基于高通量测序解析四川晒醋固态发酵过程中细菌群落变化
2021-10-29冯洁雅张桂容温雪瓶刘雪娇附俊杰四川轻化工大学生物工程学院四川宜宾644000四川省川南晒制麸醋生物酿造技术工程实验室四川宜宾644000
冯洁雅,张桂容,蔡 吉,刘 军,2,温雪瓶,2,刘雪娇,附俊杰,李 丽,2,(.四川轻化工大学生物工程学院,四川宜宾 644000;2.四川省川南晒制麸醋生物酿造技术工程实验室,四川宜宾 644000)
四川晒醋属于我国“四大名醋”[1]之一的四川麸醋,它是以麸皮、大米为主要原料,沿用历史传统秘方的酿制技艺,经蒸煮、发酵、日晒(其醋醅和醋液均需经自然条件下晒制)和陈酿四大工艺流程,20 多道工序制成,故而简称“晒醋”。具体工艺流程见图1。其产品色泽黑褐、无沉淀、香气芬芳,具有酸味醇厚、微甜爽口、回味悠长、久存不腐的特点[2−3]。距今已有160 余年的生产历史,经几代酿造技师(掌缸师)的不断探索、挖掘、整理和传承,该酿制技艺已获得“省级非物质文化遗产”的称号。
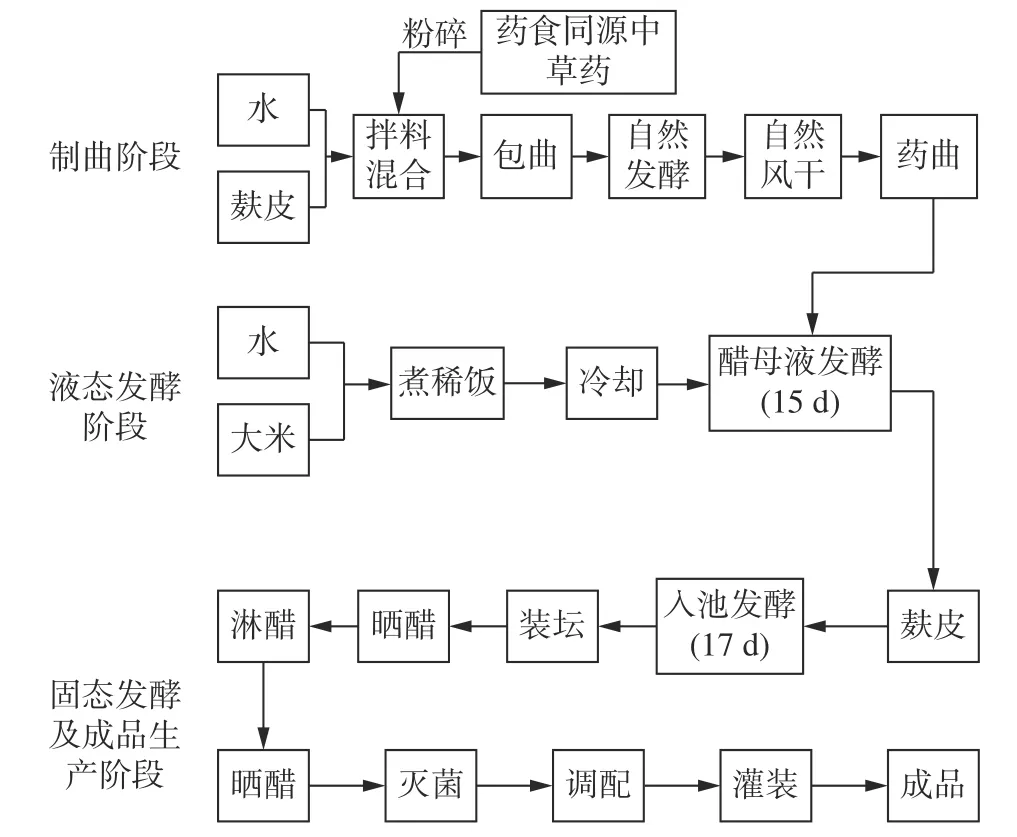
图1 四川晒醋生产工艺流程图Fig.1 Process flow chart of Sichuan Sun vinegar production
我国历史上的“四大名醋[4−10]”除了福建永春红曲醋[11]采用液态发酵外,其他三种名醋均采用固态发酵的方式;四川晒醋以麸皮为主要酿制原料,固态开放式多菌种混合接种,辅以独特的药曲配方,采用糖化、酒化、醋化同池进行(俗称:三边同池发酵)发酵,形成独特微生物群落结构,这是区别于其他食醋之根本所在[12]。但是当前对晒醋发酵过程中微生物群落结构的变化及其代谢机理的研究不足,不利于非物质文化的传承,也不利于四川晒醋的规模化生产和产品创新,因此迫切需要对四川晒醋的发酵过程进行探索,了解其微生物群落结构变化及其规律。
近年来,随着分子生态学技术的迅速发展,高通量测序技术(High-throughput sequencing)代替了传统微生物培养和分离技术,一次对样品中几十万到几百万条DNA 分子进行序列测定,可快速确定其中微生物的种类和丰度[13−15],分析速度快、结果精准,因而特别适合对复杂微生物生态系统的区系结构进行连续动态分析,在与微生物群落变化相关的所有产业领域都具有广泛的应用前景[16−18],该技术也成为了研究微生物生态的首选方法。
综合目前国内对食醋的研究状况分析[19−26],利用高通量测序技术对四川晒醋的研究还未见报道,且尚无对四川晒醋微生物群落分析的研究,尤其是对四川晒醋的微生物群落变化、功能菌等方面的研究。因此,利用高通量测序技术研究四川晒醋微生物群落结构变化及其规律,为了解微生物群落结构的多样性,探索优势微生物及其代谢机理提供了理论基础,也为四川晒醋的改革和行业发展提供帮助。
1 材料与方法
1.1 材料与仪器
固态发酵过程中的醋醅 取自四川某晒醋厂,取样时间以隔天取样计,分别为1、3、5、7、9、11、13、15、17 d,共9 个样品(分别标记为P1,P3,…P17)。每个样本采用三点取样,如图2 所示,将上面的三个样本混合均匀,取500 g 样本用无菌塑料袋收集,低温运回实验室,并于−20 ℃冰箱保存。

图2 醋醅取样点分布图Fig.2 Distribution of sampling sites in Cupei
DNA Marker 大连Takara 公司;细菌DNA 提取试剂盒 杭州新景生物试剂开发有限公司;OmegaDNA 提取试剂盒、10×PBS 缓冲液(pH7.4)北京全式金生物技术有限公司;Q5®High-Fidelity DNA Polymerase 北 京 NEB 公 司;Quant-iT PicoGreen dsDNA Assay Kit 赛默飞公司;TE412-L 精密电子天平 北京赛多利斯仪器公司;AT-710 电位自动滴定计 日本精度电子制造有限公司;MT-5000 pH 计 上海三本环保科技有限公司;Eppendorf N13462C 移液器 德国Eppendorf 公司;Illumina MiSeq 测序仪 美 国 Illumina 公 司;2720 型PCR 仪 ABI 公司;DYY-6C 电泳仪 北京六一仪器厂;BioTek ELx800 酶标仪 美国Biotek;TGL 高速冷冻离心机 长沙湘仪仪器有限公司;Agilent 5977B 高效液相色谱仪、7890A-5975B 高效气相色谱质谱仪 安捷伦(中国)公司。
1.2 实验方法
1.2.1 理化指标测定
1.2.1.1 温度的测定 在发酵池中用温度计每天早晚各检测一次,取平均值[27]。
1.2.1.2 pH 测定 取10 g 醋醅样品加入30 mL 水中混匀后,用pH 计测定滤液pH[4]。
1.2.1.3 酸度测定 酸度的测定参照GB 5009.239-2016 食品安全国家标准 食品酸度的测定。
1.2.1.4 还原糖测定 采用3,5-二硝基水杨酸盐法[28]。
标准曲线的绘制:首先分别取葡萄糖标准溶液(1 mg/mL)0、0.2、0.4、0.6、0.8、1.0 mL 于带刻度的试管中,用蒸馏水补足至1.0 mL,分别加入DNS 溶液2 mL,煮沸2 min,冷却后用水补足至10 mL 刻度线,在540 nm 下测定吸光度,以葡萄糖浓度为横坐标,吸光值(A)为纵坐标,绘制标准曲线。
样品前处理:称5 g 样品加100 mL 水,浸泡30 min,过滤。
样品测定:取上述滤液1 mL,加入DNS 溶液2 mL,煮沸2 min,冷却后用水补足至10 mL 刻度线,在540 nm 下测定吸光度。根据标准曲线换算还原糖含量,表示为(mg 葡萄糖/mL)。计算公式如下:
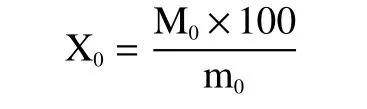
式中:X0为样品中还原糖的含量(以葡萄糖计),mg/g;M0为称取的样品质量,g;M0为由样品液吸光度从葡萄糖标准曲线中查得的葡萄糖浓度,mg/mL;100 为样品中加入水的体积。
1.2.1.5 游离氨基氮测定 采用GB/T 5009.39-2003酱油卫生标准的分析方法中的甲醛滴定法。
样品前处理:称取5 g 样品加100 mL 水,浸泡30 min,过滤。
吸取5.0 mL 上述样品稀释液,置于100 mL 容量瓶中,加水至刻度,混匀后吸取20.0 mL,置于200 mL烧杯中,加入60 mL 水,开动磁力搅拌器,转速为1000 r/min,用氢氧化钠标准溶液(0.05 mol/L)滴定至pH8.2,记下消耗的氢氧化钠体积。向其中加入甲醛溶液10.0 mL,混匀后,继续滴定至pH9.2,记录下消耗氢氧化钠标准滴定溶液的体积。同时取80 mL水,先用氢氧化钠溶液(0.05 mol/L)调节pH 为8.2,再加入10.0 mL 甲醛溶液,用氢氧化钠标准滴定溶液(0.05 mol/L)滴定至pH9.2,同时做空白试验。计算公式如下:

式中:X 为样品中氨基酸态氮的含量(以氨计),g/kg;V 为滴定样品稀释液消耗0.05 mol/L 氢氧化钠标准滴定溶液的体积,mL;V0为空白试样消耗0.05 mol/L 氢氧化钠标准滴定溶液的体积,mL;V1为样品稀释液取用量,mL;c 为氢氧化钠标准滴定溶液浓度,mol/L;0.014 为1.00 mL 氢氧化钠标准滴定溶液[c(NaOH)=1.000 mol/L]相当于氨的质量,g。
1.2.2 乳酸和乙酸含量测定
1.2.2.1 样品处理 称取10 g 醋醅,加30 mL 超纯水浸泡3 h,过滤后取滤液25 mL 并加入1 mL的亚铁氰化钾溶液(106 g/L)和1 mL的硫酸锌(300 g/L)溶液,用超纯水定容至100 mL,混匀后静置1 h,取上清液过0.22 μm 滤膜,弃去初滤液,取续滤液供HPLC 分析用[29]。
1.2.2.2 高效液相色谱条件 色谱柱Venusil MP C18(4.6 mm×250 mm,5 μm);流动相:20 mmol/L NaH2PO4(pH2.7),比例为100%;流速:0.5 mL/min;进样体积:10 μL;柱温:30 ℃;紫外检测器波长:210 nm。
1.2.2.3 标准曲线及线性回归方程 分别精确称取乳酸和乙酸标品10 mg 溶于10 mL 超纯水中,混匀后作为母液,依次从母液中取0、2、4、6、8、10 mL,分别定容到10 mL,使得终浓度依次为0、0.2、0.4、0.6、0.8、1.0 mg/mL,在相同的色谱条件下进样,绘制标准曲线[30]。
1.2.2.4 定量方法 根据标准品的出峰时间和出峰面积对样品进行定性和定量分析。
1.2.3 乙醇含量测定
1.2.3.1 样品处理 分别称取醋醅固体样品2 g 置于10 mL的顶空萃取瓶中,加入2.5 g NaCl 进行饱和,同时加入15 μL(8.4×10−4mg/L)的2-辛醇作为内标,根据峰面积比对进行定量;萃取瓶于50 ℃水浴预热10 min,萃取针经230 ℃老化处理30 min 后插入萃取瓶,保持50 ℃恒温水浴条件下萃取40 min,之后将萃取针插入GC-MS 分析仪进样口,解析5 min,采集样品数据[30]。
1.2.3.2 色谱条件 色谱柱DB-WAX(60 m×250 μm×0.25 μm);载气为高纯He,流速1 mL/min,进样口温度230 ℃;程序升温:初始温度35 ℃保持1 min,然后以5 ℃/min 升至130 ℃保持1 min,再以5 ℃/min升至150 ℃保持2 min,最后以8 ℃/min 升至230 ℃保持1 min,总共运行时间为38 min。
1.2.3.3 质谱条件 电子电离源(EI),70 eV 电子能量,采集模式为全扫描,质量范围20~550 u,离子源温度230 ℃,四级杆温度150 ℃。
1.2.4 总DNA 提取及扩增
1.2.4.1 样品预处理 取2 g 醋醅样品于20 mL 10×PBS 缓冲液(pH7.4)中悬浮,在振荡器上充分振荡5 min,离心5 min(500×g,4 ℃)后收集上清液,将沉淀继续用PBS 缓冲液洗涤两次后收集上清液,将所有上清液再次离心10 min(12000×g,4 ℃),收集沉淀,用1 mL 10×PBS 缓冲液重悬沉淀转入1.5 mL的PE 管中,−20 ℃保存[31]。
1.2.4.2 DNA 提取 根据Omega 试剂盒的使用说明书,对样品进行总DNA的提取,将获得的总DNA 通过1.2%琼脂糖凝胶进行电泳检测,同时采用紫外分光光度计对回收后的DNA 进行定量。琼脂糖凝胶电泳检测参数如下:Marker 上样量5 μL,样品上样量5 μL,电泳时间20 min,琼脂糖浓度1.20%,电压120 V,恒压,电流约80 mA。
1.2.4.3 PCR 扩增及测序 采用通用引物P1(ACTCC TACGGGAGGCAGCA)和P2(GGACTACHVGGGT WTCTAAT)对细菌16S rRNA 基因进行扩增。
PCR 样品均匀稀释至20 ng/L,扩增体系(25 μL):5×reaction Buffer 5 μL,5×GC Buffer 5 μL,dNTP(2.5 mmol/L)2 μL,Forward primer(10 μmol/L)1 μL,Reverse primer(10 μmol/L)1 μL,DNA Template 2 μL,ddH2O 8.75 μL,Q5 DNA Polymerase 0.25 μL。
扩增条件:98 ℃预变性2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s(30 次循环),最后72 ℃延伸10 min。随后扩增子送上海派森诺生物技术有限公司的Illumina MiSeq 平台(Illumina,San Diego,CA,USA)上进行测序[32−35]。
1.3 数据处理
通过QIIME(Quantitative Insights Into Microbial Ecology,v1.8.0,http://qiime.org/)软件,剔除疑问序列以及统计数,对所获得的序列按97%的序列相似度进行归并和OTU 划分,删除丰度值小于0.001%的OTU,采用Silva 数据库(Release132,http://www.arb-silva.de)[20]对OTU 进行分类鉴定。然后利用R 软件绘制带有各种分类信息的柱状图,直观比较不同样本OTU 数量和分类状态识别结果的差异。使用SPSS 软件(SPSS 软件,中国上海)进行数据处理。使用ORIGIN(OriginLab)对曲线进行分析。
2 结果与分析
2.1 理化指标的动态分析
醋醅固态发酵周期是17 d,在整个发酵过程中理化指标的变化如图3 所示,发酵初期温度为27.4 ℃,结合理化指标中温度前三天的变化,推测出由于好氧微生物的生长繁殖,导致物料内部的温度迅速上升,在第3 d 时温度迅速增长至38.2 ℃,此后温度处于缓慢上升的趋势,直至第9 d 温度达到最高点44.4 ℃;之后随着时间的延长,温度处于缓慢下降的趋势,这是由于好氧微生物的缓慢衰亡,厌氧微生物出现生长,因此温度仍然处于37 ℃左右。
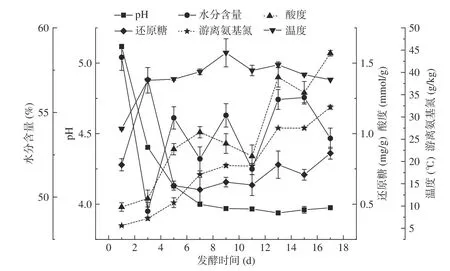
图3 四川晒醋固态发酵过程中各理化指标的动态变化图Fig.3 Dynamic changes of physicochemical indexes during the solid-state fermentation of Sichuan Sun vinegar
水分是保持微生物生长较重要的因素之一,发酵前三天由于微生物的生长消耗了大量的物料,产生的热量使得物料内部的水分蒸发,因此水分含量急剧下降;随着发酵的进行,微生物代谢产生的气体使得物料内部的水分含量有所增加,使得水分含量出现增加。整个发酵过程中,水分含量保持在49.2%~58.3%之间波动。
由于发酵过程中酸物质的积累(发酵前7 d 酸度一直处于上升的趋势),使得发酵pH 在第1~7 d 急剧下降,之后趋于平缓(基本维持在pH3.9 左右)直到发酵结束;酸度在第7~11 d 略有小幅下降,推测是在这个阶段,物料中的酸性物质被微生物继续利用,使得酸物质减少。
发酵第1~3 d,还原糖含量急剧上升,到第5 d急剧下降,然后呈现缓慢上升趋势,这可能是由于晒醋的发酵过程与糖化、酒化、醋化同时进行,糖化主要处于整个醋酸发酵的初始阶段,在第3 d 后,在还原糖充足的情况下,微生物开始大量利用还原糖进行发酵。在整个发酵过程中,氨基酸氮的含量始终呈上升趋势,这与发酵液中产生蛋白酶的微生物密切相关,而蛋白质在蛋白酶作用后产生氨基酸等含氮物质。
2.2 醋醅发酵过程中乙酸、乳酸和乙醇的变化情况
从图4 分析可知,发酵的前7 d,乳酸和乙酸的含量都在明显升高,这一现象也与图3 中酸度升高,pH 下降的变化相吻合。同时,乳酸的含量要高于乙酸,说明发酵前期乳酸发酵占主导地位,使得乳酸含量较高;到第11 d 时乳酸被微生物利用使得含量下降。在第9 d 时乙醇含量达到最大值,随后出现下降趋势,表明乙醇开始大量被转化为乙酸,发酵开始逐渐步入以醋酸发酵为主的发酵阶段,此时乙酸含量又出现上升。由于晒醋的发酵过程同时包含糖化、酒化和醋化,因此当发酵结束时(第17 d)乙酸含量(16475.10±670.31)mg/100 g 和乳酸(14895.64±717.30)mg/100 g 含量出现了相差不大的情况。

图4 四川晒醋固态发酵过程中乙酸、乳酸和乙醇含量的动态变化图Fig.4 Dynamic changes of acetic acid,lactic acid and ethanol contents during the solid-state fermentation of Sichuan Sun vinegar
2.3 高通量测序结果分析
2.3.1 DNA的提取和扩增 醋醅样本的DNA 扩增后电泳图如图5 所示,9 个样品的9 条序列均有明显的条带出现,说明DNA 扩增成功,可以进入测序平台进行测序。
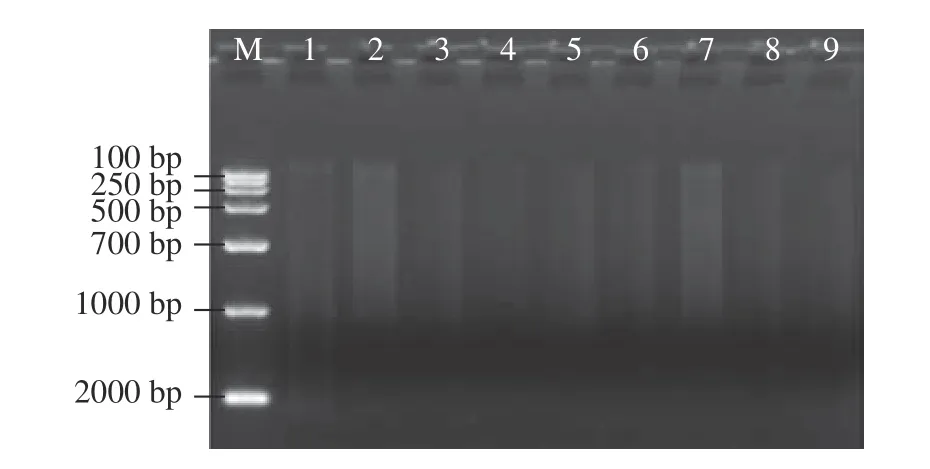
图5 DNA的扩增电泳图Fig.5 Amplification electrophoresis image of DNA
2.3.2 醋醅微生物群落测序深度评价及测序分析稀释曲线(Rarefaction curve)主要利用各醋醅在不同测序深度时的微生物Alpha 多样性指数构建曲线,以此反映各醋醅在不同测序数量时的微生物多样性。它可以用来比较测序数据量不同额醋醅中物种的丰富度、均一性或多样性,也可以用来说明醋醅的测序数据量是否合理。如图6 所示,随着测序深度的增加,OTU 数量呈上升趋势,直至趋于平缓。但第13 d的稀释曲线并没有接近饱和,说明如果测序深度继续增加,可以发现新的OTU,但上升范围逐渐稳定,从测序量可以看出本次测序已满足所需要的测序深度,测序量基本合理。
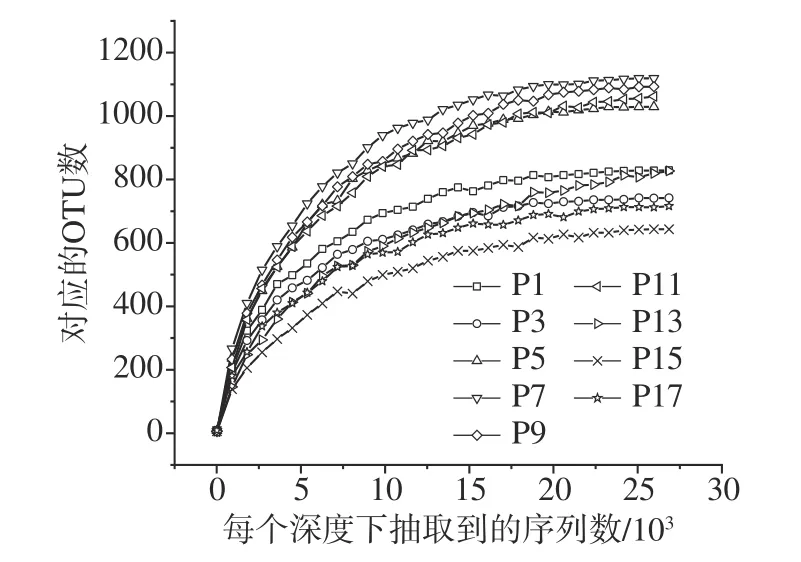
图6 四川晒醋固态发酵过程中细菌稀释曲线Fig.6 Bacterial rarefaction curve during the solidstatefermentation of Sichuan Sun vinegar
从表1 可以看出,本次测序共获得344233 条序列,序列的平均长度为394 bp,能够覆盖16S rDNA V3~V4 区域;在发酵的过程中结合五个分界来看,细菌的OTU 在发酵初期(1~3 d)略微减少,这可能是一些细菌进入发酵状态还没有适应环境,表现出下降的趋势。第3~7 d 细菌OTU 开始上升,达到高峰,第7~11 d 发酵过程中细菌OTU 总量略微下降,但差异较小。第11~15 d 细菌OTU 数量明显减少,这也证实了因酸度上升导致微生物减少的结果。

表1 不同发酵时间样品的测序量以及测序分类地位划分Table 1 Sequencing quantity of samples with different fermentation time and classification of sequencing status
2.3.3 醋醅发酵过程中微生物群落的α-多样性分析对于微生物群落来说,有多种指标可以反映其多样性,其中多样性指数包括Chao 1 指数、ACE 指数、Shannon 指数和Simpson 指数等。Chao 1 或ACE指数越大,表明群落的丰富度越高;Shannon 指数综合考虑了群落的丰富度和均匀度,且主要针对优势菌群;Simpson 指数对均匀度和群落中的优势OTU 更敏感;Shannon 指数和Simpson 指数值越高,表明群落的多样性越高。
从表2 可以看出,在整个发酵的17 d 中,Chao 1 指数在651.38~1119 之间波动变化,发酵的初始阶段,来自于醋曲和原料中的微生物不能较好的适应发酵环境,使得微生物生长出现了一个短暂的停滞,使得丰富度下降,因此P3的丰富度小于P1 丰富度;当微生物适应环境后,出现迅速的增长,因此从第3~7 d,样本丰富度上升并达到最大值1119,之后丰富度趋于平稳;在发酵的后期,由于酸物质的累积,环境中pH 下降,使得微生物生长受到抑制甚至是衰亡,导致第15~17 d 样本的丰富度显著下降。Shannon 指数在4.59~6.74 之间波动,出现先增加后下降的变化趋势,与Chao 1 指数不同之处在于发酵第3 d的多样性要高于第1 d,说明发酵初期,由原料、环境中带入了微生物,使得多样性出现了增加。在第7~9 d,由于乙酸和乙醇含量在继续上升(图4所示),使得环境中的微生物生长受到影响,进而微生物群落的多样性和丰富度也有所下降。Simpson 指数在整个发酵过程中没有出现大幅变化,说明微生物群落中优势菌群的均匀度没有太大变化。

表2 基于扩增子测序的微生物多样性指数Table 2 Microbial diversity index based on amplicon sequencing
2.3.4 分类学组成分析 由图7 可知,在整个发酵过程中,第15 d 发酵的细菌各分类水平归属于11 个门、14 个纲、36 个目、45 个科、79 个属,为所有样本中最高的,而第3 d 样本的细菌各分类水平类群数则为最低的。

图7 各分类水平的微生物类群数统计图Fig.7 Statistical diagram of microorganism groups at different taxonomic levels
在发酵第1~3 d的微生物类群处于下降阶段,第3~7 d 微生物类群处于上升,第7~9 d 处于下降,然后第9~15 d 又继续上升,第15~17 d 微生物类群又开始下降。结合前面理化指标、酸变化趋势,推测产生这种结果的原因如下:a.第1 d的醋醅中含有来自于醋曲和原料带入的微生物,使得微生物类群有较高的水平,随着发酵的进行,当中的部分微生物生长受到环境因素的改变,出现了短期的延滞,因此第3 d 微生物类群水平下降;b.随着微生物适应了发酵环境,微生物的生长处于快速增长时期,从第3~7 d,微生物类群又出现了增加的趋势;c.在发酵的第7~9 d,随着发酵环境中的乙酸、乳酸含量升高,微生物类群出现小幅下降的变化;d.随着第9~15 d 乙醇含量的降低,乙酸含量的增加,有利于酸性微生物的生长,因此微生物类群又开始上升;e.第15~17 d 微生物类群缓慢下降,有可能是进入后期,随着营养物质的消耗,酸性物质的累积,促使微生物类群减少。
由图8 可知,在整个发酵过程中,厚壁菌门(Firmicutes)在发酵前期占主导,相对丰度为53.1%,为发酵前期的优势菌群,随着时间的延长,呈逐渐下降的趋势;变形菌门(Proteobacteria)在发酵后期占主导,相对丰度为44.1%,为发酵后期的优势菌群,并随时间的延长而逐渐增加。

图8 微生物门水平上组成和丰度分布Fig.8 Microbial composition and abundance distribution
由图9 可知,发酵的第1 d,主要微生物群落为乳杆菌属(Lactobacillus),魏斯氏菌属(Weissella)和顶生雀麦菌属(Bromus_tecrorum)分别占36.8%、32.7%和14.5%,当中的乳酸杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)主要来源于醋曲,顶生雀麦菌属可能来源于发酵原料及周边环境;由丰度显示,在发酵第1 d 后顶生雀麦菌属(Bromus_tecrorum)逐渐下降到零,可推测该菌属并非是晒醋发酵过程中的主导菌属。

图9 微生物属水平上组成和丰度分布Fig.9 Microbial composition and abundance distribution
发酵第1~3 d,乳杆菌属(Lactobacillus)丰度上升至峰值,占比高达91.5%,其次还有少量的魏斯氏菌属(Weissella),占4.1%;发酵第3~7 d,虽然乳杆菌属(Lactobacillus)仍是主导菌属,但丰度有所下降。与此同时,醋杆菌属(Acetobacter)出现增长的趋势;发酵第7~9 d,乳杆菌属(Lactobacillus)逐渐增加,使得发酵过程中酸物质的积累;发酵第9~17 d 乳酸菌属(Lactobacillus)呈逐渐下降的趋势,最终相对丰度占2.3%。醋杆菌属(Acetobacter)呈上升的趋势,最终相对丰度占66.5%。由于前3 d 属于发酵前期,温度尚未达到发酵温度,且没有进行翻醅,氧气的供给量相对较少,故乳杆菌属呈现大量生长的势头;而醋杆菌属因氧气供应不足导致生长缓慢;随着醋醅发酵温度上升,为了保证发酵的正常进行需进行翻醅降温,此时供氧量增大,促使醋酸杆菌大量生长,而部分厌氧菌则因此衰亡,最终醋杆菌属成为主导菌属。
除此之外,在晒醋微生物群落分类中还发现了少量的贪铜菌属(Cupriavidus)、嗜糖假单胞菌属(Pelomonas)和鞘氨醇单胞菌属(Sphingomonas),相对丰度分别占11.8%、8.0%和3.7%。在第13 d、第15 d 和第17 d,这三类菌的占比总和相对丰度分别为46.9%、60.6%和23.5%。
2.3.5 聚类分析 系统聚类法的基本思路是将多个样品各自作为一类,然后计算各类之间距离的远近,首先将距离最近的两类合并成新的一类,然后用所得到的新一类和其他类样品再进行距离分析,将此时距离最近的再归为一类,直至将所有样品合为一大类,最终形成聚类树状图[21−22]将测序结果通过非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)进行计算,以等级树的形式展示样本间的相似度,如图10 所示。

图10 基于Weighted UniFrac 距离矩阵的UPGMA 聚类分析图Fig.10 UPGMA cluster analysis diagram based on Weighted Unifrac distance matrix
从图10 可以发现,整个发酵过程中的17 个样品中,第15~17 d 和第13 d 可以优先聚为一类,提示其菌落群落特征最大程度区别于其他几个类别的样品,这与前面分类学水平分析的结果相一致;其次是第5~11 d 可以聚为一类,其中第7~9 d 与第11 d 又继续聚为一类,这与前面的研究结果也相对应;最后是第1~3 d 聚为一类。这提示了晒醋发酵过程中菌落群落的差异,反映了各样品之间的亲缘关系强弱,为进一步揭示晒醋的发酵代谢机理奠定了基础。
3 结论
本研究采用高通量测序分析四川晒醋固态发酵阶段细菌群落变化情况,通过醋醅动态理化指标、细菌群落的分类学组成的变化和聚类分析表明,乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)为发酵过程的主要优势菌属,并初步划分了“三边同池”的时间节点,推测出发酵第1~3 d 是发酵前期;发酵第5~11 d 是发酵中期;发酵第13~17 d 是发酵后期。
此外,通过研究发现晒醋发酵后期除了醋杆菌属(Acetobacter)为优势菌属外,还有其他优势菌属,为贪铜菌属(Cupriavidus)、嗜糖假单胞菌属(Pelomonas)和鞘氨醇单胞菌属(Sphingomonas),这些菌属在其他食醋中的相关报道较少,这表明微生物多样性与发酵原料、发酵工艺、地理位置、发酵环境有很大的关系。
本研究的发现为食醋功能成分与微生物菌群的联系奠定了基础,对进一步了解四川晒醋酿造和提高食醋的品质与安全具有重要意义。
