高产β-葡萄糖苷酶酵母菌的诱变选育及对刺梨果酒香气特性的影响
2021-10-29刘晓柱张远林李银凤于志海黄名正
刘晓柱,张远林,李银凤,于志海,黄名正
(贵州理工学院食品药品制造工程学院,贵州贵阳 550000)
刺梨(Rosa roxburghiiTratt)是一种兼具营养价值和药用价值的蔷薇科(Rosaceae)蔷薇属(Rosa)植物,广泛分布于我国西南地域,如贵州、四川、重庆等[1]。目前对刺梨的研究主要集中活性成分[2]、香气特性[3]以及基因功能[4]等领域的研究,而对刺梨微生物资源的筛选、鉴定及应用等方面的研究还比较少。谢丹等[5]、刘晓柱等[6]采用高通量测序方法分析了刺梨果渣自然发酵过程中细菌群落结构和多样性的变化;刘晓柱等[7]结合了高通量测序技术鉴定了刺梨自然发酵过程中非酿酒酵母多样性变化,并采用纯培养技术从中分离到5 类可培养非酿酒酵母菌。赵湖冰等[8]、刘晓柱等[9]则深入分析了刺梨葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)的生理特性,并采用混合接种形式进行了刺梨果酒的发酵,发现接种刺梨野生酵母影响刺梨果酒的基本理化特性,并可调节刺梨果酒的香气特性。上述研究表明,刺梨果实上蕴含着丰富的微生物资源,亟待进一步深入的研究。
挥发性风味物质的种类及其含量是食品饮料的一项重要评价指标[10−11]。然而水果中的一些风味物质通常以稳定的前体形式存在,只有这些风味前体物质被水解,其芳香类配体风味物质才能被释放出来[12]。β-葡萄糖苷酶(EC3.2.1.21)是一类可水解含β-D-葡萄糖苷键底物的水解酶,能够释放出具有香气特性游离糖苷配体,促进香气物质的产生,被广泛用于果汁、果酒等食品领域的增香[13−15]。β-葡萄糖苷酶普遍存在于微生物细胞中,具有酶活性高、底物特异性强、易纯化等特点,近年来受到广泛的关注[16]。但目前分析β-葡萄糖苷酶对刺梨果酒香气特性影响方面的研究还比较少。
课题组前期从“贵农五号”刺梨果实上分离保存的酵母菌资源库中筛选到一株产β -葡萄糖苷酶异常威克汉姆酵母(Wickerhamomyces anomalus)。化学诱变因其诱变率高、操作简单而被广泛用于各类微生物的选育研究中[17]。本研究采用化学诱变方法对一株产β-葡萄糖苷酶W.anomalus菌株进行化学诱变,进一步提高其β-葡萄糖苷酶活性。将该菌株及其诱变高产β -葡萄糖苷酶菌株用于发酵刺梨果酒,顶空固相微萃取-气相质谱联用法检测刺梨果酒挥发性香气成分,进而分析β -葡萄糖苷酶对刺梨果酒香气特性的影响。
1 材料与方法
1.1 材料与仪器
W.anomalusC4 菌株分离于“贵农五号”刺梨,保存于本实验室;酿酒酵母ZYMAFLORE X16(S.cerevisiaeX16) 法国LAFFORT 公司;对硝基苯基-β-D 吡喃葡萄糖苷(p-nitrophenyl-D-glucopyranoside,p-NPG)、对硝基苯酚木糖苷(p-nitrophenolxyloside,p-NPX)、对硝基苯酚阿拉伯呋喃糖苷(pnitrophenolarabinoglycoside,p-NPAG)、对硝基苯酚鼠李糖苷(p-nitrophenolrhamnoside,p-NPR)、甲基磺酸乙酯(ethylmethanesulfonate,EMS)、环己酮 分析纯,上海源叶生物科技有限公司;果胶酶(食品级,500 U/mg)、偏重亚硫酸钾(食品级)、蛋白胨、酵母粉、葡萄糖以及其它常规试剂 试剂纯,贵州博奥瑞杰生物科技有限公司。
GR60DA 型高压蒸汽灭菌锅 北京盛科信德科技有限公司;H5300 型紫外分光光度计 日本日立公司;雷磁PHSJ-3F 型pH 仪 上海仪电科学仪器股份有限公司;ZD-85A 型恒温摇床 常州朗越仪器制造有限公司;DHP-420 型恒温培养箱 天津天泰仪器有限公司;SA402B 型电子舌味觉分析系统 日本INSENT 公司;TQ8040NX 型气相质谱联用仪日本岛津仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制 YPD 培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,固体培养基另加入琼脂粉20 g/L,pH 自然,115 ℃,0.1 MPa 灭菌30 min,备用。
马铃薯葡糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g/L,葡萄糖20 g/L,pH 自然,115 ℃,0.1 MPa 灭菌30 min,备用。
1.2.2 菌株活化 将−80 ℃保存的W.anomalusC4菌株、S.cerevisiaeX16 菌株划线于YPD 固体培养基,28 ℃恒温倒置培养48 h,4 ℃保存,用于菌株的诱变及刺梨果酒的发酵。
1.2.3 生长曲线测定 菌株生长曲线的测定参考刘晓柱等[9]方法,以S.cerevisiaeX16 菌株为对照,每组平行重复3 次。
1.2.4 菌株化学诱变 取对数生长期的W.anomalusC4 菌株培养液,4000 r/min 离心收集菌体细胞,生理盐水洗涤2 次,菌体细胞悬浮于生理盐水中使其浓度为108CFU/mL。
参考温智慧等[18]方法对W.anomalusC4 菌株进行化学诱变。取制备好的W.anomalusC4 菌悬液,加入EMS 使其终浓度分别为0%、1%、2%、3%。28 ℃温育1 h。4000 r/min 离心收集细胞,弃上清至废液收集瓶中。重悬细胞于5%硫代硫酸钠溶液中,洗涤2 次,然后再把菌体悬浮于生理盐水中,并稀释成10−1~10−5浓度,涂布于YPD 固体培养基上,28 ℃恒温倒置培养48 h,计算EMS 诱变致死率。致死率(%)=(对照组菌落数−处理组菌落数)/对照组菌落数。
1.2.5 突变菌株筛选 初筛:将EMS 诱变后的W.anomalusC4 菌株单克隆,挑至以p-NPG 为底物的96 孔板PDA 培养基中,28 ℃培养72 h,加入1 mol/L Na2CO3终止反应,观察各孔显色情况,挑选颜色较深的菌落继续进行复筛检测。
复筛:挑取初筛显色较深的W.anomalusC4 菌株单克隆至YPD 液体培养基中,28 ℃,180 r/min 培养72 h,4000 r/min 离心收集上清液,作为粗酶液,用于测定菌株糖苷酶活性。
1.2.6 糖苷酶活性测定β-葡萄糖苷酶活性测定按照参考文献方法[19]进行。酶活力单位(U)定义为pH5.0、50 ℃条件下,1 min 水解p-NPG 产生1 μmol p-NP 所需酶量。
分别取300 μL 粗酶液于1.5 mL 离心管中,a.加入100 μL p-NPX、37 ℃反应1 h,加入1 mol/L Na2CO3终止反应,静置5 min,400 nm 处测定OD 值,计算菌株β-D-木糖苷酶活性;b.加入300 μL p-NPAG 底物溶液,37 ℃反应30 min,加入1 mol/L Na2CO3终止反应,静置15 min,405 nm 处测量OD 值,计算菌株α-L-阿拉伯呋喃糖苷酶活性;c.加入150 μL p-NPR,45 ℃水浴保温20 min,加入 1 mol/L Na2CO3溶液终止反应,静置15 min、测量OD405值,计算菌株α-L-鼠李糖苷酶活性。
相对酶活(relative enzyme activity,REA)计算如公式1 所示:

式中:EAs,各实验组酶活;EAc,各对照组酶活。
突变菌株的酶活测定实验中,以突变前菌株的酶活为对照;
1.2.7 菌株遗传稳定性实验 将诱变后产β-葡萄糖苷酶菌株接种于YPD 液体培养基中,连续培养8 代,每一代培养条件为:28 ℃,180 r/min,培养72 h,以第一代菌株的酶活为对照,按照1.2.6 方法测定各代菌株β-葡萄糖苷酶的相对活性。
1.2.8 不同酵母菌发酵刺梨果酒的制备 取新鲜成熟刺梨,榨汁,加入100 mg/L的偏重亚硫酸钾、20 mg/L的果胶酶过夜处理,加入白砂糖调整糖度至24°Brix,分成五组,置于2 L 无菌三角瓶中,每组平行重复三次。第一组(S.cerevisiaeX16 组):接种107CFU/mL的S.cerevisiaeX16;第二组(W.anomalusC4 组):接种108CFU/mL的W.anomalusC4 酵母;第三组(W.anomalusE3 组):接种108CFU/mL的W.anomalusE3酵母;第四组(S.cerevisiaeX16+W.anomalusC4 组):同时接种108CFU/mL的W.anomalusC4 菌株和107CFU/mL的S.cerevisiaeX16;第五组(S.cerevisiaeX16+W.anomalusE3 组):同时接种108CFU/mL的W.anomalusE3 菌株和107CFU/mL的S.cerevisiaeX16 菌株。各组于25 ℃恒温静置发酵。发酵结束后,取刺梨原酒,5000 r/m 离心10 min,取上清用于各种指标检测。
1.2.9 刺梨果酒相关指标的测定
1.2.9.1β-葡萄糖苷酶活性的测定 在刺梨果酒发酵过程中,于发酵第0、2、4、6、8、10、12、14、16 d 分别取样,以第10 d的酶活为对照,采用1.2.6 方法检测刺梨果酒发酵过程中β-葡萄糖苷酶相对酶活的变化。
1.2.9.2 刺梨果酒基本理化指标的测定 刺梨果酒酒精度、总糖、总酸、挥发酸含量的测定采用酒类国际检测分析方法进行[20];pH 测定采用pH 计进行。
1.2.9.3 刺梨果酒感官特性的测定 量取各组刺梨酒80 mL,加入至电子舌专用烧杯中,按照电子舌系统仪器使用说明书对各组刺梨果酒进行检测。采样时间为120 s,采样速度为1 次/s,每个样品平行测定3 次,每个平行重复采集4 次[8]。
1.2.9.4 刺梨果酒挥发性香气物质的测定[21]量取8 mL 各组刺梨果酒,加入1.0 g NaCl、50 μL 环己酮内标(273.5 mg/L),密封置于45 ℃水浴中,平衡30 min。插入固相微萃取头对挥发性香气成分进行顶空萃取,萃取结束后,将萃取头插入GC 进样口进行挥发性香气成分的解吸附。
GC 条件:进样口温度240 ℃,进样时间2 min,不分流进样,载气为氦气,恒线速度模式(35 cm/s),吹扫流速3 mL/min,分流比20:1。色谱柱为InertCap Wax 毛细管柱(60 m×0.25 mm×0.25 μm),升温程序40 ℃保持3 min,3 ℃/min 升至230 ℃,保持8 min。
MS 条件为:EI 离子源,电子能量70 eV,离子源温度200 ℃,接口温度250 ℃,全扫描模式(Q3 Scan),溶剂延迟2 min。
挥发性成分经GC-MS 分析后,通过与美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)谱库进行匹配,从而对挥发性成分进行定性分析;挥发性成分的定量分析采用内标法,计算公式如公式2 所示:

式中:As,内标物的峰面积;Ai,未知物的峰面积;ρs,内标物的质量浓度,μg/mL;ρi,未知物的质量浓度,μg/mL。
香气活力值的计算:查阅各挥发性香气成分阈值,计算各香气成分风味活性值(odour activity value,OAV)。计算公式如公式3 所示:

式中:Ci为香气成分质量浓度,μg/mL;OTi为香气成分阈值,mg/L。
1.3 数据分析
Excel 2010 对数据进行处理和作图;数据结果以平均值±标准差表示,SPSS 21.0 对数据进行显著性分析;P<0.05 为差异有统计学意义。
2 结果与分析
2.1 菌株生长曲线
W.anomalusC4 菌株的生长曲线如图1 所示,包含了适应期、对数生长期和稳定期。其中0~4 h 为适应期,4~20 h 为对数生长期,20 h 以后为稳定期。因此,本实验选择细胞生长旺盛的对数生长中期(12 h)进行EMS 化学诱变实验。

图1 W.anomalus C4 菌株生长曲线Fig.1 Growth curves of W.anomalus C4
2.2 诱变浓度的选择
不同浓度诱变剂EMS 对W.anomalusC4 菌株致死率如图2 所示,随着EMS 浓度增加,菌株致死率增大。EMS 浓度为1%时,菌株致死率为81%,浓度为2%时,致死率达到93%,而3%的EMS 致死率达到100%。通常情况下,75%~85%的致死率,正突变率较高,有利于筛选到优良性状菌株[22]。因此本研究选择1%的EMS 作为诱变浓度。

图2 不同浓度EMS 对W.anomalus C4 菌株致死率影响Fig.2 Effects of different concentrations of EMS on the fatality rate of W.anomalus C4
2.3 突变菌株的筛选
采用p-NPG 法对EMS 诱变的W.anomalusC4 菌株进行筛选,得到三株β-葡萄糖苷酶酶活性较高菌株,编号为D7、E3、F7的酶活为(48.96±0.95)、(55.05±0.74)、(54.25±0.26)U/L(图3)。其中E3 菌株酶活最高,较出发菌株W.anomalusC4(41.80±0.25)U/L 提高了31.70%,因而选择E3 菌株做后续分析。

图3 三株突变菌株β-葡萄糖苷酶活性Fig.3 β-glucosidase activity of three mutant strains
与出发菌株W.anomalusC4 相比,EMS 诱变明显提高了W.anomalusE3 菌株的β-葡萄糖苷酶活性。W.anomalusE3 菌株的α-L-阿拉伯呋喃糖苷酶、β-D-木糖苷酶以及α-L-鼠李糖苷酶活性与亲本W.anomalusC4 菌株相比,没有显著差别(图4)。

图4 W.anomalus E3 菌株糖苷酶活性分析Fig.4 Analysis of glucosidase production of W.anomalus E3 strain
2.4 突变菌株遗传稳定性分析
将W.anomalusE3 菌株传代培养,各代菌株β-葡萄糖苷酶活性如图5 所示,菌株W.anomalusE3 传至8 代,各代菌株的β-葡萄糖苷酶均保持着较高的活性,且与亲本菌株W.anomalusC4 之间无显著性差异,因此菌株产β-葡萄糖苷酶遗传稳定性较好。
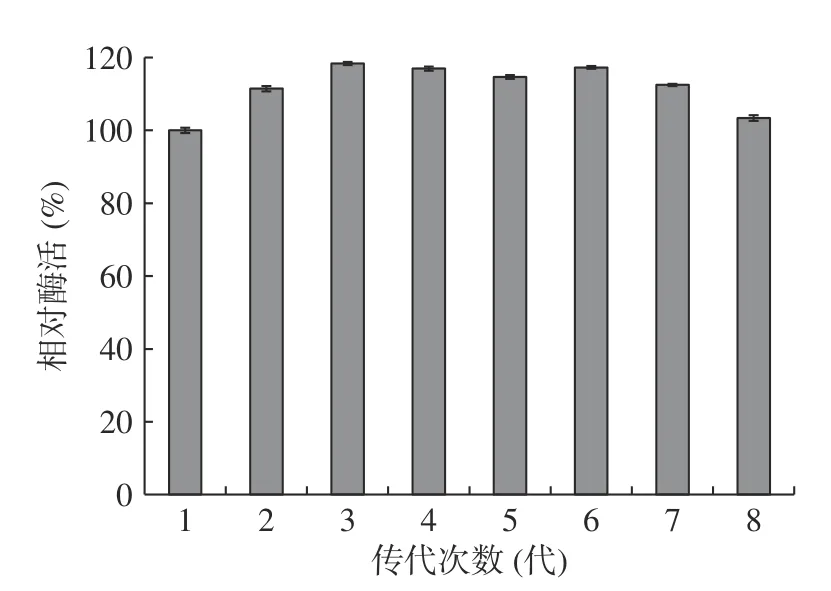
图5 W.anomalus E3 菌株β-葡萄糖苷酶稳定性分析Fig.5 Stability analysis of β-glucosidase production of W.anomalus E3
2.5 W.anomalus E3 菌株对刺梨果酒品质影响
2.5.1β-葡萄糖苷酶活性变化 刺梨果酒发酵过程中,β-葡萄糖苷酶活性变化如图6 所示,在发酵的前10 d,β-葡萄糖苷酶活性逐渐增加,第10 d 达到最大值。接着,β-葡萄糖苷酶活性迅速降低,直至发酵终点。我们的前期研究发现,低于10%(V/V)的乙醇可提高β-葡萄糖苷酶活性,而高于10%(V/V)的乙醇则抑制β-葡萄糖苷酶活性[23]。因而在刺梨果酒发酵第10 d,其发酵液中乙醇浓度可能为10%(V/V)左右,故β-葡萄糖苷酶活性达到最大值。随着发酵的不断进行,发酵液中乙醇浓度继续增大,则反过来抑制β-葡萄糖苷酶活性。当然,其它因素也可能影响β-葡萄糖苷酶活性,如发酵液中葡萄糖也可调节β-葡萄糖苷酶的活性,随着发酵的不断进行,葡萄糖被不断分解利用,其抑制效果逐渐被解除,β-葡萄糖苷酶活性逐渐增大,在发酵第10 d 葡萄糖等营养逐渐被耗尽,菌体活性受到影响,故而β-葡萄糖苷酶活性逐渐降低。

图6 刺梨果酒发酵过程中β-葡萄糖苷酶活性变化分析Fig.6 Changes of β-glucosidase activity during the fermentation of Rosa roxburghii wine
2.5.2 刺梨果酒基本理化指标 各组刺梨果酒基本理化参数如表1 所示,接种W.anomalusC4、W.anomalusE3 可明显降低发酵刺梨果酒的酸度值(总酸含量、挥发酸含量和pH)以及总糖含量。研究表明,接种纯种W.anomalus可降低空心李果酒总酸含量,但混合接种发酵空心李果酒总酸含量则没有明显降低[21]。Ye 等[24]采用纯种W.anomalus以及与S.cerevisiae混合发酵的苹果酒(Cider)总酸含量也表现出明显降低的特点。推测W.anomalus菌株具有降低发酵果酒酸度特性。

表1 刺梨果酒基本理化指标值Table 1 Physical and chemical indicators of R.roxburghii wine
2.5.3 刺梨果酒电子感官特性 各组发酵刺梨果酒电子感官特性结果如图7 所示,除酸味值外,各组发酵刺梨果酒在苦味、涩味、后味、鲜味、丰富度以及咸味之间无区别。酿酒酵母发酵刺梨果酒酸度高于其它四组刺梨果酒。
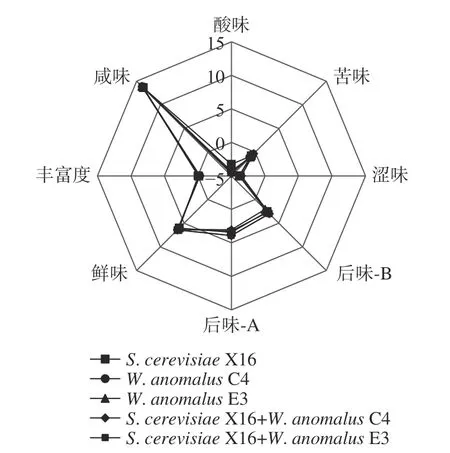
图7 刺梨果酒电子感官特性Fig.7 Electronic sensory properties of R.roxburghii wine
2.5.4 刺梨果酒挥发性香气特性 采用HS-SPMEGC-MS 方法分析了各组刺梨果酒挥发性香气物质种类与含量。S.cerevisiaeX16 发酵刺梨果酒中检测到的挥发性物质种类最少,为26 种;接种W.anomalusC4 菌株或E3 菌株发酵刺梨果酒挥发性物质种类增多,W.anomalusC4 组、W.anomalusE3 组、S.cerevisiaeX16+W.anomalusC4 组、S.cerevisiaeX16+W.anomalusE3 组分别为46、47、56、48 种。
酯类化合物为各类发酵果酒中重要的香味物质,通常具有花香和水果香[25]。接种W.anomalus可显著增加刺梨果酒中酯类香气化合物的含量,其中接种纯种W.anomalusE3 组刺梨果酒酯类香气物质含量最高。乙酸乙酯是发酵果酒中最主要的酯类香气化合物之一,具有菠萝、甜果香味,阈值150 mg/L 左右[26]。在葡萄酒中,乙酸乙酯含量在80 mg/L 左右时,可较好的赋予葡萄酒水果香味,还可以增加酒体的复杂性。采用纯种S.cerevisiaeX16 发酵生产的刺梨果酒中未检测到乙酸乙酯,而四组接种W.anomalus发酵生产的刺梨果酒中乙酸乙酯含量均显著增加,其中接种纯种W.anomalusC4 发酵的刺梨果酒中乙酸乙酯含量最高,为(33.84±2.51)mg/L。研究表明,W.anomalus是乙酸乙酯良好的生产者,某些菌株合成的乙酸乙酯高达150 mg/L。乙酸乙酯的阈值为(150~200)mg/L,但过高浓度的乙酸乙酯则使得酒体具有腐败特性[27]。本研究中,接种W.anomalus生产的刺梨果酒,其乙酸乙酯浓度为30 mg/L 左右,因而有助于增加刺梨果酒的水果香味特性。
醇类化合物由酒精发酵过程中,酵母菌代谢产生,对酒体的香气特性具有重要影响[28]。接种纯种W.anomalusC4、W.anomalusE3 菌株以及混合接种W.anomalusC4 菌株,均明显提高了刺梨果酒中醇类香气化合物的含量(图8)。但混合接种W.anomalusE3酵母,发酵刺梨果酒中醇类香味化合物未显著提高。
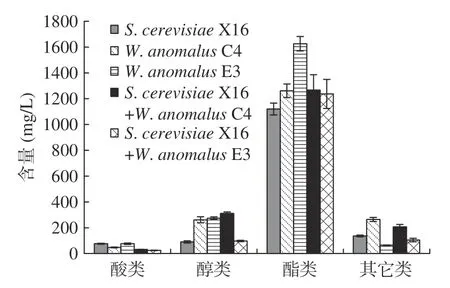
图8 刺梨果酒挥发性香气化合物含量Fig.8 Volatile aroma compounds contents of R.roxburghii wine
研究表明,提高β-葡萄糖苷酶活性可促进萜烯类化合物的释放[29]。本研究发现,与亲本W.anomalusC4菌株(0.83±0.05)mg/L 相比,化学诱变提高β-葡萄糖苷酶活性,可使W.anomalusE3 菌株(1.16±0.09)mg/L发酵刺梨果酒中芳樟醇含量提高。但接种产β-葡萄糖苷酶菌株(W.anomalusC4、E3)发酵的刺梨果酒中仅检测到芳樟醇这一种萜烯类化合物,未发现其它类的萜烯类化合物,其原因还需要做进一步的分析。
此外,接种纯种W.anomalusC4 菌株、混合接种W.anomalusC4 菌株明显提高发酵刺梨果酒中其它类化合物的含量。因而接种W.anomalusC4 菌株、E3菌株显著可增加刺梨果酒中挥发性酯类、醇类以及其它类物质含量,降低挥发性酸类物质含量(图8)。
进一步分析各组发酵刺梨果酒的主要风味化合物OAV 值,从而评价不同发酵方式对刺梨果酒香气特性贡献度[30−31]。OAV 大于1 时,表明该化合物对酒体香气贡献度突出,反之OAV 小于1,该化合物对酒体香气贡献度不突出[15]。S.cerevisiaeX16 纯种发酵刺梨果酒OAV 大于1的化合物为12 种,接种W.anomalusC4 菌株发酵刺梨果酒OAV 大于1的化合物为18 种,接种W.anomalusE3 菌株发酵刺梨果酒OAV 大于1的化合物为18 种,共同接种S.cerevisiaeX16 与W.anomalusC4 菌株发酵刺梨果酒OAV 大于1的化合物为18 种,共同接种S.cerevisiaeX16 与W.anomalusE3 菌株发酵刺梨果酒OAV 大于1的化合物为16 种。与接种S.cerevisiaeX16 组相比,接种W.anomalus可显著增加芳樟醇、正己醇、乙酸异戊酯、乙酸乙酯、乙酸己酯等香气化合物的OAV。相反,乳酸乙酯化合物的OAV 在接种W.anomalus组中明显降低表2。

表2 不同酵母发酵刺梨果酒主要风味化合物OAV 值Table 2 The odour activity values(OAVs)for main compounds of R.roxburghii wine fermentation with different yeasts
3 结论
采用化学诱变剂甲基磺酸乙酯,诱变得到一株产β-葡萄糖苷酶性能稳定,酶活为(55.05±0.74)U/L的突变菌株W.anomalusE3。与W.anomalusC4菌株相比,W.anomalusE3 菌株酶活提高了31.70%。在刺梨果酒发酵过程中,W.anomalus β-葡萄糖苷酶活性逐渐增大,第10 d 达到最大值,然后迅速降低。接种W.anomalusC4、及其突变菌株E3 可降低刺梨果酒包括总酸含量、挥发酸含量、pH 在内的酸度值以及总糖含量;同时还可增加刺梨果酒中挥发性酯类、醇类物质的种类和含量以及主要香气成分风味活性值(OAV)。因此,接种产β-葡萄糖苷酶W.anomalus菌株有助于调节刺梨果酒的香气特性,增加刺梨果酒的复杂性和丰富度。
