油茶叶提取物的5α-还原酶抑制活性及化学成分分析
2021-10-29崔心禹吴晓琴沈建福
崔心禹,夏 琛,金 蒙,苏 远,吴晓琴,沈建福
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
5α-还原酶(5α-Reductase,5α-R)是重要的雄性激素代谢酶,睾酮(Testosterone,T)在5α-还原酶(5α-R)的作用下不可逆地转化双氢睾酮(Dihydrotestosterone,DHT),过程中还要依赖还原性辅酶II(NADPH)[1−2],如图1 所示。DHT 是最强的活性雄性激素,因为它与雄性激素受体(Androgen receptor,AR)的亲和性比T 高2~5 倍,诱导AR 信号传导的效力比T 高10 倍[3−4]可引发雄性激素依赖性疾病比如痤疮、雄激素源性脱发、女性多毛症、前列腺癌、前列腺增生、假两性畸形等[5−6]。

图1 5α-R的作用机理Fig.1 Catalytic reaction process of 5α-R
5α-R 是皮肤中最重要的雄性激素代谢酶,它具有三种同工酶,其中I 型和II 型酶的特征比较清楚,二者的主要区别为5α-RI 主要存在于肝脏及非生殖器官皮肤,其发挥生理作用的最适pH 为范围较宽为6~9,而5α-RII 主要存在前列腺、睾丸、附睾、精囊、头皮毛囊等,其最适pH 为5.5[7−11]。
目前已开发的5α-R 抑制剂包括甾体类和非甾体类,最常见药物如非那雄胺、度他雄胺、爱普列特等。但这些药物存在不良反应,如代表性药物非那雄胺可能对男性造成抑郁、焦虑、认知障碍、勃起障碍、性欲减退、男性乳房女子化、肌肉生长受损等副作用[12−13],统称为非那雄胺后综合征(Post-finasteride syndrome,PFS)[14]。这些副作用是这类药物本身固有的,难以通过改造结构来消除,因此从天然植物中寻找安全、有效且来源广泛的5α-R 抑制剂替代这些化学合成的抑制剂已成为国内外研究的热点。Niederprüm 等[15]通过体外实验证实了锯叶棕果实提取物具有5α-R 抑制活性以及治疗前列腺增生的效果。Weisser 等[16]发现锯叶棕提取物IDS 89 对人前列腺上皮和间质中的5α-R 具有抑制作用,且属于非竞争性抑制,有效成分是可皂化亚组分中的月桂酸,它对上皮和基质的最大抑制率分别为52%和45%。邓桂球等[17]从雌性大鼠肝脏、雄性大鼠附睾组织中分别提取I 型、Ⅱ型5α-R,采用HPLC 法测定出红花提取物对I 型、Ⅱ型5α-R 活性均有抑制效果,抑制率分别达到88.12%和61.65%。另外也有研究报道大黄[18]非洲臀果木[19]、大荨麻[20]、薰衣草[21]、莲子心[22−23]等植物的提取物具有良好的5α-R 抑制活性,是天然来源的5α-R 抑制剂。
油茶叶是山茶科植物油茶Camellia oleifera的叶,《中华本草》中提到其味微苦,性平,有治疗鼻衄,皮肤溃烂瘙痒,疮疽的功效。罗晓伟等[24]已经证明油茶蒲具有5α-R 抑制活性,油茶叶与油茶蒲同为油茶的重要组成部分,推测油茶叶与油茶蒲可能具有类似的生物活性。本文以5α-R 为研究靶点,旨在探究油茶叶提取物对5α-R 活性的影响,探讨其成为潜在的5α-R 抑制剂的可能性,并分析其化学成分,为其在治疗雄性激素依赖型疾病如痤疮、前列腺癌等提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜采摘的油茶叶 浙江省江山市江山之间生物科技有限公司提供;SPF 级别雄性大鼠4 只,体重(200±20)g 由浙江省医学科学院提供,许可证编号SCXK(浙)2019-0002;还原型辅酶II、Bradford 蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;度他雄胺、睾酮、没食子酸、芦丁分析对照品 上海阿拉丁试剂有限公司;色谱级甲醇等有机试剂 均来自国药集团化学试剂有限公司。
Waters e2695 高效液相色谱、Acquity TM Ultra 型超高效液相色谱仪 美国Waters 公司;Luna C18(2)色谱柱(4.6 mm×250 mm,5 μm) 美国Phenomenex 公司;Ultimate UHPLC LP-C18色谱柱(2.1 mm×150 mm,1.8 μm) 上海月旭科技股份有限公司;Sciex Triple TOF 5600+四极杆飞行时间质谱仪 美国AB Sciex 公司。
1.2 实验方法
1.2.1 粗酶提取物的制备以及5α-R 含量的测定 参考张蓓[25]的方法并稍作修改,取雄性大鼠4 只,禁食不禁水过夜后脱臼处死。迅速取肝脏,剥离脂肪组织,称重,剪碎,置于烧杯,加入预冷的提酶缓冲液(提酶缓冲液[26]:0.32 mol/L 蔗 糖;0.1 mmol/L DTT;1 mmol/L EDTA;20 mmol/L 磷酸盐缓冲液pH7.4)按照1:4(w/v)的比例在冰水浴中用匀浆器匀浆,制成匀浆液,然后将其分装至离心管,在4 ℃、10000×g条件下离心20 min,除去漂浮的脂肪,取上层液体,同样条件下再离心1 h,上清液即为微粒体粗提取物。采用Bradford 法[11]对粗酶提取物定量,以其总蛋白质含量表示5α-R的含量。
1.2.2 5α-R 酶促反应体系的建立与5α-R 活性测定
1.2.2.1 T 标准曲线的制备 配制系列浓度T 溶液:5~2000 μmol/L,将不同浓度T 溶液用0.22 μm 微孔滤膜过滤至液相瓶,进入高效液相色谱仪检测,以峰面积A(AU*min)为纵坐标,以T 浓度C(μmol/L)为横坐标,绘制标准曲线。
液相色谱条件:色谱柱:LunaC18(2)柱(4.6 mm×250 mm,5 μm)不锈钢柱;柱温:30 ℃;流动相:甲醇/水70/30(V/V);流速:1.0 mL/min;检测波长:242 nm;进样体积:20 μL。
1.2.2.2 5α-R 酶促反应体系的建立 在1000 μL 测活体系中[27],将300 μL PBS 缓冲液(pH7.4)、500 μL粗酶提取物稀释液、50 μL T、50 μL 50%乙醇、100 μL NADPH 按顺序添依次加至离心管,于旋涡混合仪快速混合均匀3 s,37 ℃恒温水浴锅反应30 min,在t0时刻与t30时刻快速分别取样400 μL,快速加入800 μL 甲醇(甲醇起到失活蛋白酶的作用),涡旋5 s 终止反应[17]。上述反应液在12000 r/min离心15 min,除蛋白,取上清液,0.22 μm 有机相滤膜过滤至液相瓶,待检测。
1.2.2.3 5α-R 活性测定 HPLC 检测比较反应前t0时刻与反应后t30时刻T 峰面积的变化,液相色谱条件同1.2.2.1。将T 峰面积带入T 标准曲线,计算出相应浓度,以及T 浓度的变化量,从而实现测定5α-R的活性。设置不同的反应管包括:空白对照管(酶提取物用甲醇失活)、酶正常反应管、阳性对照管(50%乙醇换成度他雄胺溶液)。
计算公式如下:

式中,Ct0表示0 min 时T 浓度,Ct30表示30 min时T 浓度,ΔT 表示反应前后T 浓度的差值。
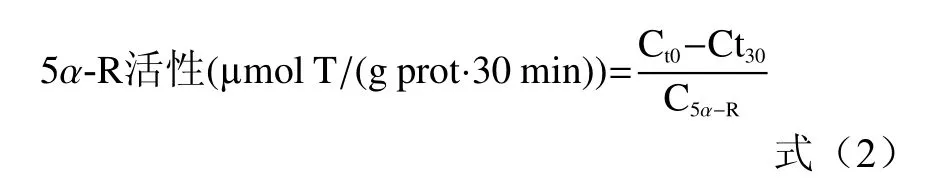
式中,定义5α-R 活性(μmol T/(g prot·30 min))为每克酶提取物每30 min 转化T的量,C5α-R(g/L)表示5α-R 粗提取物的浓度,即5α-R 粗提取物蛋白质的浓度。
1.2.3 5α-R 酶促反应体系的优化
1.2.3.1 反应体系中NADPH、T、粗酶提取物适宜添加浓度的确定 将NADPH 用PBS 配制成一系列梯度:0.5、1.0、1.5、2.0、2.5 mmol/L,采用1.2.2 中提到的5α-R 活性测定方法,在固定5α-R 提取物浓度为0.76 mg/mL、T 浓度为1 mmol/L的条件下,以5α-R 活性为指标,考察NADPH的适宜添加浓度。
将T 配制成一系列梯度:0.1、0.4、1.0、1.5、2.0 mmol/L,采用1.2.2 中提到的5α-R 活性测定方法,在固定 5α-R 提取物浓度 为 0.76 mg/mL,NADPH 浓度为2 mmol/L的条件下,以5α-R 活性为指标,考察T的适宜添加浓度。
以蛋白质浓度表示粗酶提取物的浓度,将其用PBS(pH7.4)缓冲液稀释成系列梯度:0.38、0.76、1.52、3.08、6.16 mg/mL,采用1.2.2 中提到的5α-R活性测定方法,在固定T 浓度为2 mmol/L,NADPH浓度为2 mmol/L的条件下,以5α-R 活性为指标,考察粗酶提取物的适宜添加浓度。
1.2.3.2 反应体系稳定性的考察 确定最终反应体系各个组分浓度条件:0.76 mg/mL 粗酶提取物500 μL,2 mmol/L T 50 μL,样品50 μL,2 mmol/L NADPH 100 μL,分别测定四次空白对照管和酶正常反应管的T 浓度变化,考察反应体系的重复性和稳定性,计算相对偏差RSD。
1.2.3.3 度他雄胺5α-R 抑制活性的测定 度他雄胺是Ⅰ型5α-R 抑制剂,将其为阳性药物并稀释成系列梯度:2、4、6、8、12、16 nmol/L,采用1.2.2 中提到的5α-R 活性测定方法,在适宜的NADPH 浓度、T 浓度、粗酶提取物浓度条件下,把50%乙醇溶液替换成系列浓度的度他雄胺溶液,考察不同浓度度他雄胺对5α-R 活性的抑制率,绘制抑制曲线,计算出度他雄胺对5α-R 活性的半抑制浓度(IC50),公式如下:

1.2.4 油茶提取物的制备及5α-R 抑制活性的测定
1.2.4.1 不同溶剂油茶叶提取物的制备及得率的计算 油茶叶经过挑选去除病变叶后,45 ℃烘箱干燥,粉碎过60 目筛,称取8 份20 g 油茶叶粉末按1:40(w:v)料液比分别加入水、50%乙醇溶液、甲醇、乙醇、正丁醇、乙酸乙酯、二氯甲烷、石油醚,先搅拌浸泡3 h 再于50 ℃下超声振荡提取两次(2 h/次),4000 r/min 离心10 min 使得固液分离,上清液旋转蒸发减压浓缩除去有机试剂,然后真空冷冻干燥,得到不同极性溶剂的油茶粗提取物分别记为A1~A8,观察其颜色及性状,并计算得率,计算公式如下:
式中,m 为提取物的质量(g),M 为原料干基质量(g)。
1.2.4.2 油茶叶提取物5α-R 抑制活性的测定 分别取A1~A8 冻干粉末,用50%乙醇均配制成200 μg/mL的稀释液,按照1.2.2 测定A1~A8 稀释液对5α-R的抑制率,以5α-R 抑制率为指标,确定最佳制备溶剂,并测定、计算最佳溶剂提取物对5α-R 活性的半抑制浓度(IC50),相关计算公式同公式(3)。
1.2.5 油茶提取物总酚和总黄酮含量的测定 用50%乙醇溶液将A1~A8 配制成1 mg/mL的稀释液,采用Folin-Ciocalteu 法,以没食子酸计,测定不同油茶叶提取物中的总酚含量。标准曲线的制备:配制梯度浓度的芦丁溶液0~50 μg/mL。在1 mL 体系中依次加入100 μL 没食子酸溶液,250 μL的福林酚试剂,250 μL的15%的碳酸钠溶液,再补足400 μL 水至1 mL 终体积。充分混合之后80 ℃水浴放置30 min,静置冷却10 min,4000 r/min 离心5 min,取上清液于778 nm 测定吸光值A778nm。依据没食子酸标准溶液的浓度和相应的吸光值绘制标准曲线。样品的测定:操作同上,将样品吸光值带入标准曲线,以没食子酸计,算得样品总酚含量[28]。
采用亚硝酸钠-硝酸铝-氢氧化钠显色法,以芦丁计,测定不同溶剂植物提取物中总黄酮的含量。标准曲线的制备:精密配制梯度浓度的芦丁溶液0~50 μg/mL。吸取 200 μL 待测芦丁溶液,置于5 mL试管中,加入300 μL 60%乙醇溶液,再加入100 μL亚硝酸钠溶液,摇匀,放置6 min,加入150 μL 硝酸铝溶液,摇匀,放置6 min,加入400 μL 氢氧化钠溶液,最后加入1.35 mL 60%乙醇溶液至终体系为2.5 mL,摇匀,放置15 min,于510 nm 测定吸光值A510nm。依据芦丁标准溶液的浓度和相应的吸光值绘制标准曲线。样品的测定:操作同上,将样品吸光值带入标准曲线,以芦丁计,算得样品总黄酮含量[29]。
1.2.6 油茶叶提取物化学组分的分析鉴定 参考王微[30]的方法取得8 mg 油茶叶50%乙醇提取物,加入2 mL 甲醇,配制成4 mg/mL的提取物待测液,超声5 min 后用0.22 μm 微孔滤膜过滤至液相瓶中,待测。
色谱柱:C18柱(2.1 mm×150 mm,1.8 μm);流动相:0.1%甲酸-水溶液(流动相A)和乙腈(流动相B);梯度洗脱条件:0~10 min,5%~13% B;10~20 min,13% B;20~40 min,13%~20% B;40~60 min,20%~45% B;60~70 min,45%~100% B;进样量:10 μL;流速:1 mL/min;柱温:35 ℃;检测波长:280 nm。
UPLC-Triple TOF 5600+飞行时间液质联用仪:负离子扫描模式;扫描范围:m/z 100~2000;雾化气(GS1):55 psi;雾化气(GS2):55 psi;气帘气(CUR):35 psi;离子源温度(TEM):550 ℃(负);离子源电压(IS):−4500 V(负);一级扫描:去簇电压(DP):100 V;聚焦电压(CE):10 V;二级扫描:使用TOFMS-ProductIon-IDA 模式采集质谱数据,CID 能量为20、40 和60 V,进样前,用CDS 泵做质量轴校正,使质量轴误差小于2 ppm。
1.3 数据处理
2 结果与分析
2.1 5α-R 粗酶提取物蛋白含量的测定
粗酶提取物呈现粉红色,采用Bradford 法对5α-R 粗酶提取物定量,以蛋白质含量表示。测得蛋白质含量的标准曲线为y=0.5753x+0.5269(y 为吸光值,x 为标准蛋白浓度,R2=0.9977),计算得出蛋白质浓度为12.12 mg/mL。
2.2 T的标准曲线
如图2 所示,T 在5~2000 μmol/L 范围内呈现良好的线性关系,回归方程为y=18110x+116886(R2=0.9998)。

图2 T的标准曲线Fig.2 The standard curve of T
2.3 酶促反应体系的确定
如图3 所示,在0.5~2.5 mmol/L 范围内,随着NADPH 浓度的增加,酶活性不断上升,当NADPH浓度为2 mmol/L 时再增加时对酶活性的影响不大,而且考虑到NADPH 价格昂贵,故最终选择2 mmol/L作为NADPH 在5α-R 酶促反应体系中的适宜添加浓度。如图4 所示,在0.1~2 mmol/L 范围内,随着T 浓度的增加,酶活性不断上升,选择酶活性最高时对应的2 mmol/L 作为T 在5α-R 酶促反应体系中的适宜添加浓度。如图5 所示,5α-R 提取物浓度在0.38~0.76 mg/mL 范围时,随着提取物浓度增加,酶活力逐渐上升,在浓度为0.76 mg/mL 时达到最高值,之后随着提取物浓度的增大酶活力反而降低,因此确定0.76 mg/mL 为粗酶提取物浓度在5α-R 酶促反应体系中的适宜添加浓度。

图3 NADPH 浓度对5α-R 活性的影响Fig.3 Effect of concentrations of NADPH on 5α-R activity

图4 T 浓度对5α-R 活性的影响Fig.4 The effect of concentrations of testosterone on 5α-R activity

图5 粗酶提取物浓度对5α-R 活性的影响Fig.5 Effect of concentrations of enzyme extract on 5α-R activity
最终确定的反应条件如下:pH 为7.4的磷酸盐缓冲液300 μL,添加浓度为0.76 mg/mL的粗酶提取物500 μL,添加浓度为2 mmol/L的T 50 μL,样品50 μL,添加浓度为2 mmol/L的NADPH 100 μL,反应温度为37 ℃,反应时间为30 min。
2.4 酶促反应体系的稳定性
根据2.3 确定的反应条件,分别测定四份空白对照管和酶正常反应管(同一批次)酶活性分别为(6.11±0.16)、(565.53±9.24) μmol T/(g prot·30 min),相对偏差均小于2%,说明该法可重复,此5α-R 酶促反应体系稳定强。
2.5 度他雄胺的5α-R 抑制活性
如图6 所示,当度他雄胺浓度范围为2~16 nmol/L时,阳性药物度他雄胺对5α-R的抑制作用具有量效关系,曲线拟合度良好,根据拟合曲线算得度他雄胺对5α-R的半抑制浓度(IC50)为6.24 nmol/L,有文献报道[25,31]度他雄胺对I 型5α-R的IC50等于6 nmol/L,与本测定值相近,进一步说明5α-R 酶促反应体系可靠有效。

图6 度他雄胺对5α-R的抑制曲线Fig.6 Inhibition curve of dutasteride on 5α-R
2.6 不同油茶叶提取物得率
不同极性溶剂的油茶叶提取物的得率如表1 所示,50%乙醇、甲醇、乙醇、正丁醇油茶叶提取物的得率高均超过20%,其中油茶叶50%乙醇提取物的得率最高达29.02%。这是因为该溶剂的溶解范围广,可以富集大多数的活性成分。

表1 不同极性溶剂对油茶叶提取物得率的影响Table 1 Effect of different polar solvents on the yield of Camellia oleifera leaves extracts
2.7 油茶叶不同溶剂提取物的5α-R 抑制率
根据图7 可知,200 μg/mL的油茶叶提取物对5α-R的抑制活性有影响,油茶叶石油醚提取物对其有促进作用,而其他油茶叶提取物呈现不同程度的抑制作用,其中油茶叶50%乙醇提取物对5α-R 抑制效果最明显,高达49.77%±4.43%,其次,二氯甲烷提取物和甲醇提取物对5α-R的抑制活性也较高,分别为41.26%±0.02%、36.66%±0.71%。由于油茶叶50%乙醇提取物5α-R 抑制率最高,因此最佳制备溶剂为50%乙醇,并将其提取物命名为COLE(Camellia oleiferaLeaves Extract,COLE),测得其IC50为259.56 μg/mL。已知临床上使用度他雄胺的治疗剂量为0.5 mg/d[32],经过等效换算,若以5α-R 抑制活性为指标,39.35 mg/d COLE 与度他雄胺临床剂量治疗效果相当。

图7 不同油茶叶提取物对5α-R的抑制率Fig.7 5α-R inhibition rate of different Camellia oleifera leaves extracts
2.8 油茶叶提取物的总酚和总黄酮含量及与5α-R 抑制率的相关性分析
A1~A8的总酚、总黄酮含量见表2。Pearson 相关性分析如表3 所示,A1~A8 中总酚、总黄酮含量与5α-R 抑制率相关系数分别为0.609 和0.808,即5α-R 抑制率与油茶叶提取物中总多酚含量在高度正相关(r>0.6),5α-R 抑制率与总黄酮含量存在显著的强正相关(r>0.8,P<0.05),这表明油茶叶提取物中的多酚与黄酮是抑制5α-R的重要物质。

表2 不同油茶叶提取物(A1~A8)总酚和总黄酮含量Table 2 Contents of total phenols and total flavonoids in different Camellia oleifera leaves extracts(A1~A8)

表3 油茶叶提取物的5α-R 抑制率与其总黄酮、总酚含量与之间的相关性Table 3 Correlation rate between 5α-R inhibition rate and total flavonoids,total phenolics in extracts of Camellia oleifera leaves
2.9 油茶叶提取物的化学成分分析
由上述结果可知油茶叶提取物中的多酚与黄酮可能是抑制5α-R的重要物质基础,采用UPLCTriple TOF-MS/MS 对COLE 中的酚类化合物进行定性分析,结果在COLE 中共发现22 种酚类化合物。图8 为负离子模式下的总离子图,表4 为COLE中酚类化合物鉴定结果。Richard 等[33]研究证明芦丁(IC50>100 μmol/L)、槲皮素(IC50=23 μmol/L)具有I 型5α-R 抑制活性。另外还发现儿茶素等茶多酚类物质,在无细胞状态下显示出有效的5α-R 抑制作用,但在5α-R的全细胞分析中抑制作用不明显。周琛媛等[34]在具有高5α-R 抑制活性的油茶蒲聚酰胺组Fr8 中分离纯化(采用固相萃取的方式),通过质谱和核磁共振的手段进行结构鉴定出F1 为3-O-没食子酰基-4,6,-[(S)-六羟基联苯二酰基]-α/β-D-吡喃葡萄糖(Gemin D),F4 为3,4,6-三-O-没食子酰基-α/β-D-吡喃葡萄糖(GAG)。这些物质均在COLE 中被发现,它们是COLE 发挥5α-R 抑制活性的物质基础。

图8 COLE 总离子流图(负离子模式)Fig.8 Total ion chromatogram of COLE(Negative ion mode)

表4 COLE 中酚类化合物的鉴定结果总表Table 4 Identification results of phenolic compounds from COLE
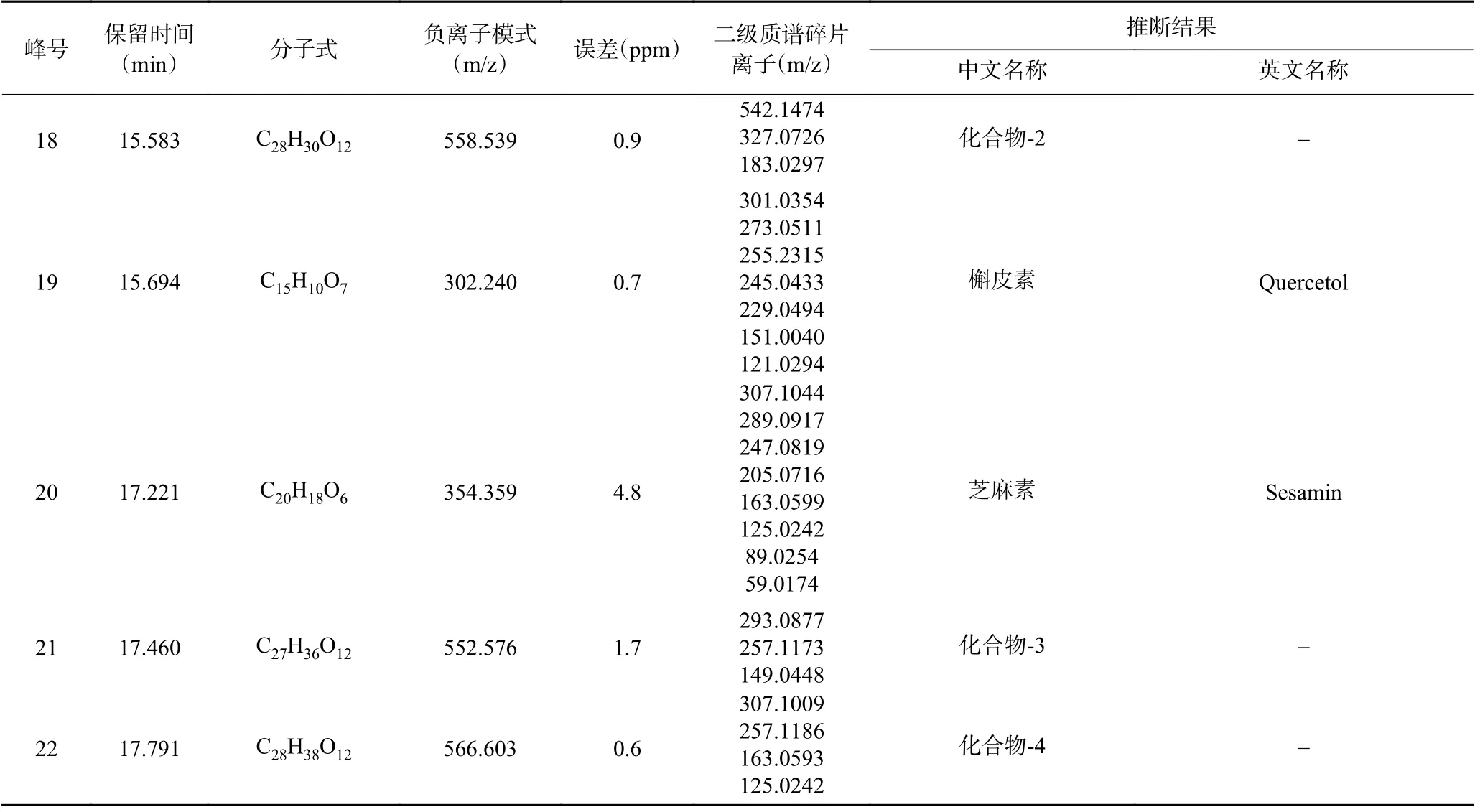
续表 4
3 结论
本研究以5α-R 为研究靶点建立酶促反应体系,通过确定粗酶提取物、NADPH、T的适宜添加浓度优化该体系,确定反应体系如下:PBS 缓冲液(pH7.4)300 μL,0.76 mg/mL的粗酶提取物500 μL,2 mmol/L的T 50 μL,样品50 μL,2 mmol/L的NADPH 100 μL,37 ℃下反应30 min。按照该体系用HPLC 法测量临床上使用的I 型5α-R 抑制剂度他雄胺的5α-R 抑制活性,结果测得其IC50为6.24 nmol/L,证实该法可靠有效。通过重复性试验证实该反应体系具有稳定性。然后用该法进一步测定、比较不同油茶叶提取物5α-R 抑制活性,其中50%乙醇油茶叶提取物的5α-R 抑制活性最高(IC50=259.56 μg/mL),证明50%乙醇油茶叶提取物是潜在的植物来源的5α-R 抑制剂。最后采用UPLC-Triple TOF-MS/MS 对油茶叶提取物中的化学成分进行了分析鉴定,结果共发现22 种酚类化合物,其中槲皮素、芦丁、儿茶素、3-O-没食子酰基-4,6,-[(S)-六羟基联苯二酰基]-α/β-D-吡喃葡萄糖(Gemin D),3,4,6-三-O-没食子酰基-α/β-D-吡喃葡萄糖可能是COLE 发挥5α-R 抑制活性的物质基础。因此本研究证明了油茶叶提取物是天然的5α-R 抑制剂,在治疗雄性激素依赖型疾病方面具有良好的应用前景。
