联合检测IL-2、IL-8和CA153在乳腺癌诊断中的价值研究
2021-10-29朱春龙张扬麟万人杰李清祥
朱春龙 张扬麟 万人杰 邓 垚 李清祥
南昌市第三医院检验科,江西南昌 330000
乳腺癌是我国女性最常见的癌症之一,肿瘤部位持续性的局部炎症因子入血后会引起血清相关细胞因子的变化,炎症相关细胞和促炎因子是其中的关键介质[1]。白细胞介素-2(interleukin-2,IL-2)是趋化因子家族中的细胞因子,IL-2 和其受体结合在肿瘤免疫应答中起着非常重要的作用。白细胞介素-8(interleukin-8,IL-8)也是趋化因子的一类,其在肿瘤组织中高表达,同样在肿瘤机体免疫应答中起关键作用。糖类抗原153(carbohydrate antigen 153,CA153)最早是由有关研究者采用杂交瘤技术从乳腺癌细胞中提取出的分化抗原,肿瘤标志物CA153 抗原可在乳腺肿瘤中呈高表达,由肿瘤微环境中的癌相关细胞释放到血液中的可溶性分子[2]。本研究探讨联合检测血清IL-2、IL-8 和CA153 在乳腺癌患者诊断中的价值,为临床提供新的诊疗思路。
1 资料与方法
1.1 一般资料
收集2019年6月至2020年12月就诊于南昌市第三医院乳腺科首次入院手术前的患者血清标本。参照美国放射学会乳腺影像报告和数据系分类标准[3]采集105 例乳腺彩超BI-RADS 4 类及以上疑似乳腺癌患者的血清,放置于-80℃冰箱储存,以乳腺癌术后病理学诊断报告为金标准,确诊为乳腺癌的65 例患者作为乳腺癌组,平均年龄(51.1±9.2)岁;40 例乳腺良性疾病患者作为乳腺良性肿瘤组,平均年龄(49.7±7.5)岁;于南昌市第三医院检查的40 名健康体检人群作为对照组,平均年龄(50.2±8.7)岁。
1.2 方法
所有研究对象IL-2、IL-8 的检测用ELISA 方法,试剂厂商为上海梵态生物公司;酶标仪器为上海赛默飞科技公司;CA153 检测方法为化学发光法,仪器试剂为西门子XP 发光仪及配套试剂。
1.3 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,三组间比较采用方差分析,若差异有统计学意义,组间两两比较采用q检验;绘制受试者工作特征(receiver operating characteristic,ROC) 曲线评价联合检测的诊断价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 三组IL-2、IL-8 和CA153 水平的比较
三组间IL-2、IL-8 和CA153 水平整体比较,差异均有统计学意义(P<0.05)。进一步两两比较显示,乳腺癌组患者的IL-2 水平低于乳腺良性肿瘤组和健康体检组,乳腺良性肿瘤组患者的IL-2 水平低于健康体检组,差异有统计学意义(P<0.05)。乳腺癌组患者的IL-8 和CA153 水平高于乳腺良性肿瘤组和健康体检组,乳腺良性肿瘤组患者的IL-8 水平高于健康体检组,差异有统计学意义(P<0.05);乳腺良性肿瘤组和健康体检组的CA153 水平比较,差异无统计学意义(P>0.05)(表1)。
表1 三组IL-2、IL-8 和CA153 水平的比较(±s)
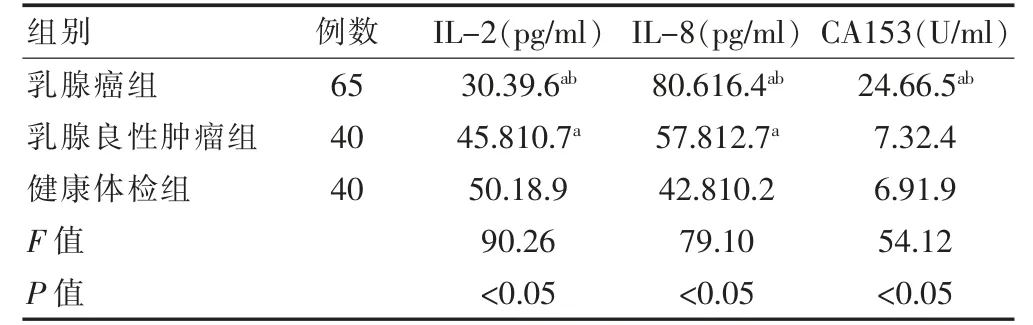
表1 三组IL-2、IL-8 和CA153 水平的比较(±s)
与健康体检组比较,aP<0.05;与乳腺良性肿瘤组比较,bP<0.05
组别例数IL-2(pg/ml) IL-8(pg/ml) CA153(U/ml)乳腺癌组乳腺良性肿瘤组健康体检组F 值P 值65 40 40 30.39.6ab 45.810.7a 50.18.9 90.26<0.05 80.616.4ab 57.812.7a 42.810.2 79.10<0.05 24.66.5ab 7.32.4 6.91.9 54.12<0.05
2.2 血清IL-2、IL-8 和CA153 单项检测及联合检测在乳腺癌中的诊断效能
根据乳腺癌和乳腺良性肿瘤各项指标比较,绘制ROC 曲线,计算诊断乳腺癌效能指标,以单因素和联合诊断的特异度、灵敏度、约登指数进行评价,计算ROC 曲线下面积(area under curve,AUC)(图1,封三)。选用约登指数(敏感性+特异性-1)最大时各指标的水平作为诊断临界值,单独检测时,IL-8 的AUC 最大。联合检测IL-2、IL-8 和CA153 用于诊断乳腺癌的灵敏度高于单独检测,特异度比单项最高值有所降低,联合检测的ROC 曲线下面积均大于各指标单独检测(表2)。

表2 血清IL-2、IL-8 和CA153 单项检测及联合检测的诊断效能
3 讨论
乳腺癌的发展和预后一直是广大学者研究前沿的方向,慢性炎症与癌症发展之间的联系得到学者广泛的认同。持续性炎症通过释放细胞因子促进肿瘤的生存、增殖、血管生成、转移和免疫逃避来促进癌症的进展[4-5],肿瘤标志物作为肿瘤发生比较特异性的指标在临床中亦得到广泛应用,炎症因子和肿瘤标志物的联合检测在乳腺癌术前早期的诊断中值得深入研究。
在机体的抗肿瘤反应中IL-2 是由活化T 淋巴细胞形成分泌的一种细胞因子,国外有学者研究检测IL-2 在乳腺癌化疗前后的临床应用价值,并提出联合检测对乳腺癌患者预后的重要性[6]。本研究结果显示,乳腺癌组患者的IL-2 水平低于乳腺良性肿瘤组和健康体检组,乳腺良性肿瘤组患者的IL-2 水平低于健康体检组,差异有统计学意义(P<0.05);单独检测时,IL-2 的特异度最高。乳腺癌患者免疫功能Th1水平低,导致IL-2 分泌不足,而乳腺癌患者sIL-2R表达常常大幅增加又消耗了IL-2,IL-2 已在临床上用于治疗乳腺肿瘤细胞,同时表现出非常有效的抗肿瘤作用,曲妥珠单抗可以通过IL-2 诱导自然杀伤细胞介导乳腺癌细胞的裂解[7]。Mani 等[7-9]使用载体乳珠蛋白启动子/增强子控制编码人IL-2 的腺病毒对乳腺癌进行基因治疗,虽然载体控制IL-2 的分泌具有明显的肿瘤生长延迟,但IL-2 治疗相关的全身毒性是一项重大挑战。
本研究结果显示,乳腺癌组患者的IL-8 水平高于乳腺良性肿瘤组和健康体检组,乳腺良性肿瘤组患者的IL-8 水平高于健康体检组,差异有统计学意义(P<0.05);单独检测时,IL-8 的AUC 最大,IL-8 预测乳腺癌的价值在单独检测中最高。有研究显示乳腺癌组织中IL-8 基因高表达,且IL-8 蛋白在乳腺癌组织中随着患者TNM 分期增加而表达增多[10-11],乳腺癌患者癌细胞的生长依赖于促炎细胞因子IL-8 分泌的表达,IL-8 促进乳腺癌细胞的增殖,同时又会抑制机体的免疫功能而导致肿瘤细胞对效应T 淋巴细胞的免疫逃逸,而且抑制IL-8 的表达可显著抑制体外的集落形成和细胞存活,抑制肿瘤的植入和体内生长。IL-8在乳腺癌中上调,并与不良预后相关,据报道,IL-8通过增加细胞侵袭、血管生成和转移来促进乳腺癌的进展[12],乳腺癌化疗期间低水平的IL-8 可有助于确定生存期延长的患者,IL-8 是患者存活率最明显的预测因子[13]。
CA153 最早是有关研究者采用杂交瘤技术从乳腺组织及乳腺癌细胞中提取出的乳房上皮细胞分化抗原,有助于肿瘤细胞黏附以及转移,CA153 在肺癌、乳腺癌、卵巢癌、胰腺癌等多种肿瘤的体液中都可检测到高表达的情况[14]。本研究结果还显示,乳腺癌组患者的CA153 水平高于乳腺良性肿瘤组和健康体检组,差异有统计学意义(P<0.05);乳腺良性肿瘤组和健康体检组的CA153 水平比较,差异无统计学意义(P>0.05)。有研究显示不同分期的乳腺癌患者CA153都可呈现升高的状态,单因素分析显示CA153 得到的结果在临床监测中比癌胚抗原(carcinoembryonic antigen,CEA)更有效地监测转移性乳腺癌患者的病程,较高的术前CA153 水平与肿瘤大小、腋窝淋巴结转移及乳腺癌的发展成显著正相关,且CA153 联合其他相关指标检测乳腺癌具有更高的检测效能,血清CA153 的水平具有预测乳腺癌患者腋窝淋巴结转移(axillary lymph node metastasis,ALNM)中的价值,术前血清CEA 和CA153 水平升高与ALNM 呈显著且独立相关[15-17]。Nicolini 等[18]研究发现CA153 相比较于CA549、CA27.29 等黏蛋白可以更好地评估乳腺癌患者化疗后的效果,并且可有效监测乳腺癌复发。
综上所述,联合检测血清IL-2、IL-8 和CA153 对于乳腺癌的筛查和诊断具有一定的临床价值,早发现、早诊断、早治疗可以使患者利益最大化,及时检测乳腺癌患者血清IL-2、IL-8 和CA153 的水平,抑制肿瘤局部炎症反应以及监测血清肿瘤标志物是监测乳腺癌患者病情进展的有效途径。
