细胞蜡块在恶性胸水诊断和个体化治疗中的应用价值
2021-10-29周兵熊基玲彭丽姿
周兵 熊基玲 彭丽姿
恶性胸腔积液(malignant pleural effusion ,MPE)为晚期恶性肿瘤临床常见的并发症之一,被认为与肿瘤的肺转移或胸部肿瘤直接胸膜侵犯有关[1]。MPE的产生往往失去手术机会而无法获得活检组织,给肿瘤的诊断及鉴别诊断带来了不小的困难[2]。既往的MPE检查多为细胞学定性诊断,仅仅能提示良恶性,往往不能确定肿瘤的原发部位,给临床的后续针对性治疗造成极大的困扰,而脱落细胞学蜡块技术在此为我们提供了一个很好的探讨方向[3]。本文收集46例MPE细胞学蜡块,并进行组织学切片和免疫组化标记,探讨细胞蜡块结合免疫组化技术在恶性胸水诊断中的作用,并分析肺腺癌恶性胸水细胞蜡块在EGFR和ALK检测在个体化治疗中应用价值。
资料与方法
一、一般资料
收集九江市第一人民医院病理科2018年6月至2020年1月确诊为MPE 46例,其中男性25例(54.3%),女性21例(45.7%),男女之比1.19:1;年龄32~84岁,平均年龄48.0±6.3岁。要求送检MPE为新鲜液体且临床病理资料齐全。
二、细胞蜡块的制片
收集制作细胞学涂片后的新鲜MPE,静置后弃上清液,充分混匀后倒入50mL的离心管,3000 rpm离心10 min,观察离心后的细胞沉渣,较少时尽可能的重复收集几次(血性MPE提前用冰醋酸处理,尽可能去除红细胞影响)。倒出上清液,10%中性甲醛固定15min,再次3000 rpm离心2 min。倒出上清液,75%及 95%酒精处理静置30min。小心用吸管或长镊轻轻刮取沉淀物,常规取材,入包埋盒自动脱水机隔夜脱水,常规石蜡包埋、切片及HE染色。
三、免疫组化染色及结果判读
细胞蜡块按3μm厚度切片,置于65℃烤箱中烘烤60min,室温冷却,既定程序脱蜡与水化,选取抗体适合的修复液(胃蛋白酶或柠檬酸)对组织抗原进行相应的修复后分别滴加一抗和二抗, DAB 显色后进行复染与制片。免疫组化抗体TTF-1、NapsinA、、CK7、p40、CK5/6、 GCDFP-15、ER、CD56、CgA、CA125、Villin、Calretinin、MC、CD20和CD3,DAB显色试剂盒,3%过氧化氢、柠檬酸、PBS等为北京中杉金桥生物技术有限公司产品。既往组织学阳性切片设阳性对照,以PBS设为阴性对照。2位高年资病理医师采用双盲法观察细胞蜡块HE形态学变化及根据抗体定位判定免疫组化标记结果,无染色或浅染色及高倍视野下阳性细胞比例低于5%判定为阴性。
四、基因检测
EGFR检测:细胞蜡块切厚度8μm白片15张,二甲苯脱蜡后梯度酒精脱水后入EP管,严格按照DNA FFPE基因抽提试剂盒(德国Qiagen公司)的说明书提取DNA样品,紫外分光光度计检测DNA纯度和浓度保持在合适范围。ARMS法:实时荧光定量PCR仪检测EGFR基因突变,EGFR试剂盒(武汉友芝友医疗公司)检测11个外显子18-21的突变,包括G719S、G719C、G719A、S768i、T790M、L858R、1861 q、外显子19缺失和外显子20三个插入突变,对过程中荧光信号强度进行实时检测和输出,实现检测结果的定性分析。参考内参基因进行解读,通过baseline划线,确定目的基因产物ct值与内参基因ct值的大小,如果ct值比内参ct值大(高出baseline的曲线),即出现该位点突变,反之则为突变阴性。
ALK检测:细胞蜡块4μm厚度切片,常规脱蜡、入无水乙醇及胃蛋白酶消化后。滴加10μL ALK双色分离探针(美国Abbott Molecular公司),原位杂交仪75 ℃变性5min,37 ℃杂交过夜,加10μL DAPI复染剂,荧光倒置显微镜观察,每个样本分析100个肿瘤细胞。细胞核≥15%细胞有红、绿信号分离(信号间距超过2个信号直径)或出现单红信号认为ALK重排阳性。
五、统计分析
结 果
一、细胞蜡块HE切片观察
细胞蜡块HE切片镜下背景为数量不等的淋巴细胞及间皮细胞,其间见多量肿瘤细胞集中分布,散在或成团簇状排列;异型肿瘤细胞结构清晰,高核浆比,核膜增厚且不规则,染色质粗,部分肿瘤细胞胞质丰富,可见明显核仁,肿瘤细胞呈片状脱落,保持有原始肿瘤组织学结构。肺腺癌呈腺腔样或乳头状(图1a);乳腺癌呈团块状、片状(图c);肺鳞状细胞癌呈巢团状、散在排列;同时肺小细胞癌、淋巴瘤及卵巢癌及间皮瘤细胞蜡块,也具有相对应的组织学结构。
二、免疫组化诊断分型
46例MPE细胞蜡块标本经免疫组化标记证实肺腺癌来源27例,占所有病例的58.7%,主要表达CK7、TTF-1(图1b)和Napsin A。乳腺癌来源6例,占所有病例的13.0%,免疫组化表达CK7、GCDFP-15(图1d)及绝大部分的ER。肺鳞状细胞癌来源4例,占所有病例的8.7%,主要表达P40和CK5/6。肺小细胞癌来源3例,占所有病例的6.5%,均表达特异性的神经内分泌标记CD56和CgA,同时TTF-1也有部分表达。淋巴瘤来源3例,占所有病例的6.5%, B细胞来源2例、T细胞淋巴瘤1例,肿瘤细胞分别表达B细胞来源的CD20和T细胞来源的CD3。卵巢癌来源2例,免疫组化表达CK7、CA125、ER及部分的Villin。间皮瘤来源1例,表达特异性间皮来源标记CR和MC,同时还表达CK5/6(见表1)。
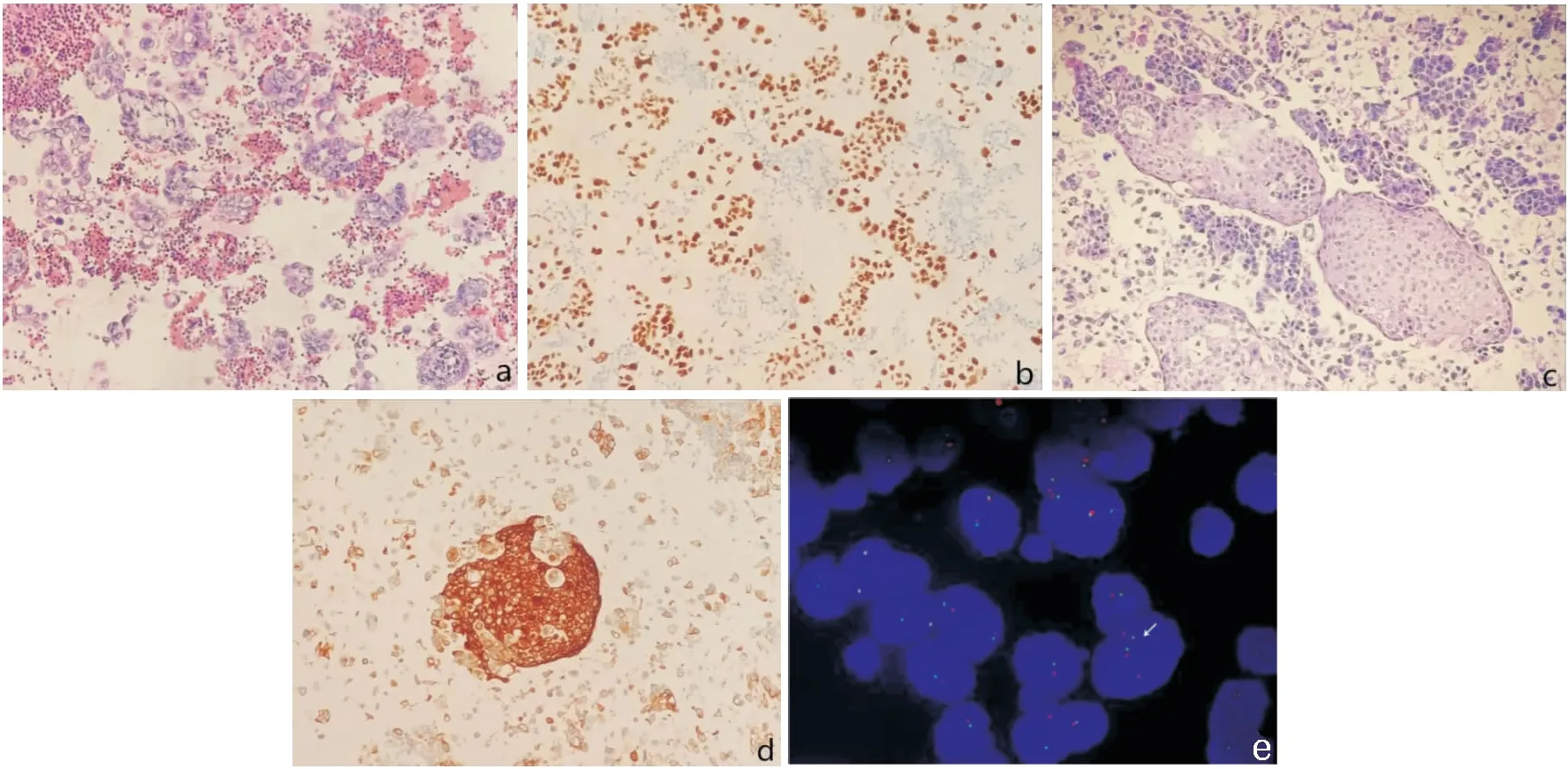
图1 MPE细胞蜡块镜下形态及免疫组化表达 a肺腺癌细胞蜡块切片(HE×100),b. 肺腺癌TTF-1(+)(EnVision×100),c. 乳腺癌细胞蜡块切片(HE×100),d. 乳腺癌GCDFP-15(+)(EnVision×100),e. ALK基因重排(+)
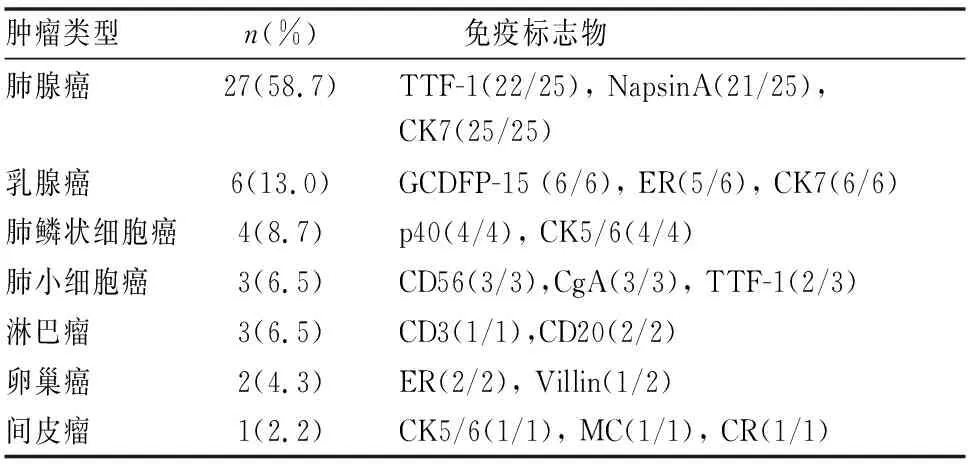
表1 细胞蜡块免疫组化结果(n=46,%)
三、基因检测
EGFR检测:21例接受基因检测的肺腺癌MPE细胞蜡块中,共检出10例(55.6%)EGFR基因突变,其中19号外显子缺失EGFR-19del突变5例(图1e),21号外显子EGFR-L858R突变4例,20号外显子ins插入突变1例,未检出其它3个18号外显子(G719S、G719C、G719A)、2个20号外显子(S768i、T790M)和21号外显子L861 q突变;突变病例中男性突变6例,年龄<60岁突变4例。
ALK检测:21例肺腺癌MPE细胞蜡块中检出2例(9.5%)ALK基因重排阳性病例(图1f),均为EGFR突变阴性病例;突变病例男女各1例,其中<60岁1例。
讨 论
当患者发生MPE时,意味着该患者已经处于绝对晚期,往往无法通过手术获得活检组织而缺乏病理诊断依据,给后续的临床治疗带来了困难[4]。传统的胸腔积液脱落细胞学涂片虽然操作简单,但由于手工操作厚薄不均,背景脏乱,给阅片造成了极大的困难,容易生成假阳性和假阴性片,极大的影响了诊断水平[5]。而脱落细胞学蜡块检查则很好的解决这一难题,蜡块HE切片厚薄一致,背景干净,干扰少,且胸腔积液能够对脱落细胞进行有效的收集,制作细胞蜡块后容易长期保存,同时可以用于免疫组化检查确定肿瘤的原发部位和分子研究材料的收集,得到国内外学者的广泛认同[6]。本研究结果显示,MPE细胞蜡块肿瘤细胞更丰富,细胞结构更清晰,各种类型肿瘤细胞都存在一定的原始肿瘤的排列方式,有助于诊断与鉴别诊断。
由于MPE细胞成分复杂,含有多量的炎症细胞、间皮细胞及组织细胞,且部分非炎症细胞结构多样,如发生反应性增生或细胞蜕变,单纯依靠细胞学或蜡块组织学,很难将其与肿瘤细胞区别开来。然而,细胞蜡块加做免疫组织化学标记能够为此提供很好的帮助,不仅能够鉴别脱落细胞的良恶性,而且在后续工作中采用免疫组化对各器官来源的肿瘤细胞进行特异性标记[7]。Wu等认为虽然脱落细胞学玻片能够较快的提供诊断信息,但细胞蜡块免疫组织化学,仍然是MPE最为重要的诊断依据[8]。本研究制作脱落细胞蜡块后免疫组织化学标记,结果显示肺腺癌作为MPE最常见的肿瘤来源,占恶性胸腔积液的一半以上,这和既往的研究结果类似,免疫组化肺II型肺泡上皮标记特异性抗体TTF-1和NapsinA被证实为最可靠的标记,两者联合应用被认为是转移性肺腺癌的确诊依据[9]。乳腺癌为MPE较为常见的肿瘤来源,绝大多数见于女性患者,联合乳腺癌特异性标记GCDFP-15及ER可以确诊。肺鳞癌为胸部常见的肿瘤,但一般为中央型且较少产生积液,联合鳞状上皮特有的标记物P40和CK5/6可以确诊。因肺小细胞癌恶性程度高且侵袭能力强,在MPE中也不少见,虽然也表达TTF-1,但是联合CD56和CgA等特异性的神经内分泌抗体和特征性的形态特点,可以很好与其它肿瘤鉴别开来;淋巴瘤来源的MPE也不少见,但要和正常的淋巴细胞相鉴别,结合既往淋巴瘤病史及异型的淋巴细胞及特异性的CD20、CD3等淋巴瘤抗体,可以鉴别和分类。卵巢癌转移至肺后,产生的MPE较少,联合应用CA125和ER抗体阳性,结合病史可以准确诊断。而胸膜原发的间皮瘤则较为罕见,表达特异性,间皮来源标记CR和MC。简而言之,免疫组化抗体的选择是要综合临床病史及细胞学形态联合选用,遇到疑难病例和抗体表达不确切时应加做标记项目,同时结合免疫组化抗体间的不同表达特点综合判断。由于肿瘤的分子检测和靶向治疗的引入,极大的改善了晚期病人的预后,因此对于细胞蜡块提出更高的要求,尽可能的多收集细胞离心制作细胞蜡块,以期获得更多的肿瘤学标本,同时我们应在满足诊断的前提下,少加做免疫组化项目,以多保留蜡块中肿瘤成分,以利于后续驱动基因检测研究[10]。
近年来,针对于EGFR突变和ALK融合基因的特定的靶向药物的引入极大地改变了晚期肺腺癌的治疗策略,但个体化治疗需要精准的驱动基因检测结果,而既往多推荐手术组织学标本,针对于晚期不能手术的病人,2018年美国临床肿瘤学协会(American Society of Clinical Oncology,ASCO)指南认为当无法获取组织学标本的前提下,脱落细胞学蜡块可以作为驱动基因的备选组织来源是合适的[11]。本研究对其中的21例肺腺癌MPE细胞蜡块完成了基因检测。EGFR基因突变率55.6%,其中以19号外显子缺失和21号外显子L858R突变最为多见,突变率和突变位点均与国内外的大部分研究结果类似,同时检出1例20号ins插入突变病例,目前针对于该突变研究较少,尚不能明确其临床意义[12]。ALK基因重排率9.5%,突变率与既往研究类似;既往研究认为ALK基因突变与年轻及女性患者有关,但本次纳入病例较少,尚不能发现相互联系[13]。
总之,细胞蜡块结合免疫组化技术应成为恶性胸水常规的检查手段,不仅能提高恶性肿瘤的诊断率,还可以判断恶性肿瘤的组织学来源;同时MPE细胞学蜡块作为合格的分子学检测样本,为晚期肺腺癌后续的针对性靶向治疗奠定了良好的基础。
