成人嗜肝病毒与间质性肺疾病的关系
2021-10-29郑俞菡陈复辉
郑俞菡 陈复辉
间质性肺疾病是200多种不同疾病的总称,虽病因各异,但其表现的临床症状、影像学和肺功能等却有某些相似之处,其发病机制、病理特征也具有某些共性。广义的来说他们分为有明确原因的和无明确原因的,具体分类如表1所示[1]。

表1 间质性肺疾病的分类(根据病因)
由于有患者临床症状出现的日期确定为病毒感染或“感冒”,因此有人认为特发性肺纤维化(interstitial pulmonary fibrosis,IPF)可能是由隐匿性病毒感染引起或加重所致的损伤表现。考虑到IPF的病理特征:肺损伤和纤维化区域的时空异质性、上皮细胞损伤、弥漫性肺泡损伤和可变炎症,有人认为病毒可能是间质性肺疾病的病因[2]。目前研究报道与间质性肺疾病相关的病毒包括:冠状病毒(如新型冠状病毒)[3-4]、流感病毒(甲型、乙型、猪流感)[4]、副流感病毒[4]、鼻病毒[4]、偏肺病毒[4]、腺病毒[2, 4-5]、柯萨奇病毒[4]、呼吸道合胞病毒[4]、肝炎病毒(如丙型肝炎病毒[2, 4-18]、托克特诺病毒[2, 5, 19-24])、人类免疫缺陷病毒[25]、嗜人T淋巴细胞病毒1型[26]、疱疹病毒(如爱泼斯坦-巴尔病毒[2, 4-5, 27]、巨细胞病毒[2, 4-5, 23, 27]、人类单纯疱疹病毒1型[2, 23]、人类疱疹病毒6型[4]、人类疱疹病毒7型[5, 23, 27]、人类疱疹病毒8型[2, 4-5, 27])。近期,通过对病毒性肝炎患者的胸部高分辨率计算机断层扫描(high resolution computerized tomography,HRCT)进行统计分析,建立了活动性肝炎和间质性肺疾病之间的轻度至中度关系[28]。目前肝炎病毒感染,在间质性肺疾病中的具体机制尚不明确,为探究嗜肝病毒与间质性肺疾病之间的关系,本文对相关研究进行了回顾。
丙型肝炎病毒
丙型肝炎病毒(hepatitis C virus, HCV)是一种嗜肝和嗜淋巴病毒,能够逃脱宿主免疫系统的监视,最终导致慢性感染。在慢性感染期间,循环免疫复合物的累积和自身免疫反应的激活可导致肝脏和肝外疾病。其中慢性丙型肝炎病毒感染会对肺部造成影响,包括引起哮喘和慢性阻塞性肺病、间质性肺炎和肺纤维化的出现,或原有肺疾病的加重。Yasuji Arase等发现与乙型肝炎病毒组相比,丙型肝炎病毒组的IPF患病率较高,其累计发病率在第10年为0.3%,在第20年为0.9%。丙型肝炎病毒患者中IPF的患病率在年龄≥55岁、吸烟指数≥20的患者和肝硬化患者中显著更高[6]。韩国一项基于全国人群的为期9年的纵向回顾性队列研究显示,吸烟、丙型肝炎、肺结核史、肺炎史、慢性阻塞性肺疾病、男性和高龄与间质性肺病的发展显著相关[8]。
关于间质性肺疾病和丙型肝炎病毒之间的联系众说纷纭:
1 有研究显示IPF患者中丙型肝炎病毒标志物的频率较高。日本的研究人员Yasuji Arase等对IPF患者体内的丙型肝炎病毒抗体进行检测,观察到IPF患者血清丙型肝炎病毒抗体的患病率(28.80%)高于对照组(3.66%)。在组织学证实的IPF患者中,丙型肝炎病毒血清抗体的患病率为29%。19名酶联免疫吸附试验阳性的患者中6名的肝功能相关参数均在正常范围内,表明IPF的抗-HCV阳性并非由肝病引起,而可能是由IPF自身引起的。日本另一研究中,Sachiko Omotani等对丙型肝炎病毒在IPF患者中发病机制通过酶联免疫吸附试验进行研究,得到了相似的结果[29]。
然而,随后在英国的一项研究中,Irving等发现丙肝病毒感染在IPF患者中并不比普通人群中更普遍,认为第一代酶联免疫吸附试验的较高假阳性以及抗原化的IgG水平可能是导致抗-HCV假阳性的原因[10]。在意大利,通过将IPF患者与其他肺部疾病患者相比,丙型肝炎病毒感染和病毒复制的患病率增加(13.3%),但抗丙型肝炎病毒抗体的水平没有差异[14]。Meliconi等认为这些结果之间的差异,可能是由于丙肝病毒感染流行的地理差异,日本和地中海国家的丙型肝炎病毒感染率较高,而北欧的感染率较低;也可能是由于对照组设置不当,自愿献血的人通常没有感染肝炎病毒的风险,而且这些人更为年轻。日本一基于医院的多中心病例对照研究中显示,IPF患者中丙肝病毒感染率与对照组之间无显著差异,与意大利的研究相比,这可能要归因于丙型肝炎病毒感染的背景率[18]。
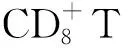
3 经干扰素治疗的慢性丙型肝炎患者伴随着IPF的进展。干扰素和利巴韦林已被用作慢性丙型肝炎感染和丙型肝炎代偿性肝硬化的标准治疗。肺毒性是公认的IFN-α并发症,被认为与其免疫刺激作用有关,其中间质性肺炎最为常见。澳大利亚的一项病例分析研究中报道,慢性丙型肝炎患者使用IFNα治疗过程中出现IPF恶化,导致疑似致命的IPF急性加重,出现了进行性低氧血症、肺功能减退及胸部HRCT显示弥漫性毛玻璃样改变,并叠加有明显恶化的双侧肺纤维化和蜂窝状改变[13]。通过将聚乙二醇干扰素α联合利巴韦林治疗慢性丙型肝炎患者组与未治疗患者组进行比较,Elhelaly等发现,治疗组中间质性肺病、支气管高反应性和慢性咳嗽显著占优势。有趣的是,在这项研究中,尽管对患者停止了聚乙二醇干扰素联合利巴韦林治疗,并使用大剂量类固醇治疗,仍有一名患者因ILD出现快速进展性气胸、纵隔气肿和严重低氧血症而死亡[9]。研究者们提出,患者的易感性(无论是遗传还是环境因素)可能导致慢性丙型肝炎患者间质性肺疾病的发生,而干扰素的治疗则通过进一步增强这种易感性,以致最终表现为疾病的发生。
Ramos-Casals等[15]发现在丙型肝炎病毒感染中,结节病可能由抗病毒治疗引起(75%的病例)或自发发生。在18名初治的患有结节病的丙型肝炎病毒感染患者中,14名(87%)肺部受累。Faurie等[7]的研究表明,抗病毒治疗引起的结节病在治疗结束后更为常见,但病情恶化通常呈现良性或简单的进展。此外,作者还提出,对于这些患者应继续维持抗病毒治疗,并在密切监测下使用局部皮质类固醇或羟氯喹治疗。另有研究提出干扰素治疗可能通过触发巨噬细胞并促进免疫系统向Th1的极化,从而开始导致结节病发生的一系列事件。在干扰素的治疗过程中,结节病的实际发病率可能被低估[17]。近期有案例报道,一中年女患者口服干扰素和利巴韦林治疗,给药后第八天患者出现间质性肺炎表现,立即停药予以类固醇冲击治疗后患者症状缓解出院。作者认为该例间质性肺疾病患者的发病机制是由于药物或其代谢物以半抗原的形式与肺组织或血液中的蛋白和多糖结合形成抗原从而引起过敏机制导致的。
4 一项回顾性研究中,M. S. Al Moamary 等发现患有丙型肝炎肝硬化的肝移植候选人也经常出现肺部改变,其中以DLCO减少最为常见[32]。Kula等通过99mTc标记的气溶胶闪烁照相术测量上皮渗透性来评估肺功能,丙型肝炎感染患者的肺上皮通透性较正常对照受试者增加,这提示了间质性肺病的早期改变[12]。
慢性丙型肝炎病毒感染引起的慢性免疫刺激和炎症,在间质性肺疾病的发生发展中可能起到了重要作用。
有研究表明,HCV核心蛋白通过核因子κB(nuclear factor-κB, NF-κB)和激活蛋白(activated protein-1, AP-1)来激活白细胞介素-8(interleukin-8, IL-8)的启动子[33]。IL-8通过与存在于炎症细胞(如中性粒细胞)上的受体相互作用,可以介导细胞募集和传播肺部炎症。IL-8已被证明可直接引起支气管收缩,并可能通过刺激中性粒细胞募集和活化而直接或间接导致慢性反应性气道疾病的发生。对慢性HCV感染患者的研究,已证实血清和肝内的细胞因子水平升高,特别是IL-8。在HCV感染者中,IL-8的表达可能通过NF-κB通道抑制干扰素-γ(interferon-γ,IFN-γ)的抗病毒活性,同时其与肝纤维化和门脉炎症的程度有关[30,33]。最近一项研究揭示了丙肝基因产物在肺组织中诱导IL-8的作用[34]。IL-8上调血管内皮生长因子的表达,增加血管生成,从而促进淋巴细胞浸润和长期淋巴细胞积累[35]。
此外,活动性丙型肝炎病毒感染可能有助于免疫应答调节梗阻性气道疾病的致病过程。冷球蛋白血症是一种以在中小血管以免疫复合物沉积为特征的血管炎,其和慢性丙型肝炎病毒感染之间的联系已经被确认,因此免疫复合物可能与HCV相关的肺部疾病有关[7, 30, 34]。
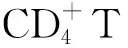
托克特诺病毒
托克特诺病毒(Torque Teno Virus , TTV)是一种非转化的、单链的3.8kb环形DNA病毒[36]。因为TTV与输血后肝炎相关,又称输血后肝炎病毒。通过聚合酶链式反应(polymease chain reaction,PCR)检测TTV感染患者的血清和9个尸检组织(骨髓、淋巴结、肌肉、甲状腺、肺、肝、脾、胰腺和肾)中获得的TTV-DNA进行定量,发现TTV在所有组织中均可检测到,病毒载量等于或高达相应血清中载量的300倍,这表明TTV基因型在组织中广泛、不均匀的分布,并表明病毒复制发生在受感染个体中,不同水平的多个组织中[21]。
TTV在人群中的感染是全球性的,其在日本、巴西和泰国健康人群血清中有高流行率,并且血中病毒载量随着年龄的增长而增长,此外,大多数感染患者没有症状。然而,Bando等2001年的研究中表示,IPF患者中TTV感染的存在可能会加重其病程。IPF患者TTV-DNA阳性组急性加重早期死亡发生率高,阳性组的3年生存率明显低于阴性组(58.3%vs95.2%,P<0.02),提示 TTV感染与IPF疾病的活动性及预后相关。该研究纳入33名IPF患者,有12名患者(36.4%)检测到TTV-DNA,在其中一位IPF病毒血症患者的肺组织中,检测到复制型的TTV-DNA。表明TTV与IPF之间可能存在着联系[19]。2008年,Bando等对患者血清中的TTV-DNA滴度进行检测,测得 IPF合并肺癌患者的TTV-DNA滴度明显高于仅IPF或肺癌患者。上述结果显示,高TTV病毒血症与IPF合并肺癌显著相关,然而尚不清楚高TTV病毒血症是否在IPF和肺癌的发展中起作用[20]。Wootton等使用PCR和泛病毒微阵列技术发现TTV感染在急性加重的病人中显著多于稳定的对照组(P=0.0003),但在急性肺损伤的对照组中存在相似的比例。由此,作者认为他们的发现可能只是反映了严重的潜在炎症的后遗症,而不能证明病毒感染和IPF急性加重之间的联系[23]。有趣的是,2015年Bando等的另一研究结果显示,TTV不大可能直接参与IPF的急性加重,而血清中的TTV-DNA滴度可能反映了宿主由于接受类固醇和免疫抑制剂治疗而产生的免疫抑制状态[24]。Sawata等提出在没有IPF的肺癌患者中,TTV滴度的变化可能与肿瘤生长相关。然而,在肺癌合并IPF患者中,TTV滴度与化疗反应不一致。因此,IPF可能对TTV-DNA滴度的变化有影响[22]。
展 望
目前,关于甲型肝炎病毒、乙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒、己型肝炎病毒、庚型肝炎病毒等其他嗜肝病毒与间质性肺疾病相关的报道较少。而丙型肝炎病毒及托克特诺病毒与间质性肺疾病之间是否存在联系仍有争议,肝炎患者治疗过程中是否需要进行抗纤维化的预防性措施,治疗间质性肺疾病是否需要抗肝炎病毒治疗,以缓解症状或预防其急性加重。除了嗜肝病毒外,还有许多病毒是否与间质性肺疾病存在相关性也存在争议,因此大量相关的临床研究亟需开展。
