非酒精性脂肪性肝病患者血清骨桥蛋白、铁蛋白水平及在肝损伤评估中的价值研究
2021-10-28刘江波史九波程治军
徐 静,刘江波,史九波,程治军
(1.三门峡市中心医院,河南 三门峡472000;2.河南科技大学第一附属医院 肝胆外科)
非酒精性脂肪性肝病(NAFLD)为常见的慢性肝脏疾病,全球范围内NAFLD的发病率均逐年上升[1]。NAFLD中约有1/5-1/4为非酒精性脂肪性肝炎[2],早期无特异性临床症状,肝细胞在脂质浸润下变性、坏死,最终发展为肝硬化。有研究显示,铁超载、铁代谢紊乱在NAFLD的发生发展进程中发挥了重要作用[3],其可能通过加重炎症和氧化应激反应对肝脏产生不利影响。血清骨桥蛋白(OPN)为分泌性磷酸化糖蛋白,有学者认为,OPN与NAFLD肝纤维化进程相关,但相关研究仍较少[4],为了明确NAFLD患者OPN、铁蛋白(SF)水平变化及在肝损伤中的作用,报道如下。
1 资料与方法
1.1 一般资料
选择2016年6月至2018年6月收治的288例非酒精性脂肪性肝病患者。其中105例为单纯性脂肪肝,49例为肝硬化,134例为非酒精性脂肪性肝炎,并匹配年龄、性别等一般资料相符的同期健康体检者100例。两组一般资料经比较差异均无统计学意义(P>0.05)。见表1。

表1 各组一般资料情况对比
纳入标准:(1)均符合中华医学会肝脏病学分会(2010)制定的《非酒精性脂肪性肝病诊疗指南》中相关诊断标准;(2)非酒精性脂肪性肝炎还需符合血清丙氨酸氨基转移酶升高1月以上或合并代谢综合征;(3)单纯性脂肪肝还需符合肝生化检查指标基本正常、经B超等影像学检查符合脂肪肝诊断标准。
排除标准:(1)长期饮酒史且估算乙醇摄入>100 g/周者;(2)合并药物性肝炎、自身免疫性肝炎、病毒性肝炎等肝病患者;(3)近1月接受保肝降酶治疗者;(4)近1月内有过补充铁剂、输血历史者。
1.2 方法
记录两组的年龄、性别、BMI等一般资料和临床诊疗情况。于患者入院第二天清晨抽取肘静脉血(禁食10 h),以2 000 r/min速度离心10 min,置于-80℃冰箱内待检测。SF检测采用电化学发光法,仪器采用罗氏COB601电化学发光分析仪,试剂盒购自罗氏诊断有限公司;OPN检测采用酶联免疫吸附法,仪器采用Multiskan Ascent全自动酶标仪(美国赛默飞世尔科技公司),试剂盒购买自R&D公司。常规检查谷草转氨酶(AST)、谷丙转氨酶(ALT)、甘油三酯(TG)、血清总胆固醇(TC)、谷氨酰转肽酶(GGT),仪器采用贝克曼AU5800全自动生化分析仪,试剂盒购自宁波美康生物有限公司,SF、OPN及其他生化指标检测严格按照试剂盒说明书进行。
1.3 观察指标
肝损伤评价采用FIB-4指标(FIB-4),FIB-4指标构建依据肝脏生化检查AST、ALT、PLT。FIB-4<2.67为2级及以下肝纤维化;FIB-4≥2.67为3级及以上肝纤维化。
1.4 统计学方法
使用SPSS23.0进行研究资料分析。计量数据组间比较为成组t检验,计数资料组间比较为卡方检验。诊断评估价值分析为ROC分析,α=0.05。
2 结果
2.1 两组OPN、SF及一般生化指标水平对比
观察组OPN、SF分别为(61.9±12.0)μg/L和(280.6±35.3)ng/mL,均高于对照组的(33.5±11.7)μg/L和(88.6±24.2)ng/mL,差异均有统计学意义(P<0.05),见表2。观察组AST、ALT、LDL-C、GGT水平均高于对照组,PLT水平低于对照组,差异均有统计学意义(P<0.05),见表3。

表2 两组OPN、SF水平对比

表3 两组临床生化指标对比
2.2 观察组不同肝纤维化水平下OPN、SF水平
经检测,288例患者中,2级及以下肝纤维化(FIB-4<2.67)为176例;3级及以上(FIB-4≥2.67)肝纤维化患者为112例。3级及以上肝纤维化患者的OPN、SF水平均高于2级及以下肝纤维化患者,差异有统计学意义P<0.05)。见表4。

表4 观察组不同肝纤维化水平下OPN、SF水平
2.3 OPN、SF对NAFLD肝纤维化诊断评估的ROC分析
以≥3级肝纤维化组为阳性样本,以≤2级肝纤维化组为阴性样本,建立ROC诊断分析模型,并采用组段建模模式:被分析指标按样本总水平数值范围划分为若干个组段,建立ROC曲线(折线)。经ROC分析知该指标具有较高的诊断价值,AUC分别为0.725、0.737。采用传统的并联联合应用模式(两指标有一阳即判阳性)对NAFLD肝纤维化诊断评估价值,AUC为0.781,其灵敏度明显高于单一指标。结果见表5,图1。

表5 OPN、SF对NAFLD肝纤维化诊断评估的ROC分析结果
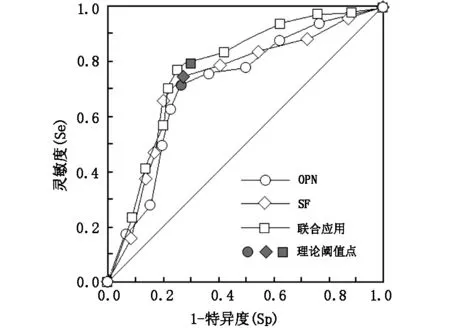
图1 OPN、SF对NAFLD肝纤维化诊断评估的ROC分析曲线
3 讨论
NAFLD患者的主要临床特征为脂肪贮积和肝实质细胞脂肪变性[5],一般包括非酒精性脂肪性肝炎、单纯性脂肪性肝病、肝硬化及肝细胞癌多种类型。随着全球肥胖及其相关代谢综合征趋势的升高,NAFLD已成为富裕国家和地区慢性肝病的主要病因之一[6]。调查显示,成人NAFLD患病率可高达10%-30%[7]。NAFLD不仅可直接导致失代偿期肝硬化、肝细胞癌等严重疾病,还可能对其他慢性肝病的进展产生影响,并且与动脉粥样硬化和2型糖尿病发病密切相关[8],严重影响患者的生活质量。NAFLD的发病机制尚不明确,可能和饮食、缺乏锻炼等多种生活习惯及基因、遗传易感性、胰岛素抵抗等有关。
近年来,有研究发现NAFLD患者肝脏普遍存在铁超载,铁为机体重要的微量元素,广泛存在于组织细胞中,肝脏为铁的主要贮存器官,因此发生铁超载时肝脏成为受损靶器官之一。SF为可溶性组织蛋白,是机体铁主要贮存形式之一,也是临床上评估铁超载(SF≥200 ng/mL)的主要指标[9],本次研究以SF为研究对象之一探讨了其与NAFLD患者肝损伤的关系,结果显示观察组SF水平显著高于对照组,并具有较高的诊断NAFLD患者肝纤维化≥3期的效能,与国内外相关研究提出的NAFLD患者中SF指标升高的观点一致,可能的原因包括:(1)铁超载可催化Haber-weiss反应[10],导致脂质过氧化,进而促进肝脏细胞胶原合成,加重肝损伤。肝细胞受损又使细胞内贮存铁进入血液循环,引起血清SF浓度升高,产生恶性循环[11]。(2)NAFLD发生发展过程中伴随着氧化应激和炎症反应[12],主要指标包括GGT、IL-1、IL-6、PLT等,而氧化应激和炎症反应又可诱导SF基因的转录和合成,造成SF表达增高,本次研究显示,观察组GGT高于对照组,PLT低于对照组,且差异具有统计学意义,进一步证实了该假设。
肝细胞损伤和肝脏炎症反应是肝脏损伤及肝纤维化发生的启动因素。据研究显示,肝细胞损伤可导致炎症因子和相关介质释放增多,从而加速肝纤维化。Ryan等[13]通过动物实验发现,正常大鼠的肝脏组织OPN表达水平极低,而肝纤维化的大鼠肝纤维间隔内及小叶中央静脉等部位呈OPN表达阳性。钟燕等[14]通过肝细胞体外培养发现,体外培养的肝细胞可以合成OPN,且在瘦素、肿瘤坏死因子-α等的刺激下OPN合成上调。Lombardi等[15]研究认为OPN表达增高发生于肝纤维化之前。以上研究均提示OPN可能成为NAFLD患者肝纤维化的新标志物。本次研究显示,该标志物诊断评估患者肝纤维化≥3期的曲线下面积AUC为0.725,表明OPN预测肝纤维化具有较高的临床应用价值。
总之,NAFLD患者血清OPN、SF水平均升高,且和肝纤维化进程相关,单独对血清OPN、SF水平进行检测有助于评估NAFLD肝损伤进展,联合检测二者的评估效果更佳。但本研究纳入病例数有限,且OPN、SF影响NAFLD肝纤维化的具体机制和路径尚未完全明确,进一步研究对揭示NAFLD的发病机制意义重大。
