幽门螺杆菌感染对帕金森病患者运动症状、便秘评分和生活质量的影响
2021-10-28王少颖王莉迪曹玉娇李净兵赵璨刘翠青王青青
王少颖,王莉迪,曹玉娇,李净兵,赵璨,刘翠青,王青青
(河北省第八人民医院 河北省老年病医院神经内科,石家庄 050011)
帕金森病(Parkinson′s disease,PD)属于神经内科常见病,是一种严重影响人类身心健康和生活质量的神经退行性疾病。相关流行病学调查显示,PD的患病率为(15~328)/10万,其发病机制可能与遗传因素、年龄、药物因素、社会因素、感染、应激反应等有关,目前尚无有效治疗方法,一旦发病,病情逐渐加重[1-2]。PD的病因是脑黑质致密部多巴胺能神经元的进行性缺损,临床表现为运动症状和非运动症状两大类,运动症状以静止性震颤为主,非运动症状则包括胃肠道功能障碍(便秘)、自主神经障碍、嗅觉障碍、认知功能减退等,对患者生活质量造成极大影响[3]。幽门螺杆菌(Helicobacter pylori,Hp)是胃肠道感染率最高的菌种之一,对人类具有较高的易感性[4]。既往认为,Hp感染与胃癌、慢性胃炎、消化道溃疡等消化系统疾病的发病密切相关;然而,随着研究的深入,发现Hp感染还参与神经系统、心血管疾病、糖尿病、自身免疫性疾病等肠外疾病的发生发展[5-6]。研究显示,Hp感染可能通过刺激迷走神经激活相关免疫细胞,进而破坏血脑屏障、诱导黑质中小胶质细胞活化,导致黑质内多巴胺能神经元变性,从而诱发PD[7-8]。但目前关于Hp感染对PD患者运动症状、便秘和生活质量影响的报道较少。本研究旨在分析Hp感染对PD患者运动症状、便秘评分和生活质量的影响。
1 资料与方法
1.1一般资料 选择2015年9月至2018年9月河北省第八人民医院神经内科收治的80例PD合并Hp感染患者作为Hp感染组,选取同期性别、年龄、病程相匹配的80例未感染Hp的PD患者作为无Hp感染组。纳入标准:①年龄55~75岁;②病程3~15年;③符合国际运动障碍学会PD的诊断标准[9]。④Hp感染患者经14C尿素呼气试验确诊Hp感染。排除标准:①PD叠加综合征或继发性PD;②伴有严重心、肝、肾功能不全、糖尿病、高血压、恶性肿瘤,脑部手术史、严重精神障碍者;③入组前4周内接受过质子泵抑制剂、抗生素等可能影响Hp检测结果药物者。Hp感染组男49例、女31例;年龄55~74岁,平均(63±8)岁;PD病程3~15年,平均(8.9±2.9)年。无Hp感染组男45例、女35例;年龄55~75岁,平均(64±9)岁;PD病程3~15年,平均(9.0±3.0)年。两组患者性别、年龄、病程比较差异无统计学意义(P>0.05)。本研究经河北省第八人民医院医学伦理委员会批准,患者均签署了知情同意书。
1.2治疗方法 无Hp感染组患者给予常规抗帕金森病治疗。Hp感染组患者在常规抗帕金森病治疗基础上给予Hp根除治疗,治疗方案为阿莫西林胶囊(山西昂生药业有限责任公司生产,批号:150102)每次1.0 g,每日2次;克拉霉素分散片(四川省旺林堂药业有限公司生产,批号:150405)每次250 mg,每日2次;奥美拉唑肠溶胶囊(济南明鑫制药股份有限公司生产,批号:150317)每次20 mg,每日2次,连续治疗14 d。
1.3观察指标 ①采用Hoehn-Yahr(H-Y)分级评估症状严重程度。②采用统一帕金森病评定量表(unified Parkinson′s disease rating scale,UPDRS)-Ⅲ评价运动症状,评分范围0~56分,评分越高,症状越严重[10]。根据运动症状评定临床疗效,基本治愈:UPDRS-Ⅲ评分较治疗前降低>50%;显效:UPDRS-Ⅲ评分较治疗前降低30%~50%;有效:UPDRS-Ⅲ评分较治疗前降低10%~30%;无效:UPDRS-Ⅲ评分较治疗前降低<10%。总有效率=(基本治愈例数+显效例数)/总例数×100%。③采用UPDRS-Ⅳ评价运动并发症情况,评分范围0~23分,分数越高,症状越严重[11]。④采用便秘Wexner评分评价便秘情况,包括排便频率、排便困难度、排便完整性、排便疼痛、排便时间、排便时辅助情况、24 h内尝试排便失败次数、排便病史8项,评分范围为0~30分,分值越高,便秘程度越严重[12]。⑤采用39项帕金森病生活质量调查表(39-item Parkinson′s disease questionnaire,PDQ39)评定生活质量,包含39个条目,涉及精神健康、身体活动、日常生活行为、社会支持、屈辱感、认知、身体不适、交流8个维度,每个条目评分为0~4分,各维度及总分经过标准化换算为0~100分,分值越高,生活质量越差[13]。⑥Hp根除判断:微量14C尿素呼气试验显示CO2<100 dpm/mmol为Hp根除。
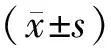
2 结 果
2.1两组治疗前H-Y分级、UPDRS-Ⅲ 评分、UPDRS-Ⅳ评分、便秘Wexner评分、PDQ39评分比较 Hp感染组H-Y分级、UPDRS-Ⅲ评分、UPDRS-Ⅳ评分、便秘Wexner评分和PDQ39评分均高于无Hp感染组(P<0.05或P<0.01),见表1。
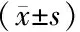
表1 两组治疗前H-Y分级、UPDRS-Ⅲ评分、UPDRS-Ⅳ评分、便秘Wexner评分、PDQ39评分比较
2.2Hp感染组患者治疗前后H-Y分级以及UPDRS-Ⅲ、UPDRS-Ⅳ、便秘Wexner、PDQ39评分比较 Hp感染组患者治疗后H-Y分级以及UPDRS-Ⅲ、UPDRS-Ⅳ、便秘Wexner、PDQ39评分均低于治疗前(P<0.01)。见表2。
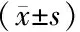
表2 Hp感染组患者治疗前后H-Y分级以及UPDRS-Ⅲ、UPDRS-Ⅳ、便秘Wexner、PDQ39评分比较
2.3Hp根除与Hp未根除患者运动症状临床疗效比较 治疗后,Hp感染组Hp根除64例,Hp未根除16例。治疗后,Hp根除组的总有效率高于Hp未根除组[46.88%(30/64)比6.25%(1/16)](χ2=11.429,P=0.001),Hp根除组运动症状的临床疗效优于Hp未根除组(u=11.534,P=0.021)。见表3。

表3 Hp根除组与Hp未根除组运动症状临床疗效比较 (例)
2.4Hp根除与Hp未根除患者H-Y分级以及UPDRS-Ⅲ、UPDRS-Ⅳ、便秘Wexner、PDQ39评分比较 治疗后,Hp根除组H-Y分级以及UPDRS-Ⅲ、UPDRS-Ⅳ、便秘Wexner、PDQ39评分均低于Hp未根除组(P<0.05或P<0.01)。见表4。
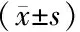
表4 Hp根除组与Hp未根除组H-Y分级以及UPDRS-Ⅲ、UPDRS-Ⅳ、便秘Wexner、PDQ39评分比较
3 讨 论
微生物感染在PD发病中发挥了重要作用,既往研究多集中于1型单纯疱疹病毒、EB病毒和巨细胞病毒,近年的临床研究与动物实验证实Hp感染同样参与PD的发生发展,且与PD的预后、转归密切相关[14]。Hp是一种定植于胃上皮管腔中的革兰阴性杆菌,最早由McColl等分离发现[15]。目前关于PD患者Hp感染率的流行病调查相对较少,研究显示,PD患者Hp检出率为27%~71%,是正常健康人群的数倍[16]。因此,了解PD患者与Hp感染之间的关系,对于Hp的防治及PD治疗方案的制订有重要意义。
Hp感染与PD病情发展有关,可加重PD患者的运动与非运动症状,降低患者生活质量。Katsinelos等[17]对PD与胃肠道微生物群之间分子联系的研究发现,Hp感染在PD的病理生理中发挥重要作用。Doulberis等[18]认为,Hp感染可通过口鼻通路或循环单核细胞通路进入大脑并破坏血脑屏障,引发神经变性,加重PD症状。另有研究发现,Hp感染可引起体液与细胞免疫,与中枢神经系统组分发生交叉反应,进而促进PD发展,表明Hp感染是影响PD患者病情的重要因素[19]。本研究结果显示,治疗前Hp感染组患者UPDRS-Ⅲ评分、UPDRS-Ⅳ评分、便秘Wexner评分、PDQ39评分均高于无Hp感染组;且Hp感染患者治疗后H-Y分级、UPDRS-Ⅲ评分、UPDRS-Ⅳ评分、便秘Wexner评分、PDQ39均评分低于治疗前,与上述研究结果一致,提示Hp感染可加重PD患者的症状,促进病情的发展。
根除Hp治疗可提高PD的临床疗效,改善PD患者的运动与非运动症状。Tucker等[20]研究认为,Hp可影响PD发病风险、严重程度及病程进展,成功的抗Hp治疗可改善PD病情。其机制可能为:①根除Hp治疗能够抑制Hp诱发的慢性炎症和免疫细胞激活,降低促炎细胞因子(如白细胞介素-6、白细胞介素-β、肿瘤坏死因子-α)的表达水平,阻断炎症因子对血脑屏障的破坏和对小胶质细胞的毒性及炎性损害,抑制神经元变性[21]。②根除Hp还能抑制Hp诱导的氧化应激,降低机体活性氧类合成,从而减轻线粒体功能损害,阻断多巴胺神经元变性坏死[22]。③左旋多巴是PD患者主要药物,主要吸收部位在胃肠道,酸碱度、胃排空和胃肠蠕动能力均影响该药吸收。Hashim等[23]研究显示,根除Hp能够改善胃酸分泌、胃肠道平滑肌细胞电活动、胃肠低动力和胃排空能力,从而提高左旋多巴吸收率,有利于维持其血药浓度。本研究Hp感染患者中,Hp根除患者运动症状临床有效率高于Hp未根除患者,H-Y分级、UPDRS-Ⅲ评分、UPDRS-Ⅳ评分、便秘Wexner评分、PDQ39评分均低于Hp未根除患者,证实根除Hp可改善PD症状,提高疗效。
综上所述,PD患者中Hp感染检出率较高,积极根除Hp能有效改善PD运动症状及运动并发症,缓解便秘,提高临床疗效。
