小鼠骨髓浆细胞样与髓样树突状细胞的体外培养及对比研究
2021-10-27谭剑峰李东方郭权威张建华
谭剑峰,李东方,郭权威,况 军,张建华
(南方医科大学深圳医院胸外科,广东 深圳 518000)
树突状细胞(dendritic cells,DCs)是人体功能最强大的专职抗原提呈细胞(antigen presenting cell,APC),在启动、维持和调节免疫应答过程中处于中心环节,被认为是机体免疫的始动者。目前已知DC有两个亚型,分别是浆细胞样树突状细胞(plasmacytoid dendritic cells,pDC)和髓样树突状细胞(myeloid dendritic cells,mDC)[1]。其中mDC具备典型的树突状形态,膜表面中高度表达MHC-Ⅱ类分子及Toll 样受体(Toll like receptor,TLR)2、3、4、5、6、8,能移行至淋巴器官和刺激初始型T细胞增殖活化,参与机体免疫应答的启动和调控,在抗肿瘤免疫反应中发挥重要作用[2]。而pDC则是一类近年来被认识并被证明在机体抵抗病毒感染以及在自身免疫性疾病和肿瘤的发生发展方面发挥着重要调控作用的免疫细胞[3~5]。与mDC不同,pDC在形态上、分布上、TLR 受体表达上、表面标记上均有其鲜明的特征。功能上pDC由于特征性地表达单链病毒RNA 配体TLR 7 和DNA病毒及CpG 寡聚脱氧核苷酸(CpG ODN)的配体TLR 9,使其能够与mDC形成互补,在病毒、CpG ODN 刺激下可以迅速分泌大量的Ⅰ型干扰素,发挥强大的抗感染等生物学效应[6]。关于mDC细胞亚群的体外培养及抗肿瘤生物学功能的研究已经渐趋成熟,但有关pDC细胞亚群体外培养及抗肿瘤生物学功能研究较少,同时缺乏对pDC与mDC细胞亚群进行系统性对比研究。为探讨小鼠骨髓树突状细胞亚群生物学功能的差异,我们对负载肿瘤细胞裂解物的小鼠骨髓浆细胞样(pDC)与髓样树突状细胞(mDC)亚群形态、免疫表型及细胞因子的分泌和促进淋巴细胞增殖等功能方面上进行对比实验研究,为以DC细胞为基础的生物免疫治疗提供新思路。
1 材料与方法
1.1动物与材料:C57BL/6雄性小鼠购自南方医科大学动物中心。小鼠Lewis肺癌细胞购自ATCC细胞库(美国)。非甲基化CpG基序的寡核苷酸(CpG ODN1826),购自上海生工生物工程公司(中国)。IL-12 ELISA、TNF-α ELISA检测试剂盒,购自BD公司(美国)。anti-CD11b分选磁珠及anti-mPDCA分选磁珠,购自Miltenyi Biotec公司(德国)。细胞计数试剂盒-8(cell conunting kit-8,CCK-8),购自Dojido公司(日本)。重组小鼠fms样酪氨酸激酶受体3配体(rmFlt3-Ligand),anti-CD11c-PE mAb、anti-CD11b-APC mAb、anti-B220-FITC mAb、anti-MHC-II FITC mAb、anti-CD40 PE mAb、anti-CD80 PE mAb及anti-CD86 PE mAb,均购自eBioscience公司(美国)。
1.2实验方法
1.2.1mDC与pDC的培养和分选:获取C57BL/6小鼠的股骨骨髓细胞,经红细胞裂解液裂解后用RMPI-1640培养液(含rmFlt3-L 100ng/mL)重悬细胞,调节细胞浓度1×106/mL,并加入12孔板中培养,每4天时半换液,置于37℃,5% CO2培养箱培养至第15天,利用CCK-8法每2天检测DC细胞的OD450值,然后利用流式细胞仪每4天检测mDC及pDC的占比。后于培养的第8天利用磁珠分选出mDC及pDC,流式细胞仪检测细胞纯度大于99%,分选得到的mDC及pDC用于后续实验。
1.2.2DC负载Lewis肺癌细胞裂解物与DC形态观察:取对数期Lewis肺癌细胞,胰酶消化,用PBS洗涤2次,再用PBS按2×107/mL重悬Lewis肺癌细胞,然后在液氮及37℃中反复冻融3次,10000rmp 4℃离心15min,吸取上清液备用。分别往mDC(106)、pDC(106)两组中加入等量的肿瘤细胞裂解液上清液(按DCs:肿瘤细胞=1∶1),对照组则加入等量的培养液,然后加入终浓度为2μg/mL的CpG1826培养24h诱导DC细胞成熟,同时利用倒置显微镜下观察细胞形态、数量、集落等生长情况。
1.2.3混合淋巴细胞增殖实验:获取小鼠脾脏,利用眼科剪将脾脏剪碎,置于70μm过滤网上,再用1mL注射器活栓尾部研磨,同时用PBS液冲洗,将收集到的脾脏细胞悬液放入离心管中,离心(1000rmp,6min)、弃上清。加入红细胞裂解液裂解,待裂解结束后迅速加入培养液中止反应,再次离心(1000rpm,6min),反复洗涤3次,弃上清即得脾脏细胞。将负载肿瘤细胞裂解物的mDC与pDC两组细胞按105/孔加入64孔培养板中培养,然后加入脾脏细胞106/孔(按DCs:脾脏细胞=1∶10),共培养3d,未负载肿瘤细胞裂解物的各组DC细胞作为对照组,共4组。同时设调零孔(培养液),单独的脾脏细胞培养孔(脾脏细胞及培养液),每个组设3个复孔。用CCK-8法检测混合淋巴细胞的增殖情况。采用酶标仪测定450nm波长吸光值(OD值),以下述公式计算刺激指数SI,SI=(实验组吸光度-调零孔吸光度)/(单独的脾脏细胞培养孔-调零孔吸光度)。
1.2.4免疫表型及细胞因子的检测:将实验组和对照组细胞悬液分别标记anti-mouse CD80 PE-Cy7,anti-mouse CD86 APC,anti-mouse CD40 PE,anti-mouse MHC Class II FITC,anti-CD11c-PE mAb,anti-CD11b-APC mAb,anti-B220-FITC mAb荧光抗体,置4℃避光条件下孵育标记30min,同时以荧光标记的同型IgG作为对照;反复洗涤2次,1000rpm 20℃离心6min,弃上清,用200μL含1%FBS的PBS缓冲液重悬后进行流式细胞仪检测,实验重复3次。分析软件为Flowjo 7.6.1,以CD11c阳性细胞设门,门内标记CD11b+B220-为髓样树突状细胞mDC亚群,CD11b-B220+为浆细胞样树突状细胞pDC亚群。利用ELISA法检测实验组和对照组细胞悬液各组IL-12、TNF-α的分泌情况,具体方法参照BD公司ELISA试剂盒说明书。

2 结 果
2.1mDC与pDC细胞的分选时间:在培养过程中,DC细胞的OD450值(表示细胞总数)先下降,至第5天时最低(0.51±0.03),然后又上升,第9天达高峰(0.82±0.05),后逐渐下降。mDC与pDC的占比在第0天为2.28%、1.42%,第4天为16.00%、8.29%,第8天为35.9%、27.00%,第14天为12.60%、33.7%。DC细胞OD450值的最大值在第9天(图1),mDC培养过程中占比最大值在第8天,35.9%,而pDC培养过程的占比最大值在第12天,33.7%(图2)。结合培养过程中的细胞总数变化及mDC与pDC占比的变化,DC亚型细胞的最佳分选时间在培养的第8~9天。

图1 不同时间DC细胞的OD450值

图2 不同时间分选的mDC与pDC细胞亚型占比
2.2负载肿瘤细胞裂解物的mDC组细胞较pDC组分泌更多的细胞因子:在负载肿瘤细胞裂解物条件下,mDC组分泌的IL-12及TNF-α分别为(2119.58±118.06)pg/mL及(590.56±125.09)pg/mL,pDC组分泌的IL-12及TNF-α(671.24±41.59)pg/mL及(298.56±50.72)pg/m,mDC组细胞分泌的IL-12及TNF-α均高于相同细胞数量的pDC组(P<0.05);且负载肿瘤细胞裂解物的mDC组与pDC组细胞分泌的细胞因子IL-12及TNF-α均高于未负载肿瘤细胞组(P<0.05),见图3及图4。
2.3负载肿瘤细胞裂解物的mDC组细胞刺激淋巴细胞增殖能力较pDC组高:负载肿瘤细胞裂解物的mDC组刺激淋巴细胞增殖的能力(8.55±0.59)高于相同细胞数量下pDC组(6.93±0.40,P<0.05);且负载肿瘤细胞裂解物的mDC组与pDC组细胞刺激淋巴细胞增殖的能力高于未负载肿瘤细胞组(P<0.05),见图5。

图3 不同条件各组DC细胞亚群分泌细胞因子IL-12的情况

图4 不同条件各组DC细胞亚群分泌细胞因子TNF-α的情况(*表示P<0.05,**表示P<0.005)

图5 不同刺激条件下各组DCs细胞刺激淋巴细胞增殖的情况(SI表示刺激指数,*表示P<0.05,**表示P<0.005)
2.4负载肿瘤细胞裂解物mDC与pDC的镜下形态:将负载肿瘤细胞裂解物的mDC及pDC亚群进行单独培养,倒置显微镜下观察可见mDC体积较大,细胞核不规则,且细胞周边见较多的“突起”(图6);而pDC体积较小,呈类圆形,大部分细胞表面无“突起”(图7)。

图6 DC(倒置相差显微镜×400)
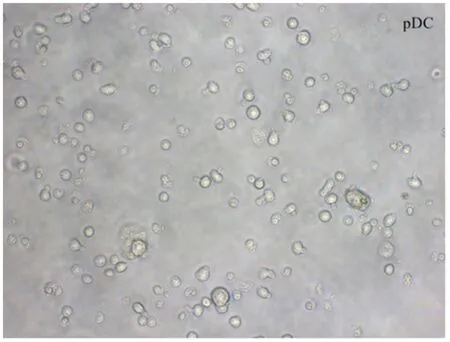
图7 pDC(倒置相差显微镜×400)
2.5负载细胞裂解物的mDC与pDC组的免疫表型表达上调:结果显示,负载肿瘤细胞裂解物的mDC组表面CD80、CD86、CD40及MHC-Ⅱ类分子平均荧光强度值高于相同细胞数量的pDC组,且负载肿瘤细胞裂解物的pDC与mDC组细胞表面CD80、CD86、CD40及MHC-Ⅱ类分子的平均荧光强度值均高于未负载肿瘤细胞裂解物组。(图8及图9)。

图8 负载肿瘤细胞裂解物前后的mDC亚群表面CD80、CD86、CD40及MHC-II类的表达变化
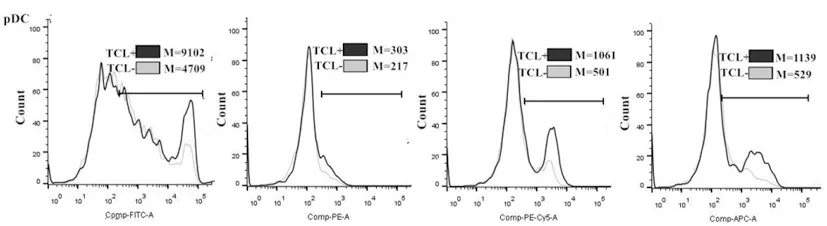
图9 负载肿瘤细胞裂解物前后的pDC亚群表面CD80、CD86、CD40及MHC-II类的表达变化
3 讨 论
在肿瘤的生物免疫治疗研究中,树突状细胞(dendritic cells,DC)疫苗为目前研究最多、临床应用开展最广泛的免疫治疗方法之一。现研究表明,DC 是由数种亚群所组成的一个具有异质性和多样性的复杂生物系统,该系统中每一个DC 亚群在免疫反应中发挥着独特的作用,共同参与对机体免疫应答的调节[7]。从来源上DC为mDC和pDC两大类,其中mDC是研究最早和体内分布最广泛的一类树突状细胞,也称常规树突状细胞(Conventional Dendritic Cells,cDCs),其与粒细胞、单核巨噬细胞均由骨髓中的髓系祖细胞(Common Myeloid Progenitor,CMP)分化而来。mDC有典型的树突状形态,高度表达MHC-Ⅱ类分子及Toll 样受体(Toll like receptor,TLR),提呈抗原并刺激初始型T细胞增殖活化,参与机体免疫应答的启动和调控。而pDC则是一类在自身免疫性疾病和肿瘤的发生发展以及在机体抵抗病毒感染方面发挥着重要调控作用的免疫细胞,主要由骨髓中的淋巴系祖细胞(Common Lymphoid Progenitor,CLP)及髓系祖细胞(Common myeloid Progenitor,CMP)分化而来。由此可见,mDC与pDC细胞亚群在形态、免疫表型及生物学功能方面存在一定的差异。
研究表明,利用细胞因子Flt3-Ligand 在体外成功诱导出小鼠骨髓源性的pDC与mDC亚群,并对 pDC与mDC进行了初步的对比研究,但不能确定pDC 与mDC的分选时间,尚未对负载肿瘤细胞裂解物的pDC 与mDC分泌细胞因子、抗原提呈及刺激淋巴细胞增殖等生物学特性进行系统研究[8]。本研究利用rmFlt3-L的体外刺激诱导DC细胞分化成mDC与pDC细胞,然后将分选后的mDC及pDC细胞负载Lewis肺癌细胞裂解物,以比较各组细胞形态、免疫表型CD80、CD86、CD40 及MHC-Ⅱ类分子的表达变化、细胞因子IL-12及TNF-α的分泌情况及刺激淋巴细胞的增殖情况,以解决前期研究者的不足。我们在研究过程中选择肿瘤细胞裂解物全抗原,是因为肿瘤细胞裂解物包含了全部潜在相关的抗原,从而避免了MHC限制及不需要特异性抗原表位,能降低免疫逃逸的风险。结果表明,在rmFlt3-L的体外刺激诱导下,小鼠骨髓细胞可分化成pDC与mDC细胞亚群,结合培养细胞数目及mDC与pDC的占比情况,从而确定了最佳分选时间为培养的第8~9d。负载肿瘤细胞裂解物的mDC与pDC均能分泌细胞因子和刺激淋巴细胞增殖,且mDC细胞的生物学功能强于pDC细胞。为了进一步明确mDC细胞的生物学功能强于pDC细胞的原因,后面我们对pDC及mDC细胞进行形态学观察,发现两者各具特点,其中pDC更类似于浆细胞或单核细胞,多数为圆形,表面突起较少,而mDC形态上则与单核细胞来源的树突状细胞类似,体积稍大,多为不规则形或圆形,胞膜可见较多突起,mDC细胞的形态较pDC成熟。同时负载肿瘤细胞裂解物的pDC与mDC组细胞表面CD80、CD86、CD40及MHC-Ⅱ类分子的平均荧光强度值均高于相同细胞数量的未负载肿瘤细胞裂解物组,且在负载肿瘤细胞裂解物的条件下,mDC组表面CD80、CD86、CD40及MHC-Ⅱ类分子平均荧光强度值高于相同细胞数量的pDC组。由此可见,负载肿瘤细胞裂解物的pDC也具有抗肿瘤的生物学功能,这与相关文献一致的[9],但mDC细胞的生物学功能强于pDC细胞,这与mDC细胞的形态成熟及共刺激分子表达上调有关。
综上所述,在rmFlt3-L的体外刺激诱导下,小鼠骨髓细胞可分化成形态与功能不同的pDC与mDC细胞亚群,最佳的分选时间为培养的第8~9天。负载肿瘤细胞裂解物的pDC与mDC细胞亚群均具有分泌细胞因子及促进淋巴细胞增殖的生物学功能,且mDC细胞的生物学功能强于pDC细胞,这可能与mDC细胞的形态成熟与共刺激分子表达上调有关,为以DC细胞为基础的免疫治疗提供一定的理论基础。
