基于激光散射技术的血流感染革兰阳性球菌快速检测的准确性分析
2021-10-27丁毅伟孙希萌
丁毅伟,孙希萌
血流感染是住院患者发病和死亡的主要原因[1-2],血流感染患者的生存率与最初给予适当的抗菌药物进行经验性治疗相关。因此,快速鉴定病原菌尤为重要[3]。有研究表明,接受充分实证治疗的厌氧菌血流感染患者的死亡率显著低于未接受充分实证治疗的患者[4]。因此,在获得药敏试验结果之前,更早和准确的病原菌鉴定对于选择合适的抗菌药物非常重要[5]。许多直接从阳性血培养样本中鉴定病原菌的方法表现出了不同的性能[6-8]。
本研究中HB&L 微生物培养仪国内刚通过认证并且在临床论证阶段,目前仅应用于尿液和体液的快速培养,可以短时间内诊断样本阴性或阳性。其采用Alifax 专利激光散射技术,原理是将激光作为光源,以检测散射光强度、频移及其角度依赖等而得到粒子的相关信息。在本研究中基于激光散射技术用来监测培养瓶中病原菌的生长,散射信号被计算和转化为生长曲线,实时推算培养瓶中的细菌浓度,当达到预设浓度后机器报警提示,这个过程仅需1~3 h,而传统的血培养阳性样本平板继代培养时间为24 h,大大缩短其时间,获得的阳性菌液直接离心取沉淀,分别用基质辅助激光解吸/电离飞行时间质谱(matrix assisted laser desorption ionization time of flight mass spectrometry,MALDI‑TOF MS)直接鉴定,同时联合VITEK 2 Compact微生物仪直接药敏试验(简称快速直接法),并以常规方法为参考,对快速直接法用于血培养阳性样本革兰阳性球菌鉴定以及药敏的准确性进行分析。
1 材料与方法
1.1 标本及其来源 收集解放军总医院第六医学中心门诊及住院患者141 份革兰阳性球菌血培养阳性样本。本研究经中国人民解放军总医院第六医学中心伦理委员会批准(201917100)。
1.2 仪器与试剂 Alifax HB&L微生物培养仪(意大利Alifax公司),Bruker MALDI‑TOF 质谱仪(德国布鲁克公司);全自动微生物鉴定和药敏系统VITEK 2 Compac(t法国梅里埃公司);血琼脂培养基、麦康凯琼脂培养基(郑州安图生物工程股份有限公司)。
1.3 方法
1.3.1 快速直接法 收集141 例革兰阳性球菌血培养阳性样本,从血培养瓶中取10µL 阳性菌液转种于 2 mL 的 HB&L 培养液瓶中,HB&L 微生物培养仪设定1.5麦氏浓度报警,当仪器达到1.5麦氏浓度报警后,无菌取出阳性培养液,分别置于2 个1.5 mL的无菌 EP 管约 1 mL,均 13 000 r/min 离心 2 min 制备沉淀物。2 份沉淀物分别进行如下操作:1 份沉淀物MALDI‑TOF 质谱仪直接细菌鉴定,操作步骤见 1.3.3;另 1 份沉淀物 VITEK 2 Compact 仪器直接药敏试验,操作步骤见1.3.4。
1.3.2 常规方法 以上收集的141例血培养阳性样本同时接种于血琼脂平板培养基、麦康凯琼脂培养基,35 ℃,5%CO2中培养24 h,待分离培养出单个菌落按照1.3.3和1.3.4进行革兰阳性球菌的鉴定和药敏试验。
1.3.3 MALDI‑TOF 质谱仪鉴定 将快速直接法的沉淀物吸取1µL涂抹于MALDI‑TOF靶板上,常规方法挑取单个菌落均匀涂抹在MALDI‑TOF靶板上,待上述2份样本晾干后,在干燥的菌液上加入1µL 甲酸晾干后,再加入IVD HCCA 基质溶液1µL,晾干后上机检测,每一步试剂均仔细滴加覆盖在每个样本上。
1.3.4 VITEK 2 Compact 药敏操作 将快速直接法的沉淀物吸取适量加入VITEK 2 Compact配套盐水中,常规方法是用无菌拭子挑取单个菌落放入VITEK 2 Compact 配套盐水中,以上分别调至0.5~0.63麦氏浓度,然后按照标准操作进行上机检测。
1.4 鉴定和药敏试验判读标准
1.4.1 鉴定结果 依据MALDI‑TOF 标准:细菌鉴定分值大于等于2.000分,表示能有效鉴定至种;分值1.990~1.700 分之间,表示能有效鉴定至属;分值低于1.700分,表示鉴定结果不可靠。
1.4.2 药敏结果 VITEK 2 Compact 仪器药敏结果参照CLSI M100‑S29 文件标准报告为敏感(susceptible, S)、中介(intermediate, I)、耐药(resistant,R);快速直接方法与常规方法药敏比较参照美国CLSI M23 ‑ A2 文 件[9]:分 类 一 致 性(categorical agreement, CA)指快速直接法与常规方法的符合率;一般错误(minor errors,MIE)指参考方法的结果为R 或S,实验方法为I,或者参考方法的结果是I,实验方法为S 或R;严重错误(major errors,ME)指参考方法的结果为S,实验方法为R;极严重错误(very major errors,VME)指参考方法的结果是R,实验方法为S;它们可接受的误差范围分别为CA ≥90%,MIE ≤ 10%,ME ≤ 3%,VME ≤ 1.5%。
l.5 统计学分析 应用SPSS 25.0软件,率的比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 快速直接法鉴定率分析 快速直接法对革兰阳性球菌的鉴定率为93.6%,其中不同菌属鉴定率分别为葡萄球菌属91.8%,肠球菌属94.1%,链球菌属100.0%,其中金黄色葡萄球菌、佩滕科夫葡萄球菌、路登葡萄球菌、里昂葡萄球菌、屎肠球菌、链球菌属鉴定率为100.0%。快速直接法鉴定率与常规方法(>1.700)比较差异无统计学意义(P>0.05),表1。
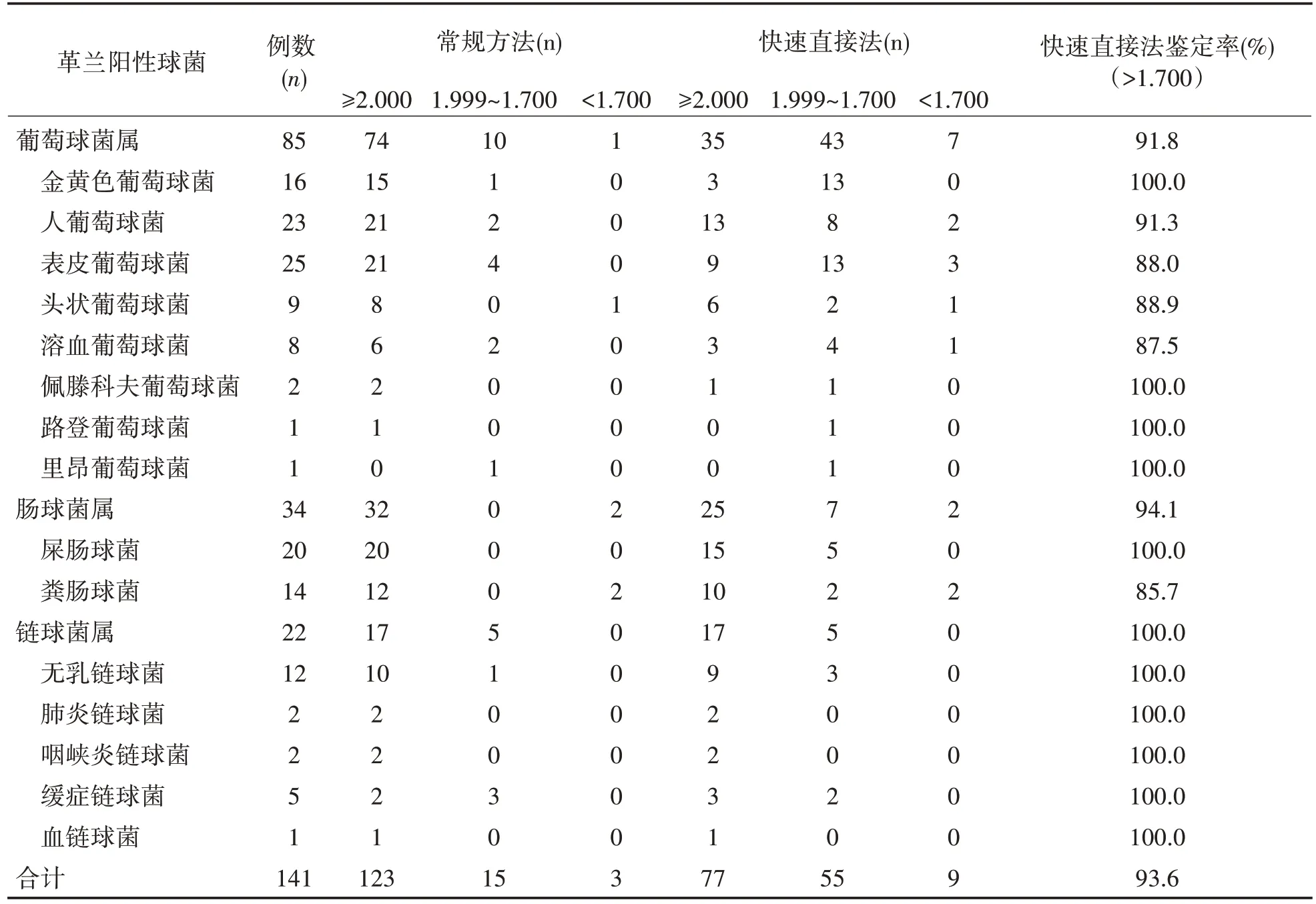
表1 快速直接法革兰阳性球菌鉴定率分析
2.2 快速直接法对葡萄球菌药敏CA 和错误率分析 收集的141 例血培养革兰阳性球菌阳性样本,葡萄球菌属85 株,占60.3%(85/141),其中金黄色葡萄球菌16 株,占18.8%(16/85),凝固酶阴性葡萄球菌69 株,占81.2%(69/85)。金黄色葡萄球菌CA 为100.0%,无错误率;凝固酶阴性葡萄球菌药敏CA均为90.0%以上,在环丙沙星、莫西沙星、利福平分别出现1例MIE(1.5%),均是3株表皮葡萄球菌;氯林霉素、四环素和红霉素各出现1 例ME(1.5%),分别是1 株人葡萄球菌和2 株头状葡萄球菌,复方新诺明出现2 例ME(2.9%),分别是1 株人葡萄球菌和1 株溶血葡萄球菌;氯林霉素和复方新诺明各出现1例VME(1.5%),均是人葡萄球菌,表2。
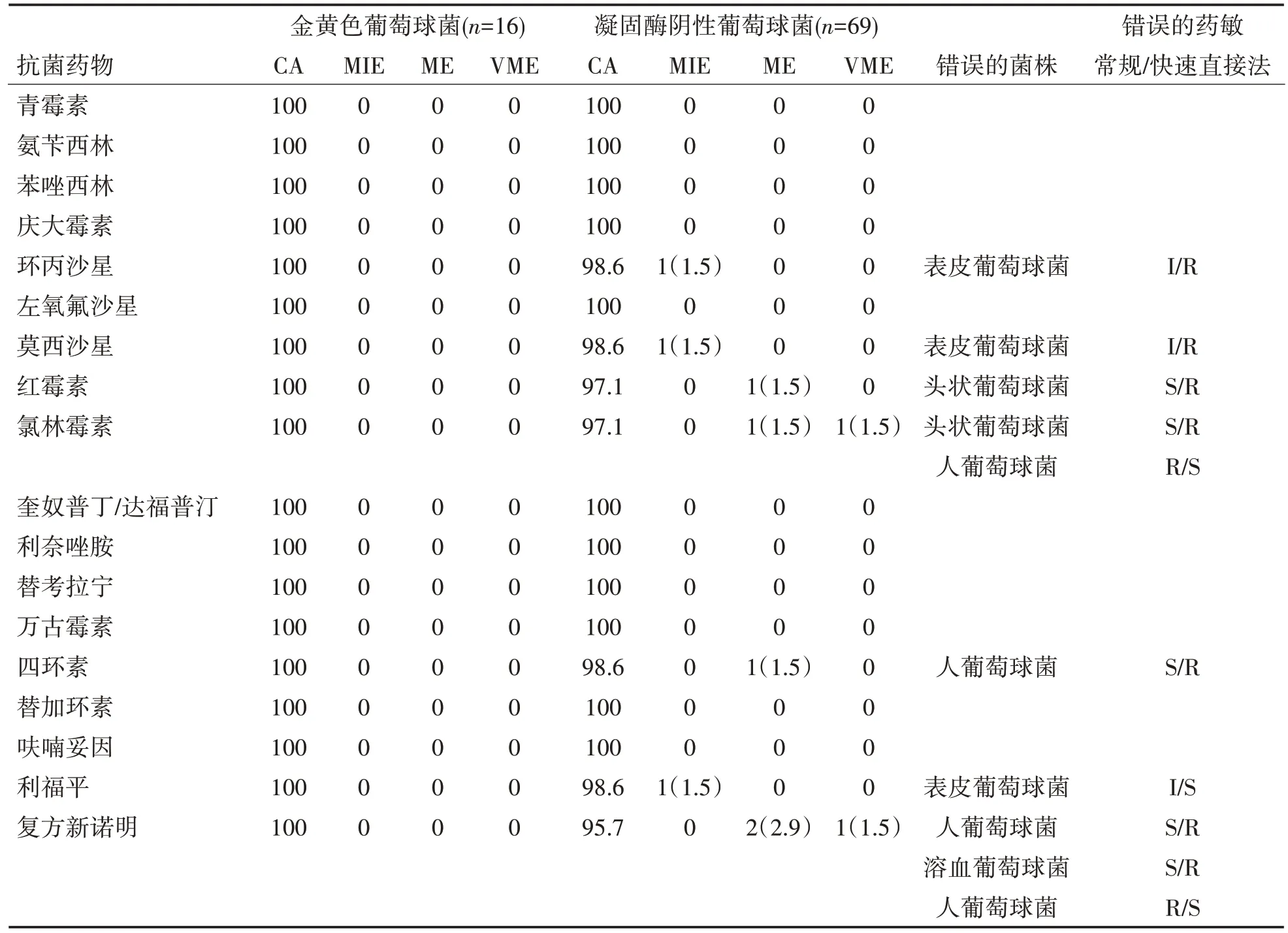
表2 快速直接法对葡萄球菌药敏的CA和错误率分析
2.3 快速直接法对肠球菌药敏CA 和错误率分析34例血培养肠球菌阳性样本中,屎肠球菌20株,占58.8%(20/34),粪肠球菌14株,占41.2%(14/34)。肠球菌药敏CA 均为90.0%以上,在ME 和VME 无错误率;在MIE 中屎肠球菌在红霉素、呋喃妥因分别出现1 例错误,分别为5.0%;粪肠球菌MIE 在呋喃妥因出现1例错误,为7.1%,表3。
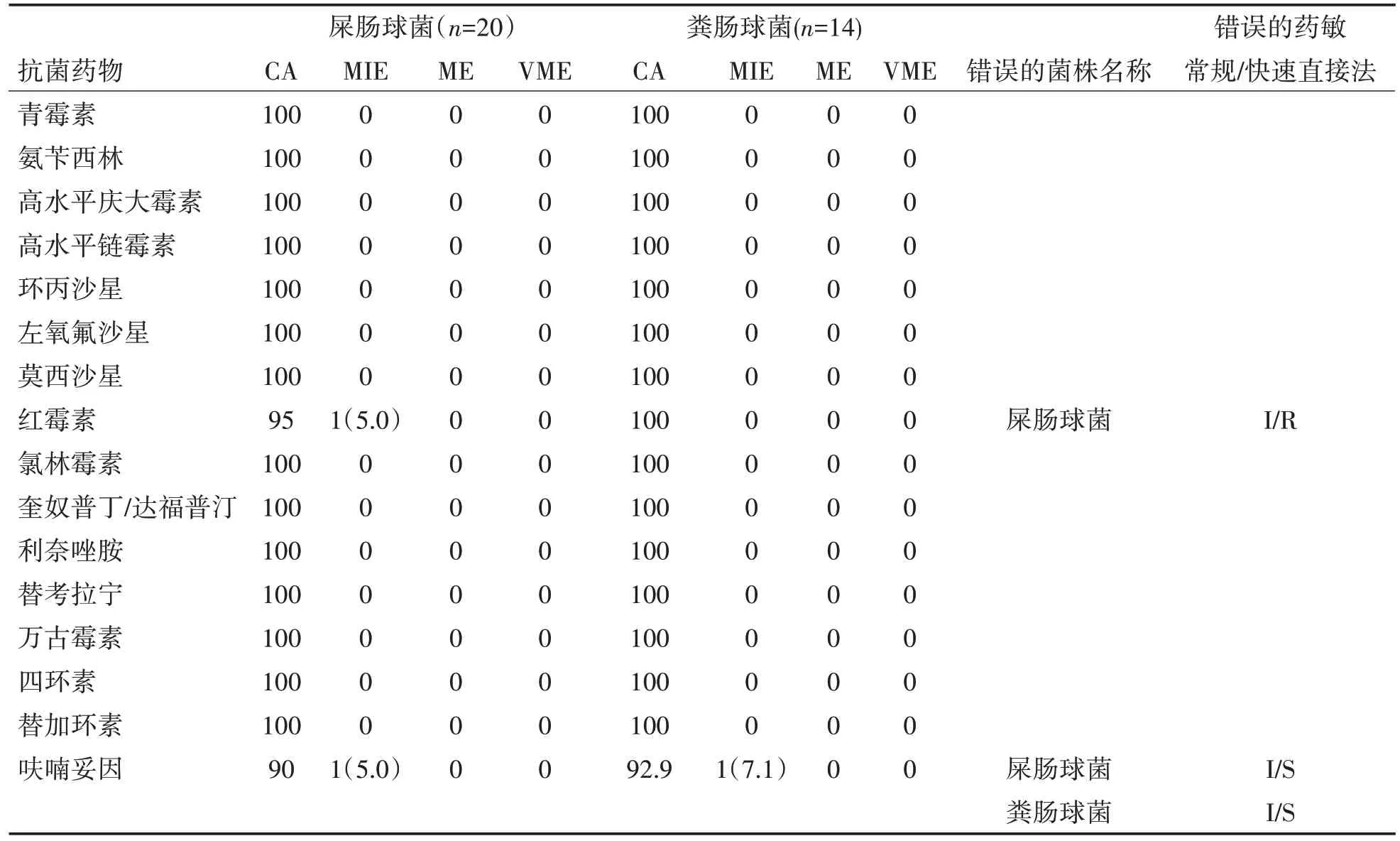
表3 快速直接法对肠球菌药敏CA和错误率分析
2.4 快速直接法对链球菌药敏CA 和错误率分析血培养阳性样本分离出的12 例无乳链球菌,CA 为91.7%,仅在替加环素出现1 例MIE 错误,占8.3%,错误为常规方法I,快速方法R,未出现ME 和VEM错误,表4。

表4 快速直接检测法对无乳球菌药敏CA和错误率分析
2.5 快速直接法对头孢西丁和诱导克林霉素耐药分析 在85株葡萄球菌中,两种方法共检测到头孢西丁67株阳性,16株为阴性,阴性一致率为100.0%(16/16),阳性一致率为97.1%(67/69),总体一致率为97.6%(83/85),常规方法有2株检测为阳性,但快速直接法为阴性。两种方法诱导克林霉素耐药32株阳性,47株阴性,阴性一致率为92.2%(47/51),阳性一致率为94.1%(32/34),总体一致率为92.9%(79/85)。
3 讨论
血流感染是临床由病原菌侵入的一种严重感染症状,易引起高发病率和死亡率[10-12],其中革兰阳性球菌引起的感染为27.9%,金黄色葡萄球菌、凝固酶阴性葡萄球菌居主要分离病原菌的前5 位,对患者健康有一定影响[13]。血培养快速准确的病原体鉴定和药敏对脓毒症患者非常重要,可大幅度降低脓毒症的死亡率[10-12]。目前,血液中的病原菌是先培养后鉴定,阳性血培养中微生物鉴定的周期约为24~48 h,在此期间患者接受经验性抗菌药物治疗或不接受治疗的时间较长。近年来,MALDI‑TOF MS 已成为一种快速可靠的技术,可直接从阳性血培养物中快速鉴定病原菌,鉴定时间能够缩短到10 h[14-21],如果直接从血培养物中鉴定容易受到血细胞影响,从而降低准确性。同时药敏结果也不能立即获得,导致患者接受广谱抗菌药物治疗而不是靶向治疗。有研究表明,靶向治疗可以缩短患者住院时间,降低死亡率[22-23]。
基于激光散射技术的Alifax HB&L 微生物培养仪,使血培养阳性样本培养时间缩短至2~3 h,本研究中快速直接法鉴定革兰阳性球菌的鉴定率为93.6%,与常规方法一致但高于血清分离胶促凝管法82.3%[24],不同菌属鉴定率分别为葡萄球菌属91.8%,肠球菌属94.1%,链球菌属100%,其中金黄色葡萄球菌、佩滕科夫葡萄球菌、里昂葡萄球菌、路登葡萄球菌、屎肠球菌、链球菌属鉴定率为100%。表皮葡萄球菌、头状葡萄球菌、溶血葡萄球菌和粪肠球菌快速直接法鉴定率低,其原因可能由于MALDI‑TOF MS 技术是检测菌体获得蛋白质图谱,但革兰阳性菌细胞壁较厚,获得的病原菌样本蛋白质图谱与数据库中图谱存在差异,因此鉴定分值不高[25]。另有翟鑫[26]等用 MALDI‑TOF MS 质谱鉴定与核酸扩增的基因进行对比,结果对凝固酶阴性葡萄鉴定符合率为100%。85株革兰阳性球菌快速直接法虽然有9株鉴定分值<1.700,但菌名鉴定均正确。快速直接法在缩短血培养阳性样本培养时间的基础上,与常规方法在鉴定上具有较高的一致率,能够为临床快速确定患者血培养中为何种病原体感染提高临床准确判断,有方向性针对用药。
临床革兰阳性球菌引起的血流感染主要是金黄色葡萄球菌[27],快速直接法检测葡萄球菌药敏显示,金黄色葡萄球菌CA 为100%,并且无任何错误率;凝固酶阴性葡萄球菌常为血培养的污染菌,但其也可引起导管相关性血流感染和感染性心内膜炎[28],凝固酶阴性葡萄球菌CA 均为90.0%以上。在人葡萄球菌、溶血葡萄球菌、头葡萄球菌检测氯林霉素、复方新诺明和红霉素时均出现ME 和VME,虽然出现的错误率较高,但是在标准范围内,下一步应该加大菌株和药物的实验进行分析。本研究中肠球菌无ME 和VME,肠球菌的血流感染以屎肠球菌为主[13],屎肠球菌在红霉素和呋喃妥因各1例MIE,粪肠球菌在呋喃妥因1例MIE。无乳链球菌替加环素1例MIE。头孢西丁和诱导克林霉素耐药的检测准确性,影响临床对葡萄球菌的用药疗效,检测显示头孢西丁阴性和阳性一致率分别为100%和97.1%,诱导克林霉素耐药阴性和阳性一致率分别为92.2%和94.1%。
快速直接法与常规方法比较,能够达到很好的鉴定率和药敏分类一致性,由于其准确性高,总报告时间大大缩短,将有助于临床快速直接鉴定血培养阳性样本革兰阳性球菌,指导用药,提高患者生存率。
