FIV静置对FIV沉淀分离及人血白蛋白质量影响的研究
2021-10-27杨建东
李 剑 金 川 李 锐 杨建东 于 李
(成都蓉生药业有限责任公司,四川 成都 610000)
人血白蛋白因具有维持血管内胶体渗透压,结合并转运体内各种脂肪酸、激素、离子以及多种药物的重要生物学功能,被广泛应用于各种低白蛋白症或创伤性休克[1]及肝硬化或肾病引起的水肿或腹水等疾病。近年来,随着人血白蛋白临床需求的不断增加,人血白蛋白的进口量不断增大[2],2020年进口白蛋白已占国内批签发总量63.96%,而随着监管日趋严格和血浆资源紧缺,国内血液制品厂家将面临更大挑战,所以不断优化生产工艺,提高血浆综合利用率和产品质量是当前各大本土厂家面临的迫切课题。目前市场上大多数血液制品企业采用的是改良后的低温乙醇工艺 Cohn6/9 法或 N-K(Nitschmann-Kistler)法[3],该法在低温乙醇条件下通过在各个分离阶段改变(pH、温度、蛋白浓度、离子强度、乙醇浓度)五变参数等措施,经多步沉淀和压滤分离,使中间制品固液相分离,使目标蛋白不断纯化。在FIV分离阶段各个厂家根据自身工艺条件、分离步骤及工艺参数都有所不同,针对FIV制作反应结束后有无静置及静置时间也并不一致,长时间静置对产品质量及安全性方面影响文献报道较少。该实验采用低温乙醇工艺制备人血白蛋白时,在FIV阶段制作完成后通过有无静置的不同工艺,来比较2种不同工艺对产品质量的影响。
1 材料与方法
1.1 主要材料与设备
主要材料与设备包括95%医用乙醇 、助滤剂、注射用水、健康人血浆、缓冲液、压滤机(EUROFILTEC FC.800. AC)、全自动电泳仪(MICROTECH648ISO)、高效液相色谱仪(Agilent1200)、动态试管仪。
1.2 方法
实验采用低温乙醇工艺制备人血白蛋白时,在工艺稳定的情况下,确保各项工艺参数的一致性,在FIV制作反应结束后,对2组各16个投浆批次分别采取无静置直接压滤分离和静置(48h)后压滤分离的不同参数控制工艺,将其合并为相对应的8个FV沉淀精制,对批次后续制剂阶段产品的多聚体含量、纯度等关键质量指标及其原液内毒素含量进行分析。工艺流程如图1所示。

图1 工艺流程图
1.2.1 过滤压力
取FIV 过滤整个过程最大压力作为过滤压力,记录2种不同参数控制工艺所达到的压力 (MPa)。
1.2.2 多聚体含量
使用 HPLC检测人血白蛋白成品的多聚体含量,对比2种不同的FIV参数工艺下所得的产品中多聚体含量的情况。
1.2.3 纯度
使用醋酸纤维素薄膜电泳法检测人血白蛋白成品纯度,对比2种不同的FIV参数工艺下所得的产品纯度情况。
1.2.4 原液内毒素含量
使用动态浊度法测定人血白蛋白原液的内毒素含量,对比2种不同的FIV参数工艺下所得的原液内毒素含量情况。
1.3 统计学分析
采用Microsoft Office Excel 2013进行数据处理,计量数据以“均数±标准差(x±s) ”表示,采用独立样本 T 检验用于数据的比较,以P<0. 05为差异有统计学意义。
2 结果
2.1 过滤压力
实验结果显示,FIV阶段静置(48h)后过滤16批人血白蛋白制品过滤压力为(0.22±0.01)MPa,而无静置直接过滤16批人血白蛋白制品过滤压力为(0.29±0.01)MPa,差异有统计学意义(t=-16.56,P=1.2258E-16,P<0.000),表明采用静置后过滤在过滤过程中能明显降低过滤压力,见图2。
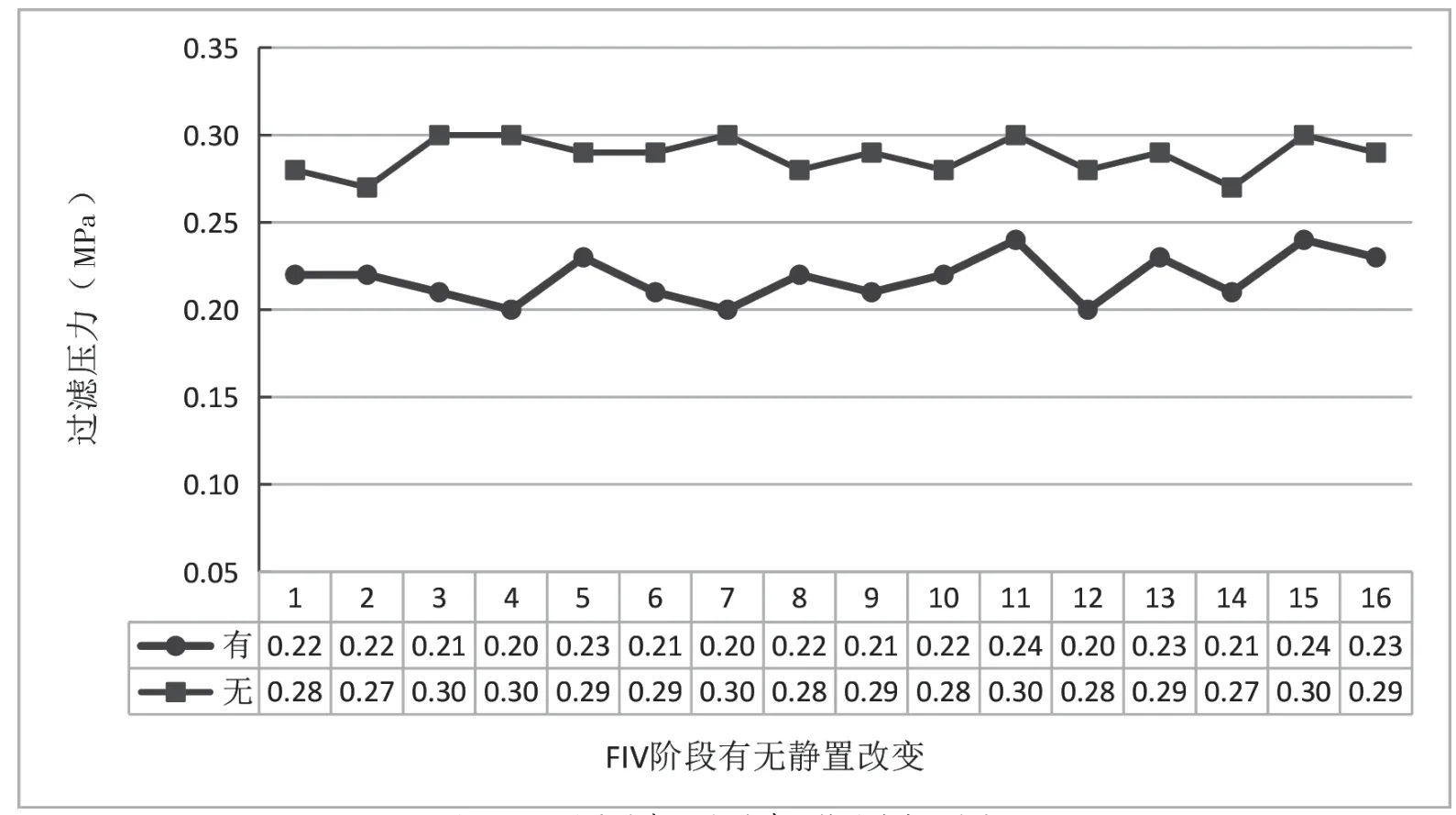
图2 FIV反应结束16批次有无静置过滤压力变化
2.2 主要质量指标比较
实验结果显示,FIV阶段静置(48h)后过滤8批人血白蛋白产品纯度为(98.29±0.11)%,多聚体为(2.80±0.18)%,而无静置直接过滤8批人血白蛋白产品纯度为(98.20±0.11)%,多聚体为(2.80±0.17)%,2组数据比较差异均无统计学意义(t分别为1.594和0.000),P分别为0.133和1.000),表明2种不同的FIV参数工艺在多聚体及纯度指标上并未表现出明显变化。见图3、图4和表1。

图3 FIV反应结束有无静置改变人血白蛋白成品多聚体变化

图4 FIV反应结束有无静置改变人血白蛋白成品纯度变化

表1 FIV反应结束有无静置过滤主要质量指标的比较
2.3 原液内毒素指标
由于中国药典2020版人血白蛋白原液检定无内毒素限值要求,参考半成品热原检查细菌内毒素限值蛋白浓度20%应小于1.67EU/ml[4],将16批FV沉淀合并为相对应的8批次FV沉淀精制(每2投浆批次合并为1批FV沉淀精制),经超滤后制成原液分别检测原液内毒素含量,实验结果显示,原液内毒素含量均处于极低水平。见表2。
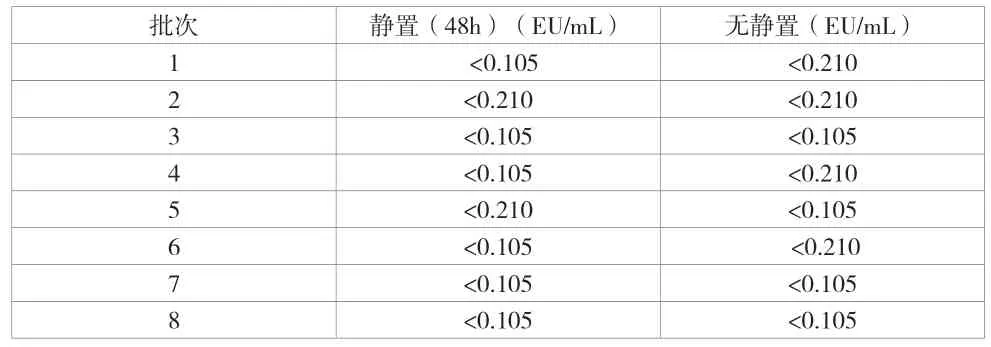
表2 FIV反应结束有无静置原液内毒素变化
3 讨论
低温乙醇工艺生产人血白蛋白时当血浆蛋白经FI+II+III压滤分离获得上清液后,进入FIV分离阶段,FIV分离纯化效果对最终产品的收率和质量影响尤为关键。FIV分离纯化主要通过制作和压滤2个生产环节实现,在制作过程结束后通常采用老化和适当静置的方法,延长制品反应时间,促使溶液中等电点蛋白更完全充分沉淀,以期望达到更好的分离效果。在进入过滤阶段通过压滤分离能够有效去除热原和各种杂质(α-球蛋白、β-球蛋白、凝血酶原、PKA、变性蛋白等),实现废弃沉淀和上清液分离,所以为了达到更佳的固液相分离效果,如何合理选用滤板和助滤剂种类(硅藻土、珍珠岩)及用量,过滤过程温度保证、过滤压力、滤液澄清度、流速控制等,将直接影响过滤过程中过滤效果,从而影响压滤分离质量。
有研究表明,为了避免蛋白溶液在离心和泵送过程中,由于高剪切力对沉淀颗粒造成的破坏,在反应条件终止后和离心或压滤操作前,此时沉淀物已经生成,在这种情况下已经可以进行下一步工艺如压滤或离心等固液分离步骤,但也可使沉淀物与母液在一定条件下继续静置一段时间,进行“批次老化”,以进一步促进沉淀形成,使沉淀物的性质随时间发生不可逆的结构变化,能够改善分离质量[5]。本次实验结果与上述报告相符,本次实验结果更进一步表明在FIV阶段采取静置(48h)后压滤分离,与无静置直接压滤相比,过滤压力降低24.14%,分析原因可能是由于在老化和静置期间,在沉淀的形成过程中沉淀蛋白颗粒强度增加、直径增大[5], 晶型完善与晶形转变等密切相关,制品在低频条件和静态混合过程中,沉淀蛋白的聚合发生结构上变化,空间构型更加稳固,对剪切力有较强抵抗力,增强了蛋白质稳定性,沉淀蛋白质颗粒直径增大,强度增加也有助于在压滤过程中与助滤剂一起形成更加疏松的滤饼,有利于提高滤过液的流速,从而降低了过滤压力。而杨宇等的研究表明,各种滤材均有其过滤面积和最大过滤压力承受负荷,过滤压力降低一方面能够降低过滤过程中因过滤压力过高带来的安全隐患;另一方面,如果过滤压力过高超过滤材最大承受压力负荷,将会导致过滤效果下降,影响产品质量[6]。而FIV阶段在随着制品不断过滤,在过滤中后期滤饼厚度增加,过滤压力出现明显升高,过滤阻力增大,导致过滤流速缓慢,出现过滤时间延长现象,而废弃沉淀收集时滤饼中液体含量往往较多,所以过滤压力改变,将直接影响过滤性能。
FIV阶段有无静置成品多聚体及纯度指标并未表现出明显变化,可见低温乙醇工艺由不同的生产工艺模块构成,作为在每个生产环节处于连续流动式运行的复杂生产系统,要在每个生产工艺步骤获得最佳的分离纯化效果, 须充分考虑五变参数调整,对降温幅度、搅拌速度及缓冲液添加速度等关键影响因素进行细致研究,单一改变某一非关键工艺过程并不会对最终产品质量造成明显影响。两者原液内毒素含量方面相比,均处于极低的水平,经分析长时间静置的制品在低温乙醇条件下储存于密闭容器中,有效避免与生产环境空气中微粒、微生物接触,而且制品处于低温乙醇状态下也不利于微生物滋生。所以为了确保长时间静置过程中制品微生物安全,生产操作过程中人员操作、洁净室环境、设备清洁效果、物料的投放方式等需要保证规范,并且对其进行持续监控,避免人员操作过程中无意识情况下将洁净室微粒、微生物等异物混入制品中,反应液在整个生产周期应尽量在密闭容器环境下生产,保证工艺流程稳定和可控,才能保证人血白蛋白生产工艺生产出安全的产品。
4 结论
该实验结果表明,在FIV分离阶段采取静置(48h)后压滤分离,能够明显降低过滤压力以及单位面积内滤板压力负荷,防止过滤压力过高造成滤板构造改变乃至破损,从而导致过滤性能下降或失效风险(滤液浊度偏高、滤液浑浊),静置(48h)后压滤分离有利于沉淀物的收集,确保固液分离的质量。而在产品质量方面,2种不同的FIV参数工艺在多聚体及纯度指标上并未表现出明显变化,其最终产品质量均符合《中国药典》要求,在原液内毒素含量方面均处于检测下限,表明FIV阶段长时间静置能够确保微生物安全,所以在FIV分离阶段适当设定静置时间,能够有效改善制品的分离质量,保障产品安全性。
