污染场地土壤重金属的生物可给性及毒性研究
2021-10-26马娇阳保欣晨崔道雷
马娇阳,田 稳,王 坤,保欣晨,汪 洁,崔道雷,向 萍
污染场地土壤重金属的生物可给性及毒性研究
马娇阳,田 稳,王 坤,保欣晨,汪 洁,崔道雷,向 萍*
(西南林业大学生态与环境学院/环境修复与健康研究院,云南 昆明 650224)
近年来,生物可给性被用于评估场地土壤污染健康风险,然而不同场地类型重金属生物可给性差别巨大,生物可给态重金属的人体健康危害效应仍然鲜见报道.本研究以浙江温岭某电子拆解厂为研究区,分析比较了5个场地土壤(S1-S5)中Zn、Cu、Cd、Pb的生物可给性并探究生物可给态重金属对人小肠上皮细胞的毒性效应机制.结果表明,场地土壤Cd和Cu污染较为严重,含量分别为4.84,438.52mg/kg. 4种重金属在胃阶段生物可给性范围分别为2.10%~48.28%、4.84%~33.73%、16.04%~42.81%、1.81%~15.71%,小肠阶段为2.05%~36.91%、13.17%~22.23%、10.19%~23.10%、0.60%~2.69%,可见胃阶段的生物可给性低于小肠阶段.对于肠相生物可给态重金属暴露人体肠道上皮细胞后,除样点S4外,细胞活力均显著性下降.此外,样点S3和S5土壤提取液对超氧化物歧化酶活力影响较小,但显著抑制过氧化氢酶活力,并且该样点对DNA产生损伤.通过研究电子拆解厂土壤生物可给性以及其毒性效应,以为我国场地土壤重金属健康风险评估提供科学依据.
电子拆解厂;土壤;生物可给性;Caco-2;DNA损伤
随着人类对电子产品的需求增加以及其更新换代的速度,电子垃圾的产生已经成为一个严重的环境问题.根据全球电子垃圾检测报告,预计2021年全球将会产生5.2×1010kg电子垃圾,但只有20%的电子垃圾以正规渠道回收.然而非正规的电子垃圾拆解和回收是不安全的、不受监管的[1],此外,在电子垃圾拆解和回收过程中,电子产品中的重金属、有机污染物等一些有毒有害物质将会释放到环境中[2],进而对空气、水以及土壤造成污染[3],甚至对人体产生毒害效应[4].
土壤中的重金属可能通过吸入、摄入和皮肤接触途径而暴露于人体,其中,偶然经口摄入土壤是主要方式之一[5].当人体摄入土壤后,达到人体消化系统,溶解在胃肠阶段的重金属量与土壤重金属总量之比称之为生物可给性.近年来,因体外方法省时、简单等优势,越来越多研究者采用体外胃肠模拟法来测定生物可给性[6-8].Li等[7]测定不同类型土壤重金属镉的生物可给性为60.9%~99.4%, Amponsah等[9]测定国外电子拆解厂重金属铅、镉和铜生物可给性分别为70.8%、64.1%、62.3%.目前土壤重金属对人体的健康风险评估大多是基于其总量,但重金属并没有100%被人体吸收,因此基于该评估方法会高估其真实风险.然而,对我国电子拆解厂土壤重金属的生物可给性鲜有报道,因此,采用SBRC体外模拟方法测定浙江温岭某电子拆解厂土壤锌(Zn)、铜(Cu)、镉(Cd)和铅(Pb)的生物可给性.
生物细胞活性氧(ROS)的积累会产生氧化损伤.有文献报道,重金属可能通过氧化损伤对人体产生危害效应[10],而抗氧化酶系统对防御氧化应激具有重要作用.当体内金属离子平衡破坏引发氧化应激后,并随后可能产生DNA损伤等毒性效应[10].而小肠作为人体的主要消化器官之一,当土壤重金属溶解于人体肠道后,是否对人体肠道细胞产生氧化损伤和DNA损伤鲜有报道.
本研究以浙江温岭某电子拆解厂为研究区,通过SBRC体外模拟的方法测定土壤重金属生物可给性,进而基于小肠上皮细胞模型,通过细胞活力、抗氧化酶SOD和CAT酶活性以及DNA损伤等指标探究土壤重金属对人体的毒害效应.因此,弄清污染场地土壤重金属的生物可给性及毒性效应,对于准确评估其健康风险具有重要意义,对防控其人体健康危害提供重要数据支撑.
1 材料与方法
1.1 样品采集与处理
以浙江温岭某电子拆解厂为研究区,布设5个土壤采样点,并标号S1~S5,每个样点采集0~20cm的表层土,除去石块、植物根系等杂物,将土壤在阴凉通风处自然晾干,并过60目(250 μm)的尼龙筛以测定土壤重金属总量以及生物可给性备用.
1.2 土壤物理化学性能表征
土壤pH值采用水提法(固液比为1:2.5),利用pH计(Starter3100)测定;使用0.5mol/L的盐酸浸泡24h后,利用总有机碳分析仪(Vario)测定土壤总有机碳含量;粒径分布利用激光粒度分析仪(Mastersizer 3000)测定;依据美国EPA的USEPA 3050B方法[11],土壤重金属含量采用硝酸(HNO3)和过氧化氢(H2O2)于105℃的消解炉内消解,利用5%硝酸定容,过0.45μm滤膜于4℃保存备用测定.重金属Cd和Pb利用电感耦合等离子体质谱(ICP-MS,ICAPRQ)测定,Zn和Cu利用原子吸收分光光度计(AA-6880)测定.
1.3 体外胃肠模拟
采用SBRC方法进行体外消化,以测定胃肠阶段土壤重金属生物可给性.胃阶段采用1:100的固液比加入胃模拟液,并于37℃恒温和转速150r/min的震荡箱中震荡1h,期间利用HCl使pH值稳定控制在1.5.胃阶段提取结束后,利用NaOH调节消化液pH值至7,并加入小肠模拟液,于上述相同条件下的震荡箱中震荡4h,期间利用HCl或者NaOH调整消化液pH值稳定控制在7.胃肠阶段分别消化完成后,离心并过0.45 μm滤膜于4℃保存备用测定.胃肠阶段重金属Cd和Pb利用ICP-MS测定,Zn和Cu利用AA测定.土壤中重金属生物可给性由下述公式计算得出:

式中:BA为土壤中目标重金属的生物可给性,%;I为胃或小肠模拟液中对应的重金属浓度,mg/L;I为胃肠模拟液体积,L;S为土壤中重金属总含量,mg/ kg;S为土壤质量,kg.
1.4 Caco-2细胞毒性效应
1.4.1 细胞培养、细胞形态和活力检测 结肠上皮细胞Caco-2来自美国模式培养物寄存库(ATCC),细胞生长于含MEM(含NEAA)基础培养基、10%血清和1%PS的完全培养基中,于37℃、5%CO2的二氧化碳培养箱中培养.待细胞于培养皿生长汇合到80%时,可利用胰蛋白酶溶液消化传代.
将1.3中不同土壤样点提取的小肠模拟液于95℃的水浴锅中加热5min,以使相关消化酶变性,并过0.22μm滤膜以备用,细胞暴露液以1:3的比例将小肠模拟液和MEM基础培养基配置[12].为研究小肠模拟液中生物可给态重金属对Caco-2细胞形态以及活力的变化,将细胞以1Í104个cells/孔/100μL的密度接种于96孔板中,待细胞生长24h后,将孔内完全培养基吸弃,加入不同土壤样点的细胞暴露液并在CO2培养箱中孵育24h,之后,利用倒置显微镜(尼康TS-100)观察细胞形态并拍照.随后加入10μLCCK-8溶液并于CO2培养箱中孵育2h,用酶标仪(SpectraMax Plus 384)在波长450nm的条件下检测每孔的OD值,以研究Caco-2细胞活力变化.
1.4.2 抗氧化酶活力测定 为了测定细胞超氧化物歧化酶(SOD)和过氧化氢酶(CAT)酶活力,将Caco-2细胞以5Í105个cells/孔/1.5mL的密度接种于12孔板中,细胞过夜培养后,加入不同土壤样点细胞暴露液孵育24h后,吸弃细胞暴露液,用预冷的PBS缓冲液洗涤Caco-2细胞,随后利用细胞裂解液裂解细胞并于4℃,12000的条件下离心5min,取上清液作为待测样品.按总SOD活性检测试剂盒(WST-8法)和过氧化氢酶检测试剂盒(碧云天生物技术)说明书进行酶活力测定.
1.4.3 DNA损伤研究 采用免疫荧光方法研究土壤重金属对人肠道细胞的DNA损伤情况,将Caco-2细胞以5Í104个cells/孔/1mL的密度接种于24孔板中,并将土壤样点S3和S5的暴露液暴露于Caco-2细胞24h,之后,在室温的条件下,用4%的多聚甲醛固定细胞30min、10%的Triton X-100透化15min和1%BSA封闭60min,并加入γH2A.X单克隆抗体,在4℃孵育过夜后,在室温复温1h,并加入山羊抗兔FITC-IgG二抗(南京翼飞雪生物科技有限公司)在室温避光孵育1h.滴加DAPI染色液避光孵育10min以将细胞核染色,使用倒置荧光显微镜(OLYMPUS IX37)对细胞进行观察,其中绿色荧光为DNA损伤阳性,蓝色为细胞核.
1.5 数据统计分析
实验数据以平均值±标准差表示,采用Microsoft Office Excel 2010进行数据计算,GraphPad Prism 8进行作图以及显著性差异分析,认为<0.05有显著性差异.
2 结果与讨论
2.1 土壤性状及重金属污染特征
浙江温岭某电子拆解厂土壤基本性状以及重金属含量如表1所示.该场地土壤pH值平均值为6.02,除样点S2呈碱性外,其他土壤样点均呈酸性.有机碳范围为1.18%~1.39%,粒径分布除S2外都以粉粒(51.78%~73.01%)为主.重金属Zn、Cu、Cd和Pb的含量平均值分别为491.43,438.52,4.84,133.93mg/ kg,该场地土壤4种重金都已超出浙江省土壤背景值[13],且重金属含量平均值分别超出背景值6.96倍、24.9倍、69.2倍、5.65倍,其中Cd的超标最为严重,其次为Cu.依据土壤环境质量农用地土壤污染风险管控标准(试行)[14],样点S3、S4的Zn以及S1、S2的Pb未超标,Cu和Cd五个样点均超出该风险筛选值.同样,赵等[15]发现该地电子拆解区土壤重金属对当地生态以及人类可能存在健康风险,其中Cu和Cd污染较严重,与本研究结果较为一致.因此,该场地土壤存在的重金属污染风险可能受到电子拆解活动的影响.

表1 土壤基本性质及重金属含量
2.2 土壤重金属生物可给性
土壤重金属在胃肠阶段的生物可给性如图1,不同土壤样点胃肠阶段4种重金属生物可给性差异明显,Zn、Cu、Cd、Pb在胃阶段生物可给性范围分别为2.10%~48.28%、4.84%~33.73%、16.04%~42.81%、1.81%~15.71%,小肠阶段为2.05%~36.91%、13.17%~ 22.23%、10.19%~23.10%、0.60%~2.69%.除样点S5的Zn和S3的Cu,胃阶段生物可给性均高于小肠阶段,反应出土壤重金属从胃相到肠相是一个逐步消化吸收的过程[16].从胃阶段进入小肠阶段,pH值从1.5调至7.0,重金属在酸性条件下,其酶活性增加而使得易从土壤中释放出,从而胃阶段生物可给性较高[17],而进入小肠阶段,随pH值的升高,重金属易发生沉淀使得释放出的重金属再次被固定钝化[18],使其小肠阶段的生物可给性降低.而样点S5的Zn胃阶段生物可给性高于小肠阶段的,但两阶段生物可给性并无显著性差异;样点S3的Cu胃阶段生物可给性明显低于小肠阶段,可能与该样点土壤粒径分布有关,其黏粒与粉粒所占比重最大(74.2%),有研究表明在土壤颗粒较细的情况下,Cu的生物可给性较高[19],因此在小肠阶段较细的土壤颗粒中的Cu可能易被溶解,从而增加生物可给性.该结果与Cao等[20]研究类似,他们发现利用体外模拟方法研究电子拆解厂土壤Cu的生物可给性,胃阶段进入小肠阶段后,生物可给性从1.3%~57.5%提高到7%~100%.
以上4种重金属的生物可给性均小于100%,由此说明并不是土壤全部重金属可溶解在人体消化系统中,基于重金属总量进行的评估可能会高估其健康风险[21].在胃阶段,土壤重金属生物可给性平均值呈现出Cd(32.09%) > Zn(22.76%) > Cu(19.93%) > Pb(7.36%)的趋势;在小肠阶段,呈现出Cu(17.05%) > Cd(16.88%) > Zn(11.88) > Pb(1.35%)的趋势.因此,该场地土壤Cd和Cu的生物可给性相对较高,与其总量污染较为严重相吻合,而Pb的生物可给性最低,与国外电子拆解厂相反,其胃阶段Pb生物可给性可达49.0%~90.2%[9],可能与其场地所释放的Pb氧化物较多有关,而使得其生物可给性较高.此外,与其他研究区相比,不同污染场地土壤重金属生物可给性差异较大,林等[22]所测定的农田土壤的生物可给性均比本研究高,这也说明不同类型土壤中重金属赋存的形态不同.
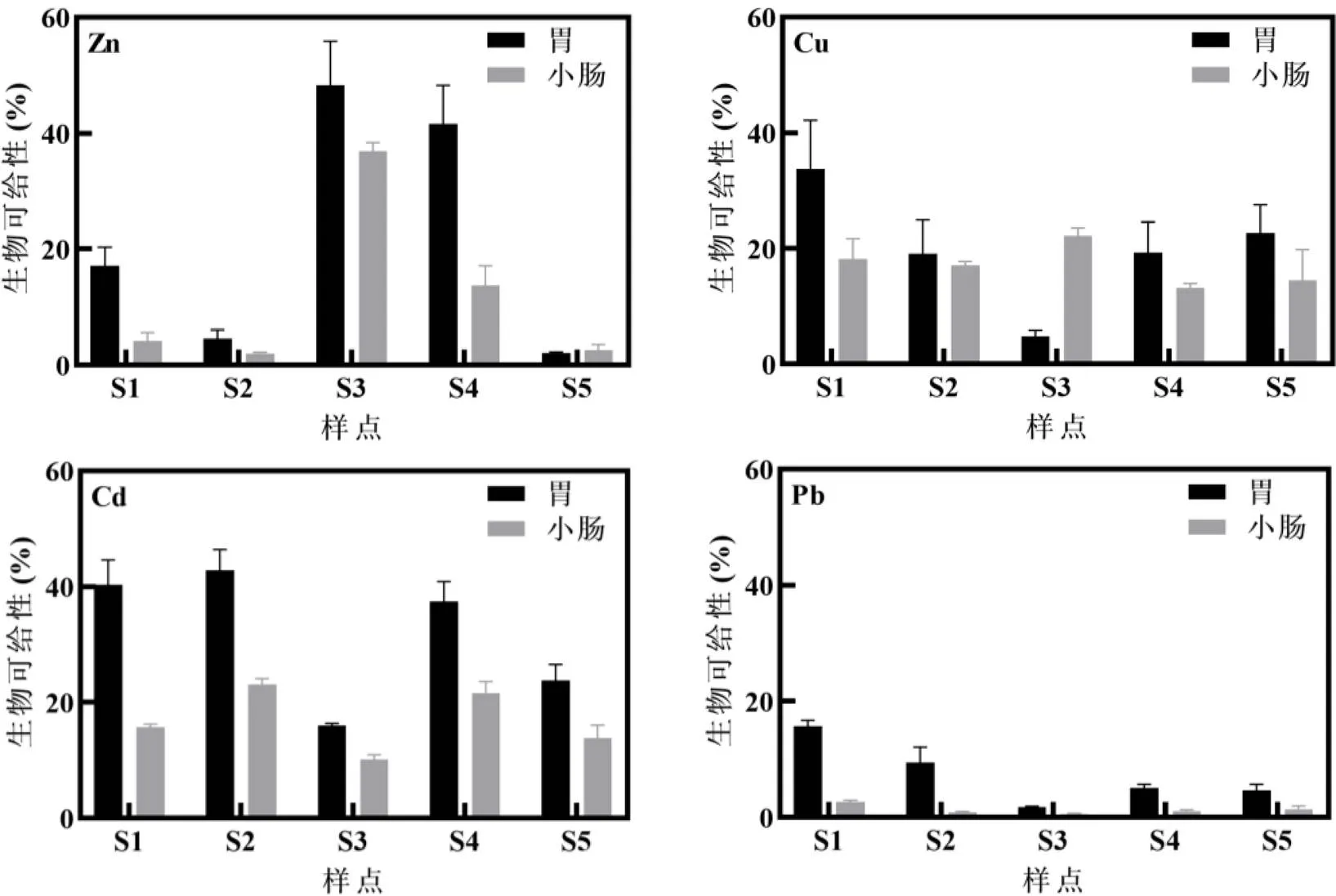
图1 土壤重金属胃肠阶段生物可给性
2.3 土壤肠相提取液对小肠上皮细胞活力和形态的影响
肠上皮细胞可维持人体肠上皮功能,并保持其持续更新能力以维持组织稳态,但是肠上皮细胞死亡会导致肠通透性增加和肠屏障功能障碍[23].因此,利用小肠上皮细胞以研究该场地土壤重金属对其毒性效应.
细胞活力是评价细胞对污染物所反映出的毒性效应的一个重要指标[24],将制备的不同土壤样点的暴露液暴露于Caco-2细胞以测定其细胞活力变化,暴露液的重金属浓度如表2.Caco-2细胞暴露于不同土壤样点的细胞活力差异性明显(图2A).样点S4细胞存活率下降<5%,与空白对照组无显著性差异,其余土壤样点都可抑制Caco-2细胞活力,其中样点S5抑制细胞活力最为显著,细胞活力下降至74.48%.可见,肠相生物可给态重金属对细胞活力有显著性影响.不同重金属对细胞活力的影响有所差别,重金属Zn在低浓度对人骨肉瘤细胞U-2OS有促进作用,但浓度>60μmol后,Zn对细胞活力有显著性抑制作用[25],同样,Zn浓度达到50μmol后,使人乳腺癌细胞MDAMB231的细胞活力下降到~80%[26]. Caco-2细胞对Cu的半抑制浓度为300μmol,而人肝细胞Hep-G2和胃细胞SGC-7901对Cu的IL50分别为700μmol和168μmol[27-28],表明Caco-2细胞比人肝细胞对Cu更为敏感,而比人胃细胞更有耐性.重金属Cd暴露于人肺细胞A594 24h后,浓度为20nmol~2μmol时,细胞活力降低<10%,与对照组显著性差异较小(<0.05),但浓度达到10μmol时,细胞活力差异性显著增强(<0.001)[29].相似地,重金属Pb随着浓度的增加对细胞活力有所影响,当Pb浓度<25μmol时,对小鼠海马神经元细胞HT-22无显著性影响,而当浓度提高到50~100μmol后,细胞活力明显下降[30].可见,不同重金属对不同类型的细胞活力影响有所差别,也表明不同细胞类型可能通过不同机制途径抵御重金属的外部胁迫.然而,土壤成分复杂,尽管本研究细胞暴露液中的重金属均低于以上研究的浓度,但土壤中多种重金属共存往往产生协同效应,导致毒性显著增强,研究[27]证实Cd和Cu复合产生的毒性效应较Cd或Cu暴露强数倍.可见,当该场地土壤进入人体肠道后,可能会损坏肠上皮细胞进而产生毒害效应.
细胞形态也是评价外部污染物对细胞毒性的有效指标.其中3个土壤样点细胞暴露液对Caco-2细胞形态的影响如图2C、D、E,其变化与细胞活力变化相一致.空白对照组(图2B: CK)的Caco-2细胞形态大多呈鹅卵石不规则的圆形,样点S4(图2D)所暴露的细胞形态与CK组相似,而样点S3(图2C)和S5(图2E)暴露的细胞形态发生改变,由圆形形状变成不规则多边形、松散的形状,并且部分细胞发亮变圆以导致细胞死亡,进而使得细胞活力也显著降低,样点S1和S2与S3无显著性差异.

表2 不同土壤样点细胞暴露液重金属浓度

图2 土壤小肠提取液对Caco-2细胞形态和活力的影响
图B~图E为细胞形态图,放大倍数为200´;CK为空白肠液的对照组;不同字母表示具有显著性差异(<0.05)
可见,肠相中生物可给态重金属暴露使得细胞活力和形态发生明显改变.我们对细胞活力改变程度与生物可给态重金属含量进行相关性分析(图3),发现细胞活力降低与重金属Zn无相关性(2=0.03) (图3A),与Cu和Pb含量有相关性(2=0.13、0.54),但细胞活力随Cu浓度的增加而增加,与细胞活力的增加呈正相关(图3B),可见低浓度Cu对Caco-2细胞增殖有促进作用,而重金属Pb与细胞活力的增加呈负相关(图3D),Pb浓度的增加对细胞起到抑制作用.重金属Cd与细胞活力有较强的相关性(2=0.80),并呈负相关关系(图3C).与Husejnovic等[31]研究相似,人皮肤细胞HaCaT细胞活力与重金属Cd毒性呈正相关(2=0.56).此外,生物有效态的重金属能够改变小鼠肠道的形态,并且可能破坏肠道屏障以紊乱消化系统[32].因此,通过重金属浓度与Caco-2细胞活力相关性也可说明样点S5所暴露的细胞活力最低可能是由于其小肠提取液中的生物可给态Cd和Pb浓度较高导致的.

图3 不同土壤暴露液重金属浓度与Caco-2细胞活力相关性
2.4 土壤肠相提取液改变小肠上皮细胞抗氧化酶活力
外界污染物重金属的胁迫下,可能会增加细胞内活性氧产生,进而触发抗氧化酶系统的作用以避免生物机体氧化损伤[33].其中,抗氧化酶SOD和CAT对维持细胞内的稳态至关重要[34].为了进一步研究肠相生物可给态重金属对人肠道细胞的毒性效应机制,分析了暴露后Caco-2细胞内抗氧化酶改变情况.
不同土壤样点小肠提取液暴露于Caco-2细胞后,SOD和CAT酶活水平(U/mg 蛋白)如图4.对照组的SOD酶活力为35.47U/mg 蛋白,与空白对照组相比,暴露组5个土壤样点的酶活水平与其都无显著性差异,为对照组的0.89~1.22倍;不同土壤样点相比,S2和S5的SOD酶活力相对较高,且无显著性差异,其余3个样点酶活力相对较低.对照组与样点S1、S2和S4的CAT酶活力无显著性差异,但样点S3和S5酶活力显著降低.SOD可通过催化歧化反应生成氧气和过氧化氢,进而通过CAT将过氧化氢转化为水[35],从而达到清除活性氧的效果以防御机体受到氧化损伤.尽管土壤样点S3和S5所暴露的Caco-2细胞SOD酶活力无明显变化,但其CAT的酶活力显著降低,因此细胞内可能会有部分过氧化氢未被分解,进而对人肠道产生氧化损伤.
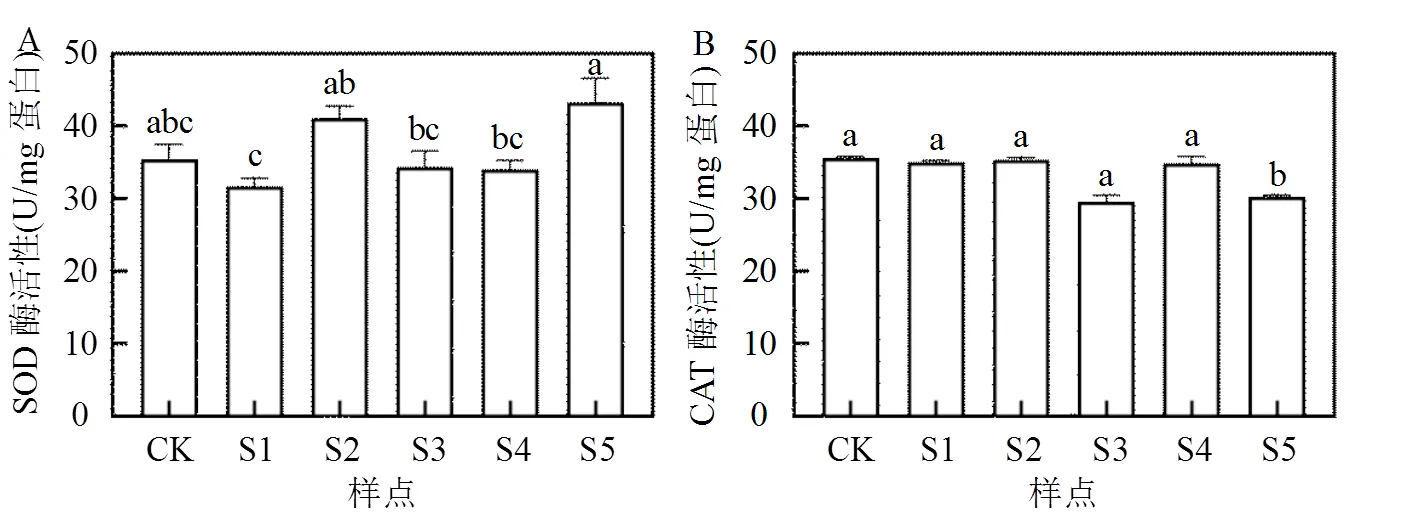
图4 土壤小肠提取液对Caco-2细胞SOD和CAT酶活力的影响
CK为空白肠液的对照组;不同字母表示具有显著性差异(<0.05)
不同重金属对SOD和CAT酶活力的影响有所差异,重金属Cd在5μmol时,对人胃细胞SGC-7901的SOD和CAT酶活力无显著性差异,而Cu在10μmol和20μmol时,SOD酶活力显著增加,但CAT酶活力显著降低[27].此外,重金属Cd(0.5mg/L)也会使水生动物肠道SOD和CAT酶活力发生改变[36],且Zn也可使水生动物肠道中CAT酶活力下降[37],进而引发氧化损伤.因此,样点S3和S5所暴露的Caco-2细胞CAT酶活力显著下降可能与其细胞暴露液中重金属浓度有关,多种金属的联合作用比单独重金属的毒性更大,进而引发酶活力下降并诱导氧化损伤.
2.5 土壤肠相提取液诱导肠道细胞DNA损伤
基于上述细胞活力以及抗氧化酶活力结果,利用免疫荧光技术进一步从分子层面分析了土壤样点S3和S5暴露Caco-2后,其DNA损伤情况.DNA双链断裂是DNA损伤最严重的形式[38].H2AX 组蛋白是染色质核小体组蛋白核心的成员之一,其在DNA加工、修复中起到重要作用[39],但当DNA双链断裂时,会促使DNA周边的H2AX 组蛋白磷酸化,从而形成γH2A.X[40].因此,γH2A.X是DNA双链断裂的标志物.利用倒置显微镜观察Caco-2细胞暴露土壤S3和S5肠提取液后DNA损伤如图5.图5A、B、C为γH2A.X抗体荧光染色(绿色),图5A′、B′、C′为DAPI细胞核荧光染色(蓝色),图5A″、B″、C″为两种染色所叠加图像.与空白对照CK组相比,土壤样点S3和S5所暴露的Caco-2细胞中,γH2A.X阳性细胞(绿色)百分比有所增加,表明该场地土壤肠相生物可给态重金属引发了明显的DNA损伤.土壤肠相生物可给态重金属中存在多种,但已有文献表明重金属Cu、Cd和Pb均能够使人细胞引发DNA损伤[31,41],其是因为土壤中的重金属可能能够抑制DNA合成或干扰DNA修复[42].因此,土壤样点S3和S5的小肠提取液中的Cd和Pb的浓度较高,因而引发DNA损伤.相似地,Husejnovic等[31]所研究的Cd和Hg含量较高的土壤样点对Caco-2细胞和人皮肤细胞HaCaT诱发DNA损伤.此外,这些数据也可表明,土壤中的多种重金属的联合作用产生的毒害效应可能比单独重金属更强.

图5 Caco-2细胞暴露土壤S3和S5肠提取液后DNA损伤
图放大倍数为400X
3 结论
3.1 浙江温岭某电子拆解厂土壤4种重金属含量呈现出不同程度的超标情况,Zn、Cu、Cd和Pb分别超出浙江省土壤背景值6.96倍、24.9倍、69.2倍、5.65倍.此外,Cu和Cd的含量均超出国家农业土壤所规定的限值.
3.2 土壤中Cd和Cu生物可给性相对较高,胃肠阶段的生物可给性分别为32.09%、16.88%(Cd)和19.93%、17.05%(Cu);而Pb的生物可给性较低(7.36%、1.35%).总体上,4种重金属小肠阶段的生物可给性低于胃阶段.
3.3 不同土壤样点提取的小肠提取液对Caco-2细胞活力变化有所差异,其中样点S5使细胞活力下降最为显著,此外,土壤样点S3和S5所暴露的Caco-2细胞CAT酶活力显著下降并产生DNA损伤,该样点对人体肠道细胞产生毒性效应可能与其含有较高的生物可给态重金属有关,为此该结果可为土壤重金属对人体健康的影响提供数据支撑.
[1] Ohajinwa C M, van Bodegom P M, Vijver M G, et al. Impact of informal electronic waste recycling on metal concentrations in soils and dusts [J]. Environmental Research, 2018,164:385-394.
[2] Okeme J O, Arrandale V H. Electronic waste recycling: Occupational exposures and work-related health effects [J]. Current Environmental Health Reports, 2019,6(4):256-268.
[3] Akram R, Natasha, Fahad S, et al. Trends of electronic waste pollution and its impact on the global environment and ecosystem [J]. Environ Sci Pollut Res Int, 2019,26(17):16923-16938.
[4] Qin G, Niu Z, Yu J, et al. Soil heavy metal pollution and food safety in China: effects, sources and removing technology [J]. Chemosphere, 2021,267:129205.
[5] Boim A G F, Wragg J, Canniatti-Brazaca S G, et al. Human intestinal Caco-2cell line in vitro assay to evaluate the absorption of Cd, Cu, Mn and Zn from urban environmental matrices [J]. Environmental Geochemistry and Health, 2019,42(2):601-615.
[6] 冯康宏,范 缙,Hii L U S,等.基于生物可给性的某冶炼厂土壤重金属健康风险评价 [J]. 中国环境科学, 2021,41(1):442-450.
Feng K H, Fan J, Hii L U S, et al. Human health risk assessment of heavy metals in soil from a smelting plant based on bioaccessibility [J]. China Environmental Science, 2021,41(1):442-450.
[7] Li S W, Sun H J, Li H B, et al. Assessment of cadmium bioaccessibility to predict its bioavailability in contaminated soils [J]. Environment International, 2016,94:600-606.
[8] Li H B, Li M-Y, Zhao D, et al. Arsenic, lead, and cadmium bioaccessibility in contaminated soils: Measurements and validations [J]. Critical Reviews in Environmental Science and Technology, 2020,50(13):1303-1338.
[9] Amponsah L O, Dodd M, G D. Gastric bioaccessibility and human health risks associated with soil metal exposure via ingestion at an e-waste recycling site in Kumasi, Ghana [J]. Environmental Geochemistry and Health, 2020.
[10] Jomova K, Valko M. Advances in metal-induced oxidative stress and human disease [J]. Toxicology, 2011,283(2/3):65-87.
[11] USEPA. Method 3050B: acid digestion of sediments, sludges, and soils [R]. Washington, DC: USEPA. 1996.
[12] Yin N, Cai X, Du H, et al. In vitro study of soil arsenic release by human gut microbiota and its intestinal absorption by Caco-2cells [J]. Chemosphere, 2017,168:358-364.
[13] 中国环境监测总站.中国土壤元素背景值 [M]. 北京:中国环境科学出版社, 1990.
China National Environmental Monitoring Centre. The soil environmental background value in the People’s Public of China [M]. Beijing: China Environmental Science Press, 1990.
[14] GB15618-2018 土壤环境质量标准 [S].
GB15618-2018 Standard of soil environmental quality [S].
[15] 赵科理,傅伟军,叶正钱,等.电子垃圾拆解区土壤重金属空间异质性及分布特征 [J]. 环境科学, 2016,37(8):3151-3159.
Zhao K L, Fu W J, Ye Z Q, et al. Spatial variation of soil heavy metals in an e-waste dismantling area and their distribution characteristics [J]. Environmental Science, 2016,37(8):3151-3159.
[16] 陈晓晨,黄振佳,陈雨晴,等.基于in vitro试验的中国典型土壤中砷的健康风险及影响因素 [J/OL]. 土壤学报, 2021.DOI:10.11766/ trxb202005140100.
Chen X C, Huang Z J, Chen Y Q, et al.test-based study on health risks of arsenic in typical soils of China and their influencing factors [J/OL]. Acta Pedologica Sinica, 2021. DOI:10.11766/ trxb202005140100.
[17] 孙立强,孙崇玉,刘 飞,等.淮北煤矿周边土壤重金属生物可给性及人体健康风险 [J]. 环境化学, 2019,38(7):1453-1460.
Sun L Q, Sun C Y, Liu F, et al. Bioaccessibility and health risk assessment of heavy metals in the soil around Huaibei coal mining area [J]. Environmental Chemistry, 2019,38(7):1453-1460.
[18] Pelfrene A, Waterlot C, Mazzuca M, et al. Assessing Cd, Pb, Zn human bioaccessibility in smeltercontaminated agricultural topsoils (northern France) [J]. Environmental Geochemistry and Health, 2011,33(5):477-493.
[19] Li Y, Padoan E, Ajmone-Marsan F. Soil particle size fraction and potentially toxic elements bioaccessibility: A review [J]. Ecotoxicol. Environ. Saf., 2021,209:111806.
[20] Cao P, Fujimori T, Juhasz A, et al. Bioaccessibility and human health risk assessment of metal(loid)s in soil from an e-waste open burning site in Agbogbloshie, Accra, Ghana [J]. Chemosphere, 2020,240: 124909.
[21] Li H, Li J, Li S, et al. Application of oral bioavailability to remediation of contaminated soils: method development for bioaccessible As, Pb, and Cd [M]. Twenty Years of Research and Development on Soil Pollution and Remediation in China. 2018:189-216.
[22] 林承奇,蔡宇豪,胡恭任,等.闽西南土壤-水稻系统重金属生物可给性及健康风险[J]. 环境科学, 2021,42(01):359-367.
Lin C Q, Cai Y H, Hu G R, et al. Bioaccessibility and health risks of the heavy metals in soil-rice system of southwest Fujian Province [J]. Environmental Science, 2021,42(01):359-367.
[23] Saravanan S,耿 华,谭小弟.肠道疾病中肠上皮细胞的死亡 [J]. 生理学报, 2020,72(3):308-324.
Saravanan S, Geng H, Tan X D. Cell death of intestinal epithelial cells in intestinal diseases [J]. Acta Physiologica Sinica, 2020,72(3):308- 324.
[24] Xiang P, He R W, Han Y-H, et al. Mechanisms of housedust-induced toxicity in primary human corneal epithelial cells: Oxidative stress, proinflammatory response and mitochondrial dysfunction [J]. Environment International, 2016,89-90:30-37.
[25] Gao K, Zhang Y C, Niu J B, et al. Zinc promotes cell apoptosis via activating the Wnt-3a/beta-catenin signaling pathway in osteosarcoma [J]. Journal of Orthopaedic Surgery and Research, 2020,15(1):doi: 10.1186/s13018-020-01585-x.
[26] Wang Y H, Zhao W J, Zheng W J, et al. Effects of different zinc species on cellar zinc distribution, cell cycle, apoptosis and viability in MDAMB231cells [J]. Biological Trace Element Research, 2016,170 (1):75-83.
[27] Wang K, Ma J Y, Li M Y, et al. Mechanisms of Cd and Cu induced toxicity in human gastric epithelial cells: Oxidative stress, cell cycle arrest and apoptosis [J]. Science of the Total Environment, 2021,756: 143951.
[28] Santos S, Silva A M, Matos M, et al. Copper induced apoptosis in Caco-2 and Hep-G2 cells: Expression of caspases 3, 8 and 9, AIF and p53 [J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2016,185-186:138-146.
[29] Kim A, Park S, Sung J H. Cell viability and immune response to low concentrations of nickel and cadmium: An in vitro model [J]. International Journal of Environmental Research and Public Health, 2020,17(24):9218.
[30] Xue C, Kang B, Su P, et al. MicroRNA-106b-5p participates in lead (Pb2+)-induced cell viability inhibition by targeting XIAP in HT- 22and PC12cells [J]. Toxicology in Vitro, 2020,66:104876.
[31] Husejnovic M S, Bergant M, Jankovic S, et al. Assessment of Pb, Cd and Hg soil contamination and its potential to cause cytotoxic and genotoxic effects in human cell lines (CaCo-2and HaCaT) [J]. Environmental Geochemistry and Health, 2018,40(4):1557-1572.
[32] He X, Qi Z, Hou H, et al. Structural and functional alterations of gut microbiome in mice induced by chronic cadmium exposure [J]. Chemosphere, 2020,246:125747.
[33] Maity S, Banerjee R, Goswami P, et al. Oxidative stress responses of two different ecophysiological species of earthworms (and) exposed to Cd-contaminated soil [J]. Chemosphere, 2018,203:307-317.
[34] Aziz N, Butt A, Elsheikha H M. Antioxidant enzymes as biomarkers of Cu and Pb exposure in the ground spidersand[J]. Ecotoxicology and Environmental Safety, 2020, 190:110054.
[35] Nojima Y, Ito K, Ono H, et al. Superoxide dismutases, SOD1and SOD2, play a distinct role in the fat body during pupation in silkworm Bombyx mori [J]. PLoS One, 2015,10(2):e0116007.
[36] Souid G, Souayed N, Yaktiti F, et al. Effect of acute cadmium exposure on metal accumulation and oxidative stress biomarkers of Sparus aurata [J]. Ecotoxicology and Environmental Safety, 2013,89:1-7.
[37] Atli G, Alptekin O, Tukel S, et al. Response of catalase activity to Ag+, Cd2+, Cr6+, Cu2+and Zn2+in five tissues of freshwater fish[J]. Comparative Biochemistry and Physiology, 2006,143(2):218-224.
[38] 刘 敏,赵 苒.γH2AX检测在DNA双链断裂研究中应用[J].中国公共卫生, 2015,31(6):742-746.
Liu M, Zhao R. Application of γH2AX assay in measurement of DNA double stand breaks [J]. Chinese Journal of Public Health, 2015,31(6): 742-746.
[39] 王丽娜,罗 志,张 立.DNA损伤及其标志物γ-H2AX检测的研究进展 [J]. 分析试验室, 2020,39(10):1131-1136.
Wang L N, Luo Z, Zhang L. Advances in DNA damage and the determination methodologies of the marker γ-H2AX [J]. Chinese Journal of Analysis Laboratory, 2020,39(10):1131-1136.
[40] Plappert-Helbig U, Libertini S, Frieauff W, et al. Gamma-H2AX immunofluorescence for the detection of tissue-specific genotoxicity in vivo [J]. Environmental and Molecular Mutagenesis, 2019,60(1): 4-16.
[41] Durrani K, El Din S A, Sun Y, et al. Ethyl maltol enhances copper mediated cytotoxicity in lung epithelial cells [J]. Toxicology and Applied Pharmacology, 2021,410:115354.
[42] Villatoro-Pulido M, Font R, De Haro-Bravo M I, et al. Modulation of genotoxicity and cytotoxicity by radish grown in metal-contaminated soils [J]. Mutagenesis, 2009,24(1):51-57.
Bioaccessibility and their toxic effects of heavy metal in field soils from an electronic disassembly plant.
MA Jiao-yang, TIAN Wen, WANG Kun, BAO Xin-chen, WANG Jie, CUI Dao-lei, XIANG Ping*
(Institute of Environment Remediation and Human Health, School of Ecology and Environment, Southwest Forestry University, Kunming 650224, China)., 2021,41(10):4885~4893
Recently, bioaccessibility of metals has been applied for assessing the health risk of field soils, however the bioaccessibility of metals is varied and there are few studies on the toxic effects of bioaccessible metals on human body. In this study, fives soil samples (S1-S5) from an electronic disassembly plant in Wenling, Zhejiang Province were sampled. The total concentrations and bioaccessibility of Zn, Cu, Cd and Pb in the soils were determined. Moreover, the toxic effects of bioaccessible heavy metals on human intestinal epithelial cells were also evaluated. The results demonstrated that all samples were polluted by Cd, Pb, Zn, and Cu, with the greatest concentrations of Cd (4.84mg/kg) and Cu (438.52mg/kg). The bioaccessibility of the four heavy metals in the gastric and intestinal phase was 2.10%~48.28%, 4.84%~33.73%, 16.04%~42.81%, 1.81%~15.71%, and 2.05%~36.91%, 13.17%~22.23%, 10.19%~23.10%, 0.60%~2.69%, respectively. In general, the bioaccessibility of four heavy metals in the gastric phase was lower than that in the intestine phase. After exposure to intestinal bioaccessible extracts of different soils for 24h, cell viability significantly decreased except for sample S4. In addition, there was no significant change in SOD activity after treatment with S3 and S5samples, but CAT activity was decreased. Furthermore, DNA damage was trigged by those samples. To investigate the bioaccessibility and its toxic effects of fields soils, this study provides a scientific basis for the health risk assessment of soil in China.
electronic dismantling;field soils;bioaccessibility;Caco-2;DNA damage
X53
A
1000-6923(2021)10-4885-09
马娇阳(1998-),女,河北石家庄人,西南林业大学硕士研究生,主要从事环境健康研究.发表论文7篇.
2021-02-18
国家重点研发计划项目(2018YFC1800504);云南省创新团队项目(202005AE160017);国家自然科学基金项目(41967026);国家林业和草原局林草科技创新青年拔尖人才项目(2020132613);云南省高层次人才引进计划青年人才项目(YNQR-QNRC-2018-049);云南省教育厅科学研究基金项目资助(2021Y237)
* 责任作者, 副研究员, ping_xiang@126.com
