大亚湾湿地沉积物氮矿化特征及影响因素探究
2021-10-26赵春宇江志坚吴云超刘松林黄小平刘富刚
赵春宇,江志坚,吴云超,刘松林,黄小平*,刘富刚
大亚湾湿地沉积物氮矿化特征及影响因素探究
赵春宇1,2,江志坚2,吴云超2,刘松林2,黄小平2*,刘富刚1
(1.德州学院生态与资源环境学院,山东 德州 253023;2.中国科学院南海海洋研究所,热带海洋生物资源与生态重点实验室,广东 广州 510301)
为探讨大亚湾滨海湿地沉积物中有机氮矿化作用的时空分布规律及其影响因素,于2017年3月(枯水期)和8月(丰水期)分别采集了大亚湾典型湿地3个断面的表层沉积物,利用连续淹水培养法对沉积物有机氮矿化过程进行了测定.结果发现,不同站位沉积物氮的矿化速率差异较大,其矿化速率范围为1.88~15.12mg/(kg·d),平均速率为(6.45±3.47)mg/(kg·d),整体呈现S3(红树林断面)>S1(光滩断面)>S2(河口断面)的分布规律.矿化速率的最高值出现在S3红树林断面,表明红树植物的生长能够促进微生物的矿化作用.蛋白酶和脲酶的活性平均值分别为(8.52±4.21)mg/(kg·d)和(25.34±11.11)μg/(g·d), 蛋白酶活性空间分布上与矿化速率的分布特征一致,表现为S3>S1>S2.蛋白酶和脲酶活性最高的区域均出现在S3断面的高潮带,这主要由于红树林影响地区具有较高的生产力和微生物丰度,促进了微生物代谢酶的产生.蛋白酶的活性远高于脲酶活性,表明人类活动对近岸湿地生态系统的物质输入可能主要以大分子类有机氮为主.在河口断面,矿化速率和酶活活性均较低,与该地区较高的NH4+-N含量有关.整体上,湿地沉积物矿化速率与蛋白酶和脲酶之间呈现出显著的正相关性(<0.01),说明蛋白酶和脲酶在有机氮的矿化过程中发挥了关键作用.
沉积物;有机氮矿化;酶活性;影响因素;滨海湿地
随着我国近岸地区工农业的迅猛发展,持续的污染输入已对海湾生态系统产生了严重的负面影响.人类活动产生的大量含氮营养物质肆意排入近海,造成河口及海湾等地区的富营养化程度不断增强[1-2].滨海湿地作为海陆交互作用的活跃区被称为营养物质的“源、汇转化器”,具有重要的生态功能.虽然人类活动产生的污水中部分含氮化合物经过湿地植物或藻类的吸收净化后才流入近岸水体,减缓了近海生态环境的污染,但还有相当一部分有机态氮通过湿地生态系统的截留作用储存在沉积物中. 随着国家节能减排政策的实施,政府和相关企业在污染物治理和排放方面上采取了一系列重要举措,但近岸湿地环境的富营养化趋势仍然严重,其中沉积物中营养物质的重新释放是其主要原因[3].沉积物矿化作用关系到潜在可释放营养物质对水体的富营养化贡献,受到广泛关注.
沉积物中储存了大量陆源输入的氮素,其中约80%以上是有机态氮,且不同形态之间时刻处于固持-矿化的动态平衡中[4].有机氮的矿化作用是滨海湿地生态系统中物质再循环的重要反应过程,通过矿化微生物的作用将沉积物前期存储的有机氮转换为无机氮,重新释放到间隙水或上覆水体中被植物吸收利用,或在潮汐的作用下直接进入近岸水体,从而增加了水体富营养化潜在风险[5].沉积物中的酶是一类存在于沉积物中、能催化有机质生物化学反应的功能蛋白质,其活性的高低可用于表征沉积物微生物活性[6].蛋白酶和脲酶是有机氮矿化过程中两种高度专一性酶,其中蛋白酶能够将大分子蛋白质、肽类催化水解为氨基酸,而脲酶则能将小分子尿素水解为氨氮[7].已有研究发现沉积物中蛋白酶、脲酶的活性与有机质含量和总氮含量呈正相关关系,在沉积物有机氮转化过程中具有重要作用[8-9]. Cao等[10]对黄河三角洲地区的研究发现,蛋白酶和脲酶在的影响下活性增高,进而促进了沉积物有机氮的矿化速率.常晶晶[11]通过湿地土壤的培养发现,有机氮的输入能促进脲酶的活性,进而促进有机氮的矿化.因此,对不同类型湿地沉积物有机氮矿化速率及其关键酶活的研究有助于进一步加强对近海生态系统中氮的生物地球化学过程的认知.
大亚湾是我国东南沿海地区最主要的亚热带海湾之一.近几十年来随着周边经济的快速发展和人口的迅猛增加,大亚湾生态环境受人类活动的影响显著.大量人为排放的有机营养物被滨海湿地生态系统所截留,在微生物矿化过程的作用下不断向环境中缓慢释放,造成水质持续恶化.目前,国内外对有机氮矿化的相关研究主要集中在单一环境因子关系的研究,例如pH值、含水率、温度、植物、土壤类型等对矿化速率的直接影响[12-15],而针对野外综合环境因子与土壤矿化酶活性的交互影响研究相对较少.此外,当前的研究区域也主要集中在森林、农田、草原、湖泊等区域[16-19],而针对滨海湿地的相关研究相对不足.因此,本研究在富营养化背景下,结合关键酶活性,以大亚湾周边三种典型的滨海湿地为研究对象,分别采集丰水期和枯水期表层沉积物进行室内培养实验.探讨了不同环境条件下湿地沉积物的矿化作用及影响因素,初步揭示了人类活动导致的营养盐输入和湿地植物对有机氮矿化的影响机制,为氮素生物地球化学循环深入研究及湿地的开发和保护提供科学依据.
1 材料与方法
1.1 研究区域及站位
大亚湾114.5°E~114.9°E,22.4°N~22.9°N,是典型的亚热带半封闭海湾,总面积600km2,海岸线长度约为92km.该地区降水主要集中在每年的4~9月,属于亚热带海洋性气候.本研究分别于2017年3月和8月对大亚湾3个典型的滨海湿地进行了高潮带(HT)、低潮带(LT)和潮下带(ST, 低潮时水深约为3m)共9个站位进行采样,采样站位如图1所示.其中,S1位于大鹏澳主要为光滩湿地断面,实测上覆水溶解无机氮(DIN)约16.6μmol/L,为低营养负荷区;S2位于淡澳河口湿地,DIN含量约706.1μmol/L,为高营养负荷区;S3位于红树林湿地,分布有大面积红树林,DIN含量约87.1μmol/L,营养水平处于中等.
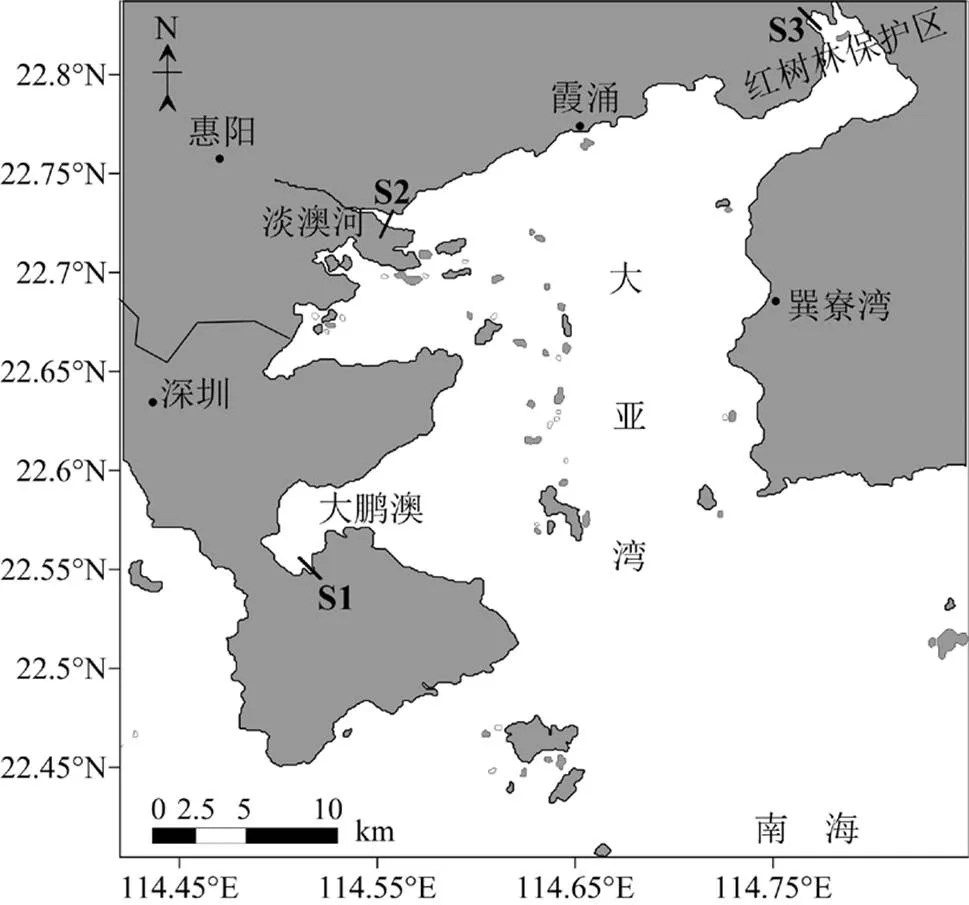
图1 大亚湾滨海湿地采样站位示意
1.2 样品采集与分析
采用抓斗采样器采集沉积物表层(0~5cm)样品.每个站点随机采集3份平行样品,共采集27份样品.鲜样去除可见杂质并混匀后,一部分4℃冷藏,用于室内矿化培养实验,另一部分自然风干,用于酶活性、粒径和氮形态等指标测定.在高潮时采集各站位底层海水,经=0.22μm的滤膜过滤后冷藏保存,用于室内培养和营养盐含量的测定.
水质参数温度、盐度及DO等指标使用YSI 6600多参数测量仪进行测定.沉积物粒径采用Mastersizer 2000型激光粒度分析仪进行分析,检测限为0.02~2000μm;沉积物碳氮元素含量的测定使用元素分析仪(Flash EA 3000Thermo Scientific, Milan, Italy);营养盐的测定参见《海洋监测规范》(GB17378. 4-2007),所用仪器为营养盐自动分析仪(Lachat Inc., Quickchem 8500, USA).NO3--N的检测限为0.1μmol/L,NO2--N和NH4+-N检测限为0.01μmol/L;酶活的测定使用试剂盒法(Comin Biotechnology Co.,Ltd.,Suzhou);微生物量氮(MBN)的测定方法为氯仿熏蒸-K2SO4提取-流动分析仪测定法.
1.3 矿化速率的测定
本实验样品为大亚湾滨海湿地沉积物,受潮汐的影响,高潮时沉积物会被海水淹没.因此,本研究中的矿化速率采用淹水连续培养法进行测定.取15g新鲜土样加入30mL经0.22μm滤膜过滤的原位水于100mL培养瓶中,水土比2:1[20].在原位温度(丰水期为26℃,枯水期为17℃)下恒温预培养12h进行活化,之后分别在0d、7d、14d、21d取2mL泥浆,加入0.3g的KCl固体,振荡2h,4000r/min离心后用GF/F滤膜过滤,利用小体系营养盐测定方法对沉积物中的DIN(NO2--N、NO3--N、NH4+-N)进行测定.培养期间采用称重法保持水分恒定.矿化速率参照以下公式进行计算[21]:
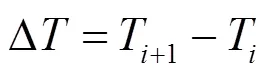
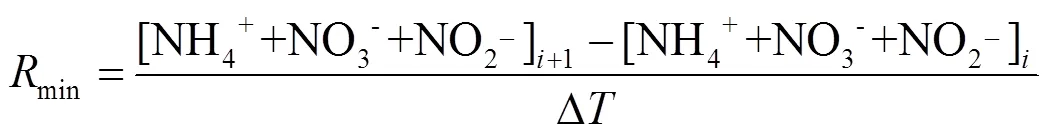
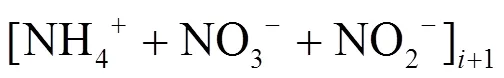
通过测定样品在不同培养温度下,相同培养时间沉积物氮矿化速率的比值计算其温度敏感性,计算公式如下[22]:
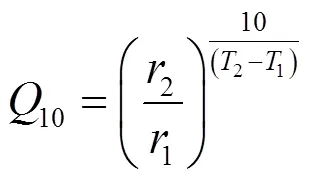
式中:1、2分别为培养温度1、2时的氮矿化速率.
1.4 数据分析与处理
数据分析及作图使用Excell 2013、Origin 9.0、Surfer 13.0等软件,利用SPSS 24.0 统计学软件对数据进行方差分析(ANOVA), 统计检验的显著性水平为=0.05.
2 结果与讨论
2.1 湿地沉积物理化特征
由表1可以看出,大亚湾湿地沉积物的含水率在20.51%~59.13,含水率最低的站位出现在S1光滩湿地断面的高潮带,最高值出现在S3红树林断面的潮下带,并且在丰水期和枯水期含水率无显著的季节性差异(ANOVA,>0.05).沉积物微生物量氮(MBN)的含量变化范围为18.71~102.76mg/kg,在枯水期和丰水期的平均值分别为(49.91±25.81)mg/kg和(68.45±26.47)mg/kg,丰水期均高于枯水期,这主要归因于丰水期相对较高的温度促进了微生物活性和繁殖,从而促进了氮转化过程,这与本实验实测的矿化和硝化速率在丰水期大于枯水期的结果相吻合.不同断面间比较发现,MBN的整体空间分布表现为S3(红树林)>S2(河口)>S1(光滩),具有显著的断面差异(ANOVA,<0.05).S2河口断面沉积物间隙水中高含量的NH4+-N(平均约为767.2μmol/L)对微生物产生了毒害作用,抑制了微生物的生长繁殖,从而使MBN含量低于红树林断面[23].S3断面位于红树林影响区,有机质丰富,微生物活性和丰度较高,因此MBN含量最高.沉积物有机碳(TOC)的变化范围在枯水期和丰水期分别为0.49%~1.51%和0.66%~ 1.73%,平均含量分别为(1.04±0.30)%和(1.26±0.29)%.总氮(TN)变化范围在枯水期和丰水期分别在0.05%~0.17%和0.10%~0.20%,平均含量分别为(0.13±0.04)%和(0.15±0.03)%.两者的最高值均出现在S1断面的潮下带,主要由于该站位位于养殖区内沉积物营养物质丰富.总体上,TOC和TN具有相似的变化趋势,由于丰水期降雨对近岸陆源营养物质的冲刷作用,使得两者含量均表现为丰水期大于枯水期.红树林湿地由于其较高的生产力,具有较高的TOC和TN含量.
由表2可见,在S1和S3断面沉积物沙质含量呈现出由高潮带至潮下带逐渐降低的趋势,沙质含量最高的站位出现在S1断面的高潮带,占了73.9%,而S2断面沉积物的各个粒级组成无显著变化,三个断面粘土含量表现为S3>S2>S1.正是由于S1光滩湿地沉积物的砂质含量较高,其吸附能力较弱,有机质含量较低,使得MBN、TOC和TN的含量最低.
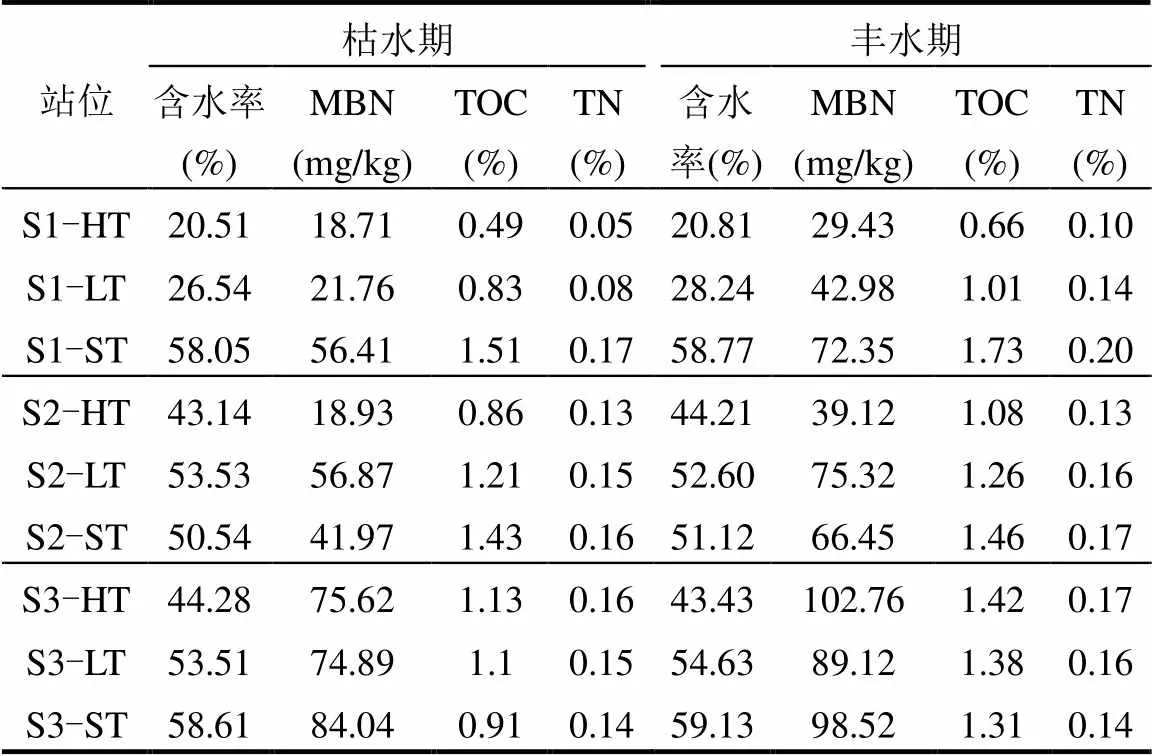
表1 大亚湾滨海湿地沉积物理化因子特征
注:站位编号见1.1节.
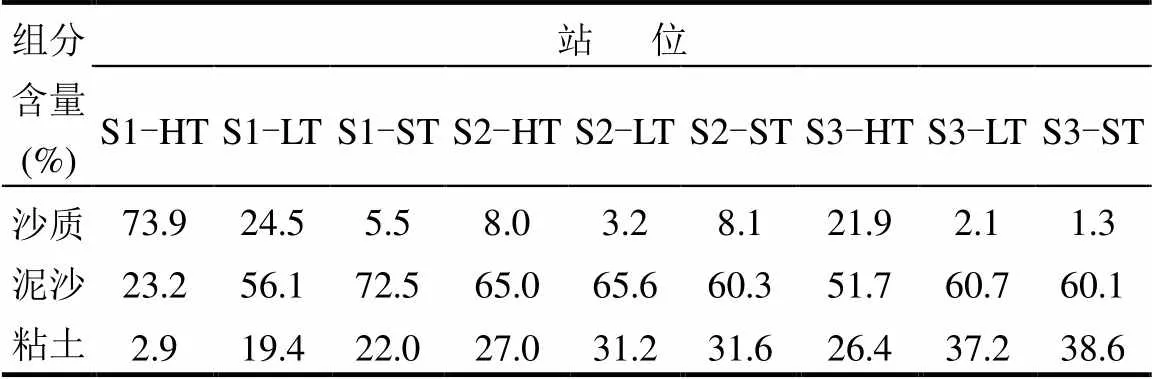
表2 大亚湾滨海湿地沉积物粒级组成
注:站位编号见1.1节.
2.2 沉积物矿化速率特征
沉积物复杂多变的环境条件,决定了有机氮矿化速率时空分布的异质性.本研究通过进行室内淹水培养实验估算了大亚湾湿地沉积物有机氮矿化速率.如图2所示,各站位滨海湿地沉积物氮的矿化速率差异较大(<0.05),其矿化速率范围在1.88~ 15.12mg/(kg·d),平均速率为(6.45±3.47)mg/(kg·d).不同断面之间整体呈现S3>S1>S2的分布规律.其矿化速率的最高值均出现在T3红树林断面,丰水期和枯水期矿化速率分别为(11.39±3.47)mg/(kg·d)和(8.48± 3.26) mg/(kg·d),表明红树植物的生长能够促进微生物的矿化作用.一方面红树林地区的沉积物中具有较高的微生物种类和丰度,较高的MBN含量间接反映了该地区较高的微生物活性;另一方面红树植物在生长过程中根系分泌物和凋落物的腐败分解为矿化微生物提供了充足的能源物质.矿化速率最低值则出现在S2淡澳河河口断面,丰水期和枯水期矿化速率分别为(4.55±0.67)mg/(kg·d)和(2.51±0.57) mg/(kg·d).与S1光滩断面相比,虽然S2淡澳河河口断面沉积物中有机质反应底物充足,但沉积物中高浓度的NH4+-N对矿化微生物产生了毒害作用[23].此外,NH4+-N还是矿化过程的产物,高浓度的产物可以抑制矿化过程的正向进行.
不同潮位之间比较发现,在S1光滩湿地断面,矿化速率最高值出现在潮下带,主要与潮下带长期被上覆水覆盖,沉积物的氧化还原电位较低有关,因为有机氮的矿化主要是在厌氧条件下进行的.而在其余两个断面,由于淡澳河和红树林的影响,最高值出现在有机质含量较高的潮位.
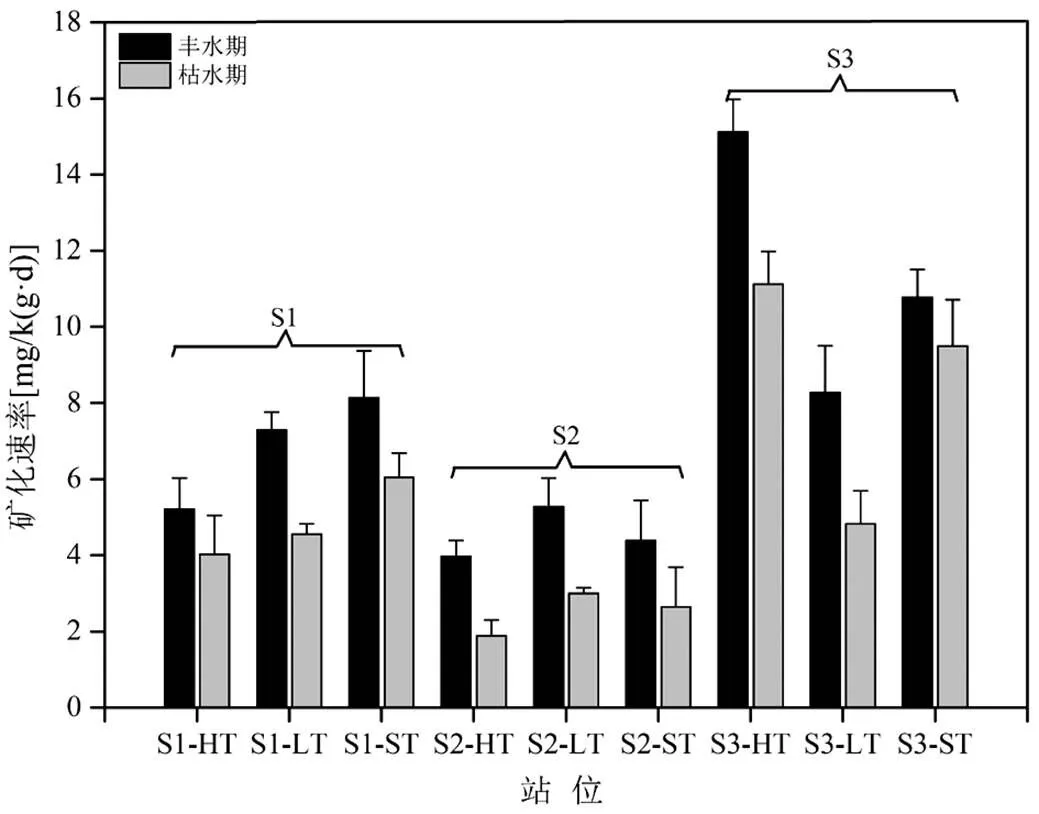
图2 大亚湾湿地沉积物有机氮矿化速率时空分布特征
沉积物矿化速率具有明显的季节差异,丰水期(7.61±3.57)mg/(kg·d)高于枯水期(5.29±3.13) mg/ (kg·d).沉积物氮矿化的温度敏感系数(10) 可作为不同基质氮矿化对温度升高响应的敏感系数[20],整体上表现为S2>S1>S3的分布规律.为探明不同湿地类型和不同潮位的沉积物有机氮矿化过程对温度变化的响应,本研究计算了大亚湾湿地沉积物的10指数,结果如图3 所示.整体上,大亚湾滨海湿地不同站位沉积物的氮矿化速率10平均值为1.63,敏感指数均大于1,但远低于全球平均值为2.21,说明温度对大亚湾湿地沉积物的矿化作用有一定的促进作用,但对温度的敏感性不高[24].研究表明10会随着纬度的增高而增大,而大亚湾地区位于低纬度地区,四季温差变化幅度较小[25].
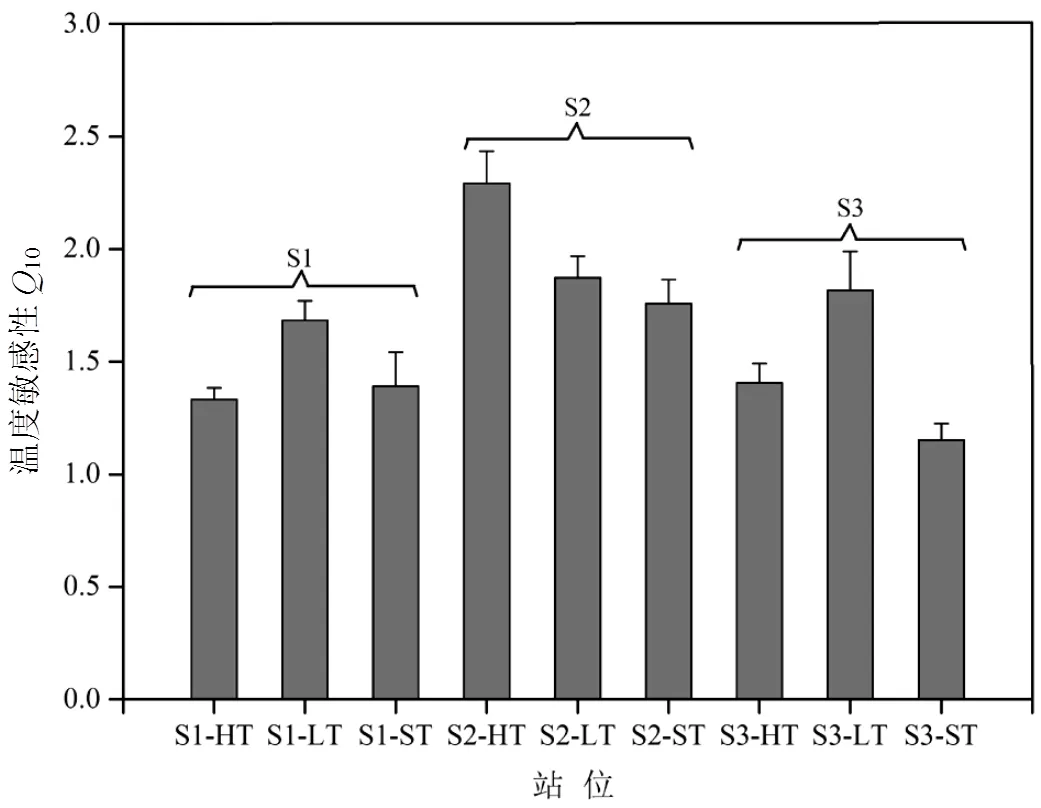
图3 大亚湾湿地沉积物净氮矿化过程的温度敏感性
2.3 沉积物酶活性特征
酶是微生物新陈代谢的产物,是催化自然界中有机质降解的重要物质.蛋白酶是一类作用于肽键的水解酶,主要分解大分子蛋白质、多肽等物质,而脲酶则是促进了尿素、酰胺等小分子有机氮的水解,这两种酶是自然界中有机氮矿化降解的关键酶[26].从图4中可以看出,大亚湾沉积物中蛋白酶和脲酶的活性分别为2.35~18.05mg/(g·d)和10.99~47.45μg/ (g·d),平均值分别为(8.52±4.21)mg/(g·d)和(25.34± 11.11)μg/(g·d).沉积物蛋白酶活性的分布特征具有显著的季节变化(ANOVA,<0.05),丰水期高于枯水期,平均活性分别为(10.76±3.57)mg/(g·d)和(6.28± 3.80)mg/(g·d).空间分布上与矿化速率的分布特征一致,表现为S3>S1>S2,S1~S3断面的平均值分别为:(8.09±3.59)mg/(g·d)、(7.01±2.25)mg/(g·d)和(10.45 ±5.90)mg/(g·d).沉积物脲酶活性的分布特征季节差异不明显,丰水期的平均值略高于枯水期,平均活性分别为(26.47±11.70)μg/(g·d)和(24.22±11.06)μg/(g·d).空间分布上表现为S3>S2>S1,S1~S3断面的平均值分别为:(17.83±5.16)μg/(g·d)、(19.71±4.95)μg/(g·d)和(38.49±7.42)μg/(g·d).整体上,蛋白酶的活性远高于脲酶活性,说明人类活动对近岸湿地生态系统的物质输入可能主要以大分子类有机氮为主.

由表3可见,大亚湾湿地沉积物中蛋白酶和脲酶的活性与TOC的含量呈显著正相关关系,这与前人的研究结果相一致,高TOC含量为微生物新陈代谢提供的能量,促进了微生物的生长繁殖和活性,使得代谢产物增加.沉积物中TN含量的增加可以显著诱导蛋白酶和脲酶的产生[8].此外,高浓度的TN可以为有机氮的矿化提供大量的底物[27].本研究中,蛋白酶和脲酶活性最高的区域均出现在S3红树林断面的高潮带,这主要由于红树林影响地区具有较高的生产力和微生物丰度,促进了微生物代谢过程中水解酶的产生.在S2淡澳河河口断面,两种酶的酶活活性较低,可能是与该地区较高的NH4+-N含量有关[23].在S1断面的潮下带,由于靠近养殖区,有机质含量丰富,蛋白酶和脲酶的活性也较高,这与甘茂林等[7]的研究结果一致.人类活动引起沉积物营养条件的改变、盐沼植物分布等对酶活的空间分布具有重要作用[28].

表3 湿地沉积物蛋白酶和脲酶活性与环境因子的关系
注:*£0.05;**£0.01;数字代表相关系数.
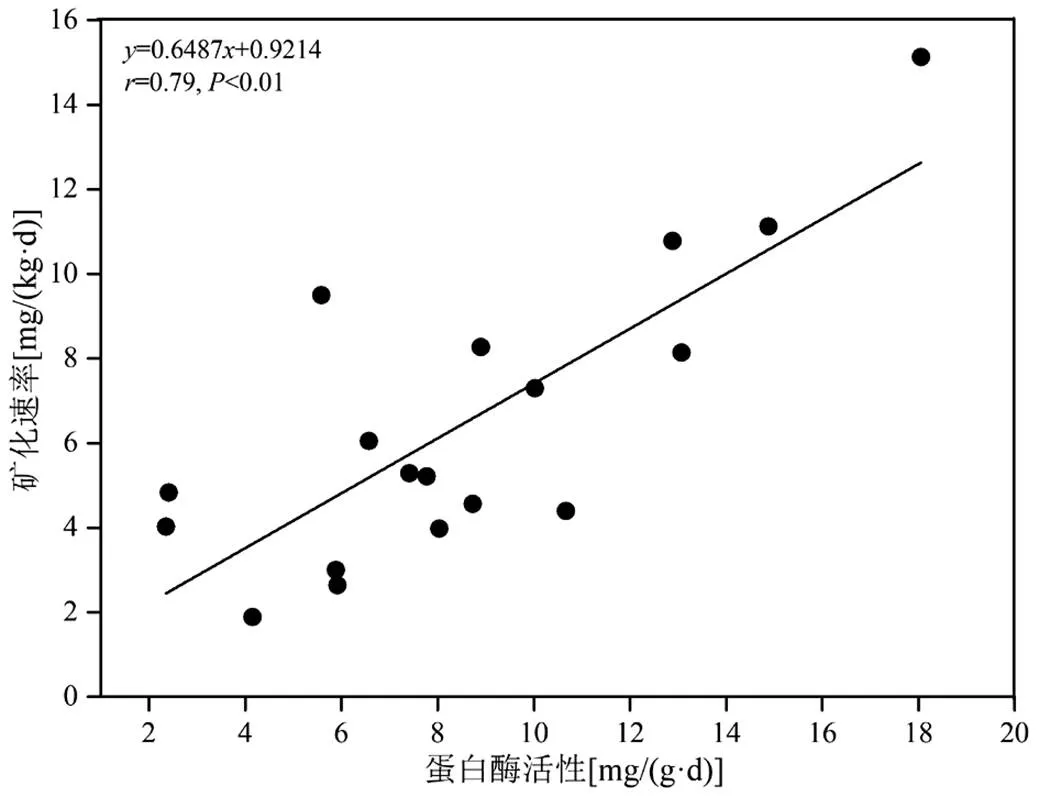
湿地沉积物矿化速率与蛋白酶和脲酶之间在不同季节均呈现出了显著的正相关性(<0.01,图5),间接表明蛋白酶和脲酶在有机氮的矿化过程中起到重要调控作用,这与前人研究结论相似[7].蛋白酶和脲酶是有机氮转化中十分重要的水解酶,其中蛋白酶能够将大分子的蛋白质、肽类等水解为氨基酸,而脲酶则是小分子尿素催化水解的高度专一性酶[26].
3 结论
3.1 大亚湾湿地沉积物MBN含量在丰水期显著高于枯水期,说明丰水期相对较高的温度能够促进氮转化微生物的生长繁殖.
3.2 不同类型湿地沉积物氮矿化速率差异较大(<0.05),断面之间呈现S3>S1>S2的分布规律.矿化速率最高值出现在红树林断面,最低值出现在富营养化严重的河口断面,表明红树植物的生长能够促进微生物的矿化过程,而高浓度的NH4+-N则抑制矿化过程的发生.
3.3 蛋白酶和脲酶活性的空间分布特征与矿化速率的分布一致,且与TOC和TN呈显著正相关,高值出现在红树林断面,主要归因于红树林地区具有较高的生产力和微生物丰度,促进了微生物酶的产生和释放.酶活性在河口地区较低,与该地区较高NH4+-N含量抑制了微生物胞外酶的分泌有关.
3.4 湿地沉积物矿化速率与蛋白酶和脲酶之间在不同季节均呈现出了显著的正相关性(<0.01),间接反映出蛋白酶和脲酶在有机氮的矿化过程中起到重要调控作用.
3.5 整体上,蛋白酶的活性远高于脲酶活性,表明人类活动对近岸湿地生态系统的物质输入可能主要以大分子类有机氮为主.
[1] Howarth R W, Sharpley A, Walker D. Sources of nutrient pollution to coastal waters in the United States: implications for achieving coastal water quality goals [J]. Estuaries, 2002,25(4):656-676.
[2] Scavia D, Bricker S B. Costal eutrophication in the assessment in the United States [J]. Biogeochemistry, 2006,79:187-208.
[3] 史玲珑,张 莉,王圣瑞,等.洱海沉积物溶解性有机氮释放及环境影响机制[J]. 中国环境科学, 2017,37(7):2715-2722.
Shi L L, Zhang L, Wang S R. Releasing characteristic of sediment dissolved organic nitrogen (DON) from Erhai Lake and its environmental impact mechanism [J]. China Environmental science, 2017,37(7):2715-2722.
[4] 何清溪,张 穗,方正信,等.大亚湾沉积物中氮和磷的地球化学形态分配特征 [J]. 热带海洋, 1992,11(2):38-45.
He Q X, Zhang H, Fang Z X, et al. Distribution characteristics of the environmental geochenical forms for nitrogen and phosphorus in the sediments of Daya Bay [J]. Tropico Ceanology, 1992,11(2):38-45.
[5] 谢蓉蓉,李家兵,张党玉,等.闽江河口湿地沉积物氮矿化对盐度响应研究[J]. 中国环境科学, 2017,37(6):2248-2254.
Xie R R, Li J B, Zhang D Y, et al. Salinity effects on the nitrogen mineralization in different wetland sediments of the Min River Estuary [J]. China Environmental Science, 2017,37(6):2248-2254.
[6] Fabiano M, Danovaro R. Enzymatic activity,bacterial distribution,and organic matter composition in sediments of the Ross Sea (Antarctica) [J]. Applied and Environmental Microbiology, 1998,64(10):3838-3845.
[7] 甘茂林,张景平,江志坚,等.大亚湾沉积物中可溶性有机氮与蛋白酶和脲酶活性特征及其影响因素[J]. 海洋环境科学, 2016,35(6):806-813.
Gan M L, Zhang J P, Jiang Z J, et al. Characteristics of dissolved organic nitrogen and key enzyme activities in the surface sediment of Daya bay and its influencing factors [J]. Marine Environmental Science, 2016,35(6):806-813.
[8] 齐继薇,刘长发,刘 远,等.双台河口潮滩湿地不同植被沉积物脲酶、蛋白酶、磷酸酶活性及其与氮、磷含量关系 [J]. 水生态学杂志, 2014,35(4):1-7.
Qi J W, Liu C F, Liu Y, et al. Activities of urease, protease, phosphatase and their relationships with contents of nitrogen and phosphorus in sediments of tidal flat wetland vegetation of Shuangtai estuary [J]. Journal of Hydroecology, 2014,35(4):1-7.
[9] Li X F, Hou L J, Liu M, et al. Primary effects of extracellular enzyme activity and microbial community on carbon and nitrogen mineralization in estuarine and tidal wetlands [J]. Applied Microbiology and Biotechnology, 2015,99(6):2895-2909.
[10] Cao D, Shi F, Koike T. Halophyte plant communities affecting enzyme activity and microbes in salinity soils of the Yellow River Delta in China [J]. Soil Air and Water, 2014,42:1433-1440.
[11] 常晶晶.生物炭、天然生物质和有机氮肥对黄河三角洲滨海湿地土壤有机氮矿化的影响 [D]. 青岛:中国海洋大学, 2015.
Chang J J. Effects of biochar, nature biomass and organic N fertilizer application on organic nitrogen mineralization in the Yellow River Delta coastal wetland [D]. Ocean University of China, 2015.
[12] 赵琦齐,沈玉娟,李 平,等.温度对太湖湖滨带不同水分梯度土壤氮矿化的影响 [J]. 南京林业大学学报(自然科学版), 2011,35(6):147-150.
Zhao Q Q, Shen Y J, Li P, et al. Responses of soil nitrogen mineralization to temperature along soil moisture gradients in the riparian zone of Taihu Lake [J]. Journal of Nanjing Forestry University (Natural Science Edition), 2011,35(6):147-150.
[13] Guntias M E, Leiros M C, Trasar-Cepeda C, et al. Effects of moisture and temperature on net soil nitrogen mineralization: a laboratory study [J]. European Journal of Soil Biology, 2012,48:73-80.
[14] 牟晓杰,孙志高,刘兴土.黄河口典型潮滩湿地土壤净氮矿化与硝化作用 [J]. 中国环境科学, 2015,35(5):1466-1473.
Mou X J, Sun Z G, Liu X T. Net nitrogen mineralization and nitrification in the tidal marsh soils of the Yellow River Estuary [J]. China Environmental Science, 2015,35(5):1466-1473.
[15] Maltais-Landry G, Maranger R, Brisson J, et al. Nitrogen transformations and retention in planted and artificially aerated constructed wetlands [J]. Water Research, 2009,43(2):535-545.
[16] 赵琦齐.太湖湖滨带湿地土壤氮矿化动态 [D]. 南京:南京农业大学, 2011.
Zhao Q Q. Study of nitrogen mineralization dynamics in soil of Taihu Lake zone [D]. Nanjing: Nanjing Forest University, 2011.
[17] 周才平,欧阳华.温度和湿度对暖温带落叶阔叶林土壤氮矿化的影响 [J]. 植物生态学报, 2001,25(2):204–209.
Zhou C P, Ouyang H. Temperature and Moisture Effects on Soil Nitrogen Mineralization in Deciduous Broad-leaved Forest [J]. Acta Phytoecologica Sinica, 2001,25(2):204–209.
[18] 余 泺,高明,慈 恩,等.不同耕作方式下土壤氮素矿化和硝化特征研究 [J]. 生态环境学报, 2010,19(3):733–738.
Yu L, Gao M, Ci E, et al. Study on the characteristics of mineralization and nitrification in different cultivation modes [J]. Ecology and Environmental Sciences, 2010,19(3):733–738.
[19] 朱剑兴,王秋凤,何念鹏,等.内蒙古不同类型草地土壤氮矿化及其温度敏感性 [J]. 生态学报, 2013,33(19):6320–6327.
Zhu J X, Wang Q F, He N P, et al. Soil nitrogen mineralization and associated temperature sensitivity of different Inner Mongolian grasslands [J]. Acta Ecologica Sinica, 2013,33(19):6320–6327.
[20] 刘 丹,张 帅,唐玉姣,等.三峡支流消落带表层沉积物氮矿化动力学参数估算 [J]. 农业环境科学学报, 2018,37(4):766-773.
Liu D, Zhang S, Tang Y J, et al. Parameter estimates of sediment nitrogen mineralization kinetics in the water level fluctuation zone of a Three Gorges Reservoir tributary [J]. Journal of Agro-Environment Science, 2018,37(4):766-773.
[21] Khoi C, Guong V, Merckx R. Predicting the release of mineral nitrogen from hypersaline pond sediments used fou brine shrimp Artemia franciscana production in the Mekong Delta [J]. Aquaculture, 2006,257(1):221-231.
[22] 高俊琴,欧阳华,张 锋,等.若尔盖高寒湿地土壤氮矿化对温度和湿度的响应 [J]. 湿地科学, 2008,6(2):229-234.
Gao J Q, Ouyang H, Zhang F, et al. The Response of Soil N Nitrogen Mineralization to Soil Temperature and Soil Moisture in Zoige Alpine Wetland [J]. Wetland Science, 2008,6(2):229-234.
[23] Li X Z, Zhao Q L. Inhibition of microbial activity of activated sludge by ammonia in leachate [J]. Environment International, 1999,25:961-968.
[24] 田飞飞,纪鸿飞,王乐云,等.施肥类型和水热变化对农田土壤氮素矿化及可溶性有机氮动态变化的影响 [J]. 环境科学, 2018,39(10): 4717-4726.
Tian F F, Ji H F, Wang L Y, et al. Effects of various combinations of fertilizer, soil moisture and temperature on nitrogen mineralization and soluble organic nitrogen in agricultural soil [J]. Environment Science, 2018,39(10):4717-4726.
[25] Liu Y, Wang C H, He N P, et al. A global synthesis of the rate and temperature sensitivity of soil nitrogen mineralization: latitudinal patterns and mechanisms [J]. Global Change Biology, 2017,23(1):455-464.
[26] Zhang W. Effects of crop stubble on soil enzyme activities and microbes [J]. Soil fertilizer science, 1993,5:12-14.
[27] Kader M, Sleutel S, Begum SA, et al. Nitrogen mineralization in sub-tropical paddy soils in relation to soil mineralogy, management, pH, carbon, nitrogen and iron contents [J]. European journal of soil science, 2013,64(1):47–57.
[28] 李倩茹,符夏梨.红树林土壤微生物与土壤酶活性分析 [J]. 广东农业科学, 2009,(7):93-96.
Li Q R, Fu X L. Soil microorganisms and activity of soil enzymes in mangrove [J]. Guangdong Agriculture Sciences, 2009,(7):93-96.
Sediment nitrogen mineralization characteristics and its influencing factors in coastal wetlands of Daya Bay.
ZHAO Chun-yu1,2, JIANG Zhi-jian2, WU Yun-chao2, LIU Song-lin2, HUANG Xiao-ping2*, LIU Fu-gang1
(1.School of Ecology, Resources and Environment, Dezhou University, Dezhou 253023, China;2.Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China)., 2021,41(10):4843~4849
To explore the spatial and temporal distribution of the organic nitrogen mineralization process in sediment and the corresponding influencing factors, the sediment organic nitrogen mineralization rates were determined with continuous waterlogging culture of coastal wetland in Daya bay which has been collected during March (dry season) and August (wet season) in 2017. The results showed that the mineralization rates of these stations varied significantly, ranging from 1.88 to 15.12mg/(kg·d), with an average rate of (6.45±3.47)mg/(kg·d), and showed a tendency of the distribution of S3 (mangrove section)>S1 (light beach section) >S2 (estuarine section). The highest mineralization rate in the section of S3, indicated that the growth of mangrove plants could promote the mineralization of microorganisms. The mean values of the activity of protease and urease were (8.52±4.21)mg/(g·d) and (25.34±11.11)g/(g·d), respectively. The spatial distribution of protease activial was consistent with the tendency of the mineralization rate. The highest activity of protease and urease in the high tidal of S3 were mainly because of the boosting production of metabolism enzymes induced by the high productivity and abundance of microorganisms in mangrove forest zone. The higher activity of protease than that of urease suggested that the input of human activities to the coastal wetland mainly by macromolecular organic nitrogen. The lower mineralization rate and enzyme activity in estuarine section was related to the higher NH4+-N content in this area. Generally, significant positive correlation between the mineralization rate and protease and urease (<0.01) were detected, inferring that protease and urease played a key role in the mineralization of organic nitrogen.
sediment;mineralization of organic nitrogen;enzyme activity;influencing factors;coastal wetlands
X142
A
1000-6923(2021)10-4843-07
赵春宇(1989-),男,山东烟台人,讲师,博士,主要从事湿地氮循环方面的研究.发表论文20余篇.
2021-03-18
山东省自然科学基金资助项目(ZR2020QC052);国家“973计划”项目(2015CB452905);德州学院博士启动基金资助(2019xjrc338)
* 责任作者, 研究员, xphuang@scsio.ac.cn
