荭草苷调节微管稳定以促进脊髓损伤后轴突再生
2021-10-26周佳瑛赖嘉新吴志炫黄蕾蕾董晨琳陈子怡
钱 浩, 林 芝#, 周佳瑛, 赖嘉新, 吴志炫, 黄 溶, 黄蕾蕾, 董晨琳,陈子怡, 王 特*
(1.温州医科大学附属第二医院,温州医科大学育英儿童医院,浙江 温州 325027;2.温州医科大学第一临床医学院,温州医科大学信息与工程学院,浙江 温州 325035;3.温州医科大学仁济学院,浙江 温州 325035)
脊髓损伤(spinal cord injury, SCI)预后不良并伴有一系列并发症[1]。与周围神经系统或胚胎期的中枢神经系统不同,成年哺乳动物的中枢神经系统在发生损伤后,轴突再生极为有限[2-3]。轴突再生障碍主要由神经元发育成熟过程中本身生长动力的减弱以及损伤后抑制性细胞微环境的形成所导致,这也是脊髓损伤预后不良的关键与治疗的难点[4]。近年来,细胞骨架动力学作为轴突再生的关键因素受到广泛关注。微管作为细胞骨架的关键组分,在正常神经元中,其结构稳定,平行排列并聚集成束,并延伸至轴突末端参与组成生长锥,进而参与轴突生长[5];而脊髓损伤后,微管的稳定性被打破,轴突再生被显著抑制[6]。多项研究表明,通过药理作用增加微管稳定性能够激活轴突再生潜能从而改善脊髓损伤后的运功功能,促进恢复,因此调节微管稳定性可作为脊髓损伤治疗的重要研究方向[7-8]。荭草苷(Orientin,ORT)是一种C-糖基类黄酮,主要提取自刚竹属竹叶、圣罗勒、西番莲、乌蕨和金莲花等药用植物中。根据已有研究报道,荭草苷具有神经保护、抗心肌缺血、抗炎、抗氧化、抗凋亡等作用[9-12]。但荭草苷在脊髓损伤模型中尚未报道,其治疗功能不明,作用机制不清。本研究发现:荭草苷给药可以稳定微管以激活轴突再生潜能,从而促进脊髓损伤大鼠的运动功能恢复,表明荭草苷具有作为治疗脊髓损伤候选药物的潜力。
1 材料
1.1 动物 成年雌性SD大鼠8周龄,体质量220~230 g,共36只,购自中国科学院上海实验动物中心(上海斯莱克实验动物有限责任公司),实验动物生产许可证号SCXK(沪)2017-0005。
1.2 药物与试剂 荭草苷(纯度≥98%,CAS号28608-75-5,批号MUST-19071508)对照品购自成都曼思特生物科技有限公司。CCK-8试剂盒(货号CA1210)、胰蛋白酶-EDTA消化液(货号T1320)、DAPI复染试剂(货号D8200)购自北京索莱宝科技有限公司;Hank’s缓冲液(货号13150016)、DMEM/F-12培养基(货号11320033)、神经元基础培养基(货号21103049)、TRIzol试剂(货号15596018)、2% B27(货号17504044)、0.5 mmol/LL-谷氨酰胺(货号21051024)、胎牛血清(货号10100147)购自美国Thermo Fisher Scientific公司;兔抗GAP43抗体(货号ab16053)、兔抗Tuj-1抗体(货号ab18207)、兔抗GAPDH抗体(货号ab9485)、兔抗Ace-tubulin抗体(货号ab179484)、兔抗GFAP抗体(货号ab7260)购自英国Abcam公司;兔抗Tyr-tubulin抗体(货号MAB1864-I)购自美国Sigma-Aldrich公司;BCA试剂盒(货号P0012)购自上海碧云天生物技术有限公司。
1.3 仪器 Thermo 8000系列水套式3429 CO2细胞培养箱、ABI QuantStudio5 实时荧光定量PCR仪(美国Thermo Fisher Scientifie公司);Infinite M200 Pro多功能酶标仪(瑞士Tecan公司);Western blot电泳仪、转膜仪(美国Bio-Rad公司);ECLIPSE 80i 共聚焦荧光显微镜(日本Nikon公司)。
2 方法
2.1 原代神经元细胞培养及氧糖剥夺模型建立 原代神经元提取自新生SD乳鼠,皮质与大脑剥离、清理血管后,将皮质组织剪切成小块,置于预冷的Hank’s缓冲液中,在37 ℃下用0.125%胰蛋白酶-EDTA处理25 min,溶液用100 μm细胞过滤器过滤,1 000 r/min离心5 min。细胞沉淀重悬于完全DMEM/F-12培养基中,并放置在37 ℃下含5% CO2、空气湿润的培养箱中孵育,4 h后将培养基更换为含有2% B27、0.5 mmol/LL-谷氨酰胺的神经元基础培养基,继续在上述条件中培养,每隔3 d更换1次培养基。氧糖剥夺(OGD)处理细胞,模拟体外脊髓损伤,吸取神经元细胞原有的培养基,PBS洗3次,加入无糖DMEM培养基,置于三气孵育培养箱[O2/CO2/N2(1%/5%/94%)]中处理,使细胞处于氧糖剥夺状态,将神经元细胞置于氧糖剥夺(OGD)环境中作用6 h,同时不给予或给予不同浓度荭草苷处理48 h。根据以上处理因素将细胞分为空白对照组、OGD组、OGD+荭草苷组,进行CCK-8细胞增殖-毒性检测、RT-qPCR、免疫荧光染色、Western Blot分析。
2.2 荭草苷细胞毒性检测 将100 μL神经元悬液置于96孔板中,孵育24 h后,向各孔中加入不同浓度(0、2.5、5、10、25、50 μmol/L)荭草苷再孵育48 h,滴加10 μL CCK8溶液,将细胞与含90 μL培养基、10 μL CCK-8、100 μL CCK-8的混合物在37 ℃下培养2 h,在450 nm波长处测定吸光度,确定细胞活力。
2.3 RT-qPCR检测 用OGD处理神经元细胞后,加入不同浓度(0、2.5、5、10、25、50 μmol/L)荭草苷,3 d后使用TRIzol试剂从神经元细胞中提取总RNA以合成cDNA。对样品中Nefh、Gap43 mRNA表达进行分析,引物见表1。

表1 RT-qPCR引物序列
2.4 Western Blot检测 分别向空白对照组、OGD组、OGD+荭草苷组神经元细胞中加入RIPA裂解缓冲液提取总蛋白,BCA试剂盒定量总蛋白,SDS-PAGE法分离出蛋白样品(40 μg)并转到PVDF膜上,5%脱脂牛奶封闭1.5 h,将膜与一抗在4 ℃下孵育过夜,加入anti-GAP43(1∶1 000)、anti-Ace-tubulin(1∶1 000)、anti-Tyr-tubulin(1∶500)、anti-GAPDH(1∶10 000),在室温下与相应二抗孵育1 h。条带可视化由ChemiDoc XRS+成像系统完成,并通过Image Lab3.0软件分析定量。
2.5 脊髓损伤大鼠模型建立及荭草苷给药 将36只成年雌性SD大鼠随机分为假手术组、脊髓损伤组、脊髓损伤+荭草苷给药组,适应饲养1周后进行造模。腹腔注射8%水合氯醛(3.5 mL/kg)麻醉后备皮消毒,沿脊中线切开,通过椎板切除术暴露脊髓于T9椎体水平,暴露的脊髓用动脉夹(30 g)夹闭脊髓1 min;假手术组仅暴露脊髓而不夹闭。术后护理包括每天2次辅助排尿至膀胱功能恢复,并使用头孢唑林钠(50 μg/kg,腹腔注射)预防感染,同时在每天固定时段通过腹腔注射对脊髓损伤+荭草苷给药组大鼠给予荭草苷(25 mg/kg),持续28 d。所有外科手术和术后动物护理均经温州医科大学伦理委员会批准,操作均符合《实验动物饲养管理和使用指南》。
2.6 免疫荧光染色 4%多聚甲醛分别固定空白对照组、OGD组、OGD+荭草苷组神经元细胞20 min后,PBS清洗3次,每次5 min。从饲养28 d的脊髓损伤组以及脊髓损伤+荭草苷给药组的大鼠中分离得到脊髓组织(损伤中心两侧各保留1 cm),在4%多聚甲醛中固定24 h,乙醇脱水后石蜡包埋切片(厚度5 μm),在37 ℃下用5% BSA封闭液封闭细胞及切片30 min,在4 ℃下与一抗孵育过夜,加入anti-Tuj-1(1∶1 000)、anti-Ace-tubulin(1∶1 000)、anti-Tyr-tubulin(1∶500)、anti-GFAP(1∶500),孵育后以PBST漂洗3次, 在37 ℃下与相应二抗孵育60 min,继续用PBST洗涤,与DAPI温育后封片。所有图像均用共聚焦荧光显微镜进行捕获,通过Image J图像分析软件对神经元轴突长度进行定量分析,测量每个神经元最长的神经突,每个图像平均选择10个代表性神经元,每个条件选择4个代表性图像。
2.7 行为学评价 为了评价脊髓损伤后的恢复特征,由2名对实验条件不知情、训练有素的研究人员进行行为学评价。Basso-Beattie-Bresnahan(BBB)量表评分和斜板实验评分选择在造模后的第0、1、7、14、28天进行,其中前者是将大鼠置于空旷场地,2名观察者根据其肢体和关节运动、肢体协调性、稳定性、尾巴位置、腹部位置的组合给出0~21分的评分;后者是将大鼠放在1块覆盖有橡胶垫的光滑木板上,斜板可绕其底部旋转,体轴平行于板的垂直轴,之后逐渐增大斜板与水平面间夹角,当大鼠恰好在斜板上停留5 s时记录角度。每只大鼠重复5次。

3 结果
3.1 荭草苷对原代神经元的细胞毒性作用 荭草苷分子结构见图1A,本实验在原代神经元中加入不同浓度(0、2.5、5、10、25、50 μmol/L)该成分并孵育48 h,结果见图1B。由此可知,各组吸光度均无显著差异(P>0.05),提示荭草苷在0~50 μmol/L浓度范围内对原代神经元无细胞毒性作用。
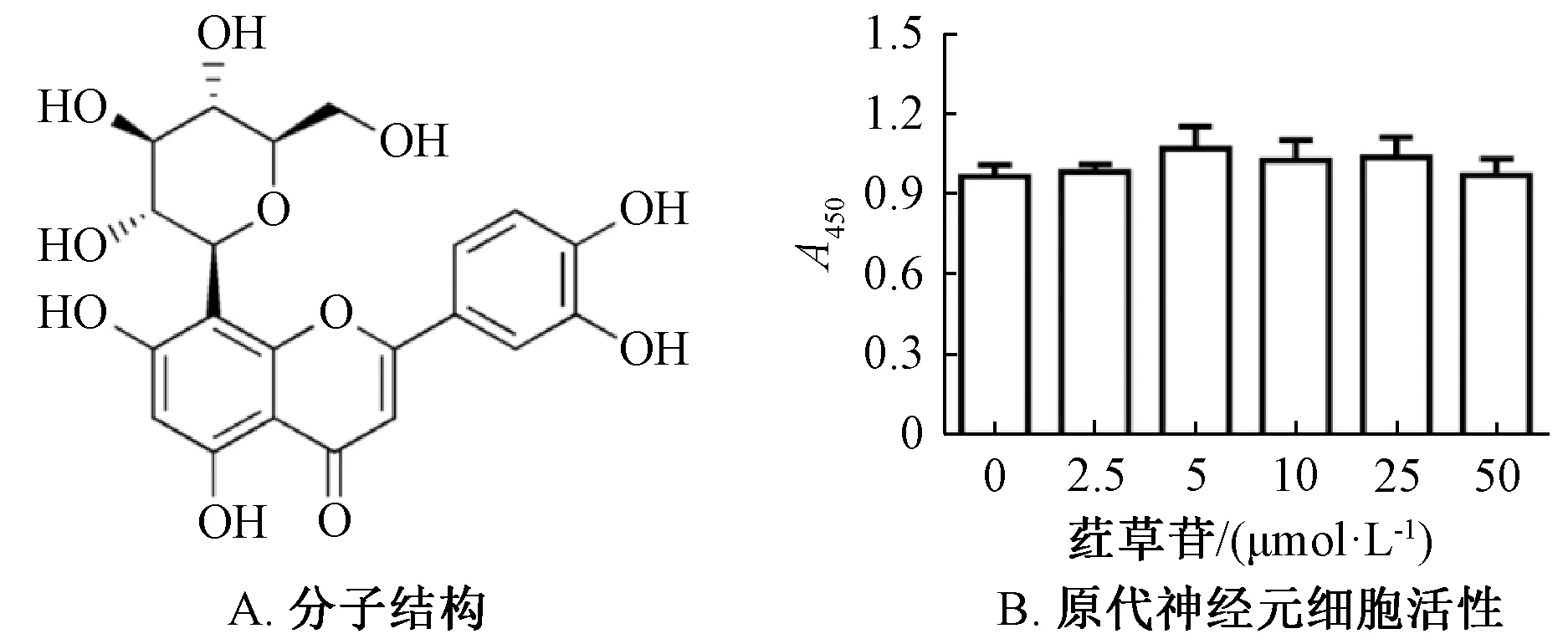
图1 荭草苷对原代神经元的细胞毒性
3.2 荭草苷促进神经元轴突再生 本实验将不同浓度(0、2.5、5、10、25、50 μmol/L)荭草苷与OGD处理神经元细胞进行培养,并以神经元轴突再生过程的关键蛋白——重肽神经丝蛋白(NEFH)、生长相关蛋白-43(GAP43)作为检测指标,结果见图2。由此可知,在3 d时荭草苷以剂量依赖性的方式使Nefh、Gap43 mRNA表达增加(P<0.05,P<0.01),在25、50 μmol/L剂量下相较于对照组(0 μmol/L)差异明显(P<0.01),由于在50 μmol/L剂量下Nefh、Gap43 mRNA表达增加最高,故选择其进行后续体外实验(图2A~2B);与OGD组比较,OGD+荭草苷组神经元细胞GAP43蛋白表达增加(P<0.05)(图2C~2D);Tuj-1免疫荧光染色显示,OGD+荭草苷组神经元轴突长度为(103.2±13.45) μm,而OGD组仅为(49.00±10.03) μm(图2E~2F),提示荭草苷能以剂量依赖性的方式促进神经元轴突再生。
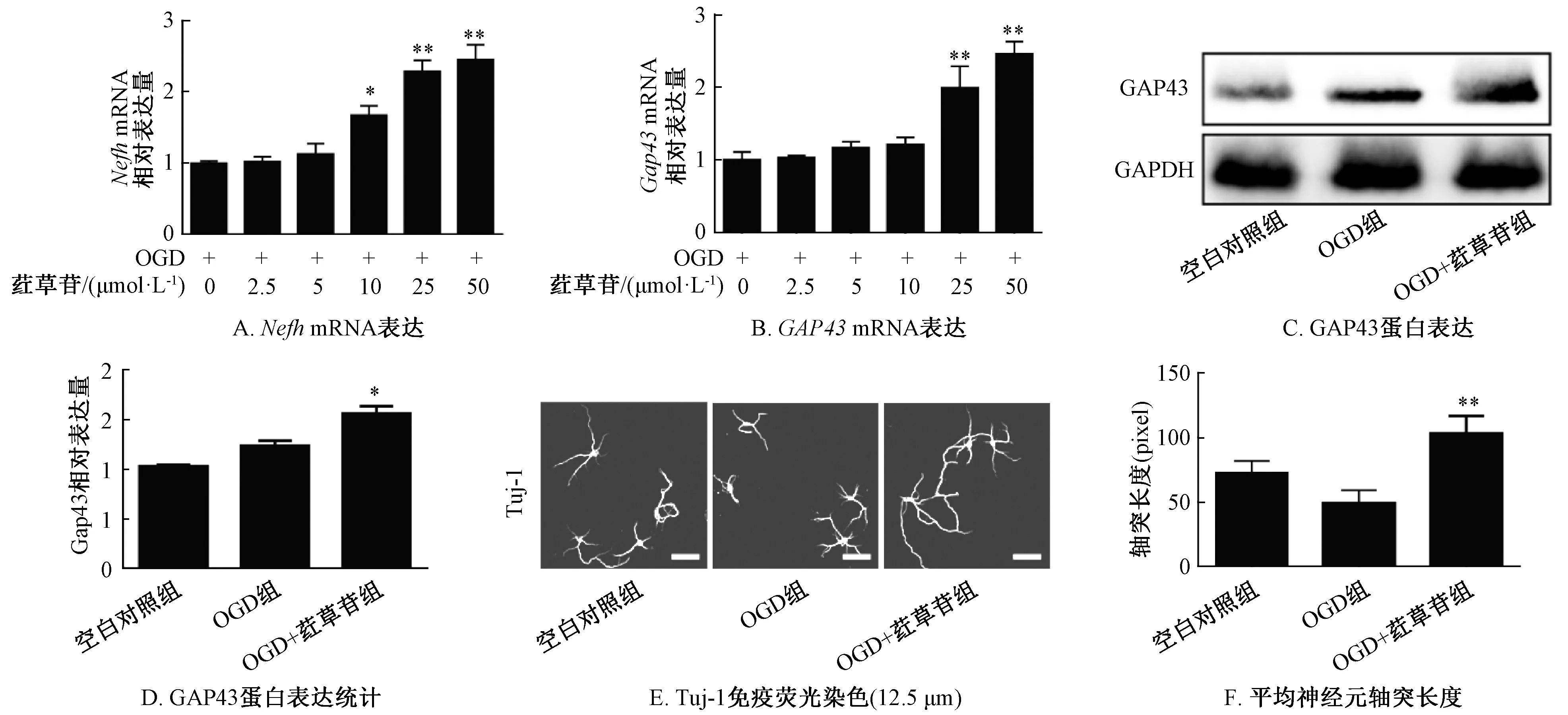
注:与OGD组比较,*P<0.05,**P<0.01。
3.3 荭草苷调节原代神经元细胞微管稳定 本实验以乙酰化微管蛋白(Ace-tubulin)、酪氨酸化微管蛋白(Tyr-tubulin)为指标,通过Western blot检测其表达,结果见图3。由此可知,相较于OGD组,OGD+荭草苷组上调了乙酰化微管蛋白表达(P<0.05),降低了酪氨酸化微管蛋白表达(P<0.05)(图3A~3C);免疫荧光染色(图3D~3F)显示,荭草苷增强了乙酰化微管蛋白荧光强度,降低了酪氨酸化微管蛋白荧光强度,使A/T比增加(P<0.01),表明荭草苷可调节原代神经元细胞微管稳定性。

注:与OGD组比较,*P<0.05,**P<0.01。
3.4 荭草苷调节微管稳定,促进轴突再生 本实验对脊髓组织切片进行免疫荧光染色,以GFAP标记星形胶质细胞,Ace-tubulin标记轴突,结果见图4。由此可知,脊髓损伤后GFAP阳性星形胶质细胞在病灶边缘积聚,而荭草苷增加了Ace-tubulin(+)面积,促进了轴突生长穿过病灶边界并延伸至远端区域,与体外实验结果一致。

注:与脊髓损伤组比较,**P<0.01。
3.5 荭草苷促进脊髓损伤大鼠功能恢复 本实验建立脊髓损伤大鼠模型后连续给药28 d,分别于造模后0、3、7、14、28 d进行BBB量表评分及斜板实验评分,结果见图5。由此可知,造模后第0天除假手术组外,其他2组大鼠BBB量表评分为0,表示造模成功;第14天脊髓损伤+荭草苷给药组的BBB量表评分为8.000分,脊髓损伤组评分为5.333分;第28天时2组评分分别为10.17、7.000分;第14、28天时脊髓损伤+荭草苷给药组斜板实验评分分别为34.17°、43.33°,高于脊髓损伤组的25.00°、30.83°(P<0.05,P<0.01),提示荭草苷可促进脊髓损伤后功能恢复。
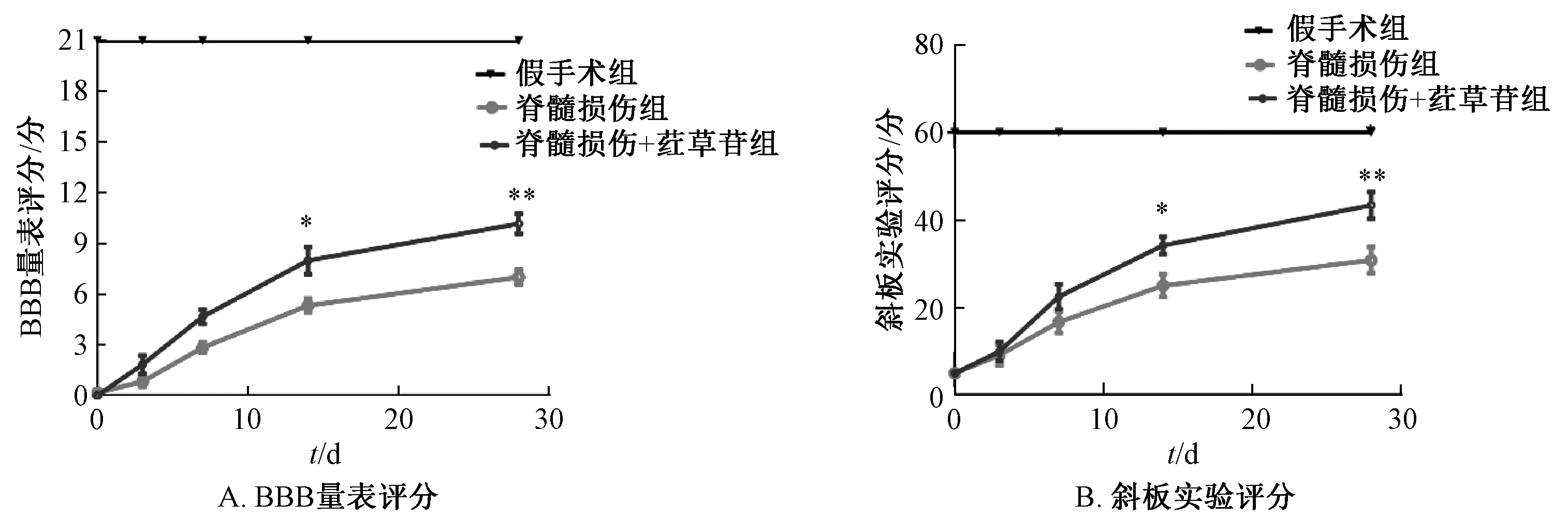
注:与脊髓损伤组比较,*P<0.05,**P<0.01。
4 讨论
中枢神经系统损伤后的神经再生是脊椎动物自我修复能力的最大限制之一,也是当代生物医学研究中最令人困扰且无法治疗的挑战之一。目前临床上尚无副作用小、疗效好的治疗药物,而脊髓损伤所带来的社会负担不容忽视,因此,能够有效促进损伤脊髓结构以及功能恢复的药物是迫切需要的。
荭草苷作为一种提取自天然中草药的黄酮类单体化合物,具有副反应小、价格低等优点。有文献报道荭草苷在脑缺血/再灌注损伤中具有神经保护作用[9]。同时,荭草苷能抑制过氧化氢(H2O2)诱导的神经元细胞的凋亡[13]。Guo等[14]亦报道过,荭草苷作为一种神经保护剂,在脊神经结扎模型中可用于神经性疼痛的治疗。研究证明,多种黄酮类化合物能够调节轴突再生:如English等[15]发现7,8-二羟基黄酮作为原肌球蛋白受体激酶B的小分子激动剂,能促进周围神经损伤后的轴突再生;Wang等[16]证明了槲皮素可以促进急性脊髓损伤后的轴突再生。基于上述,本实验猜测荭草苷可能作用于脊髓损伤。
尽管改善脊髓损伤恢复涉及各种各样的因素,但促进轴突再生被认为最有潜力,也是最有可能逆转瘫痪的因素[17]。有研究表明通过调节神经元内在信号、调节神经元外部微环境、生物支架植入等方法促进轴突生长以改善脊髓损伤后功能的恢复[18]。本研究发现荭草苷可以显著增加Nefh、GAP43等轴突再生过程中关键蛋白的mRNA和(或)蛋白表达,同时通过Tuj-1免疫荧光染色直观地反映了荭草苷处理可以增加氧糖剥夺神经元的轴突长度,提示其能够促进轴突再生。
微管是细胞骨架的关键组分,在正常神经元中,其结构稳定,平行排列并聚集成束,并延伸至轴突末端参与组成生长锥,进而参与轴突生长[5]。多项体内实验表明,成年哺乳动物中枢神经系统神经元在损伤后无法重建功能性生长锥[19-21];然而外周神经系统神经元可以再生出功能性的活动末梢[22]。两者的主要差异在于损伤部位的细胞骨架的微管结构:小鼠坐骨神经损伤后,生长锥的大小仍恒定,微管保持了典型的束状结构;而脊髓损伤后,微管的稳定性被打破,其排列变得杂乱无章且在细胞内分布不均,生长锥转化为肿胀的、无生长能力的回缩泡结构[23]。微管稳定除了上文所述的具有调节轴突尖端由回缩泡结构向生长锥转变的作用外,其对于调节损伤轴突再生的启动至少还包括以下两方面:一是神经元的极化受微管稳定性状态的调控[24];二是微管稳定在轴突再生所需细胞器(例如线粒体)、蛋白质(例如肌动蛋白)等的定向运输过程中起重要作用[25]。Ertürk等[22]报道使用微管解聚药物诺考达唑处理背根神经节神经元后,可将微管分散,轴突尖端转变为类似于中枢神经系统损伤后的回缩泡结构。相反,通过埃坡霉素B、紫杉醇等药理性微管稳定作用,可增强轴突尖端处的微管聚合,以促进神经元的极化与再生[7, 26]。因此,恢复微管的稳定性是促进脊髓损伤后轴突再生与功能恢复的重要途径。在原代神经元细胞中,本研究通过Western blot及免疫荧光等实验,发现荭草苷可以上调乙酰化微管蛋白的表达,同时降低酪氨酸化微管蛋白的表达,增加A/T比值,提高微管的稳定性,从而促进轴突再生。脊髓组织切片的免疫荧光实验亦支持了上述结果。同时,与埃坡霉素B、紫杉醇等抗肿瘤药物比较,荭草苷作为天然中草药提取物,其副反应小且价格较低,具有独特的优势。
最后利用急性脊髓损伤伤动物模型,本实验进一步评估了荭草苷在实验动物体内能否发挥作用,发现与对照组比较,进行荭草苷给药的大鼠BBB评分及斜板评分均增加,表明荭草苷可改善脊髓损伤大鼠运动功能。
总而言之,本研究表明荭草苷通过稳定微管以促进轴突再生,最终改善脊髓损伤后大鼠运动功能,这为治疗脊髓损伤提供了新的策略,也为天然中草药在脊髓损伤治疗中的应用提供了一定参考。但荭草苷如何增加微管稳定性或是否存在其他机制促进轴突再生,仍需进一步研究。
