超声引导下微波消融治疗原发性甲状旁腺功能亢进症的效果
2021-10-26彭丽丽赵朕龙曹晓静于明安
魏 莹,彭丽丽,赵朕龙,曹晓静,伍 洁,李 妍,于明安
(中日友好医院介入医学科,北京 100029)
原发性甲状旁腺功能亢进症(primary hyperparathyroidism, PHPT)为常见内分泌系统疾病,患者可出现骨痛、骨质疏松、骨折、尿路结石、神经系统病变甚至高钙危象等[1-2]。既往多采用手术治疗PHPT,效果较好,但老年人、合并症较多、心肺功能较差者等不能耐受或不适宜接受手术[3-4]。已有研究[5-6]表明,超声引导下热消融治疗继发性甲状旁腺功能亢进症(secondary hyperparathyroidism, SHPT)安全有效,用于治疗PHPT亦已见于报道[7],且短期效果较好,但已有研究纳入病例数较少,随访时间较短。本研究分析超声引导下微波消融(microwave ablation, MWA)治疗PHPT的有效性及安全性。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月—2020年6月96例于中日友好医院接受超声引导下MWA治疗的PHPT患者,男32例,女64例,年龄18~85岁,平均(56.6±16.6)岁。纳入标准:①有症状的PHPT;②满足以下条件之一的无症状的PHPT患者,a.高钙血症,b.骨密度评分T-score<-2.5分和/或出现骨折,c.肾脏受累,d.年龄<50岁;③超声显示至少1枚增大甲状旁腺病灶;④99Tcm-甲氧基异丁基异腈(methoxyisobutylisonitrile, MIBI)核素双时相显像证实存在甲状旁腺功能亢进;⑤不适宜手术或患者拒绝手术。排除标准:①严重凝血功能异常;②伴多发性家族性内分泌肿瘤;③药物不能控制的心、肺功能不全或恶性高血压等[2]。术前患者均签署知情同意书。
1.2 仪器与方法 采用GE LOGIQ E9超声诊断仪为引导设备,线阵探头,频率6~15 MHz;南京亿高智能微波仪,17G水冷电极或康友医疗KY2000微波消融仪,T3型甲状腺专用水冷微波天线。
术前完善常规超声、超声造影(contrast enhanced ultrasound, CEUS)及99TcmMIBI检查;根据常规超声及99TcmMIBI确定PHPT病灶大小、数目及位置,利用CEUS评估病灶增强特征(造影剂为声诺维)[8]。
嘱患者仰卧,于颈部常规消毒、铺巾,以2%利多卡因局部麻醉穿刺部位。于超声引导下以18G PTC针于病灶周围区域注射生理盐水约40~60 ml,分离甲状旁腺与周围结构后,于甲状旁腺被膜外注射隔离液(利多卡因与生理盐水混合液,比例1∶3)。将消融针经皮插入病灶内,以功率30 W行多点消融,每点消融15~20 s,消融过程中经PTC针持续注入生理盐水维持液体隔离带。之后以CEUS评估病灶是否完全消融:整个病灶无增强区覆盖时判断为完全消融;如病灶内仍有增强,则立即追加消融至完全消融。术后局部按压30 min,超声观察有无局部出血等并发症。
1.3 相关指标观察及随访 术前及术后2 h、1天、7天、1个月、3个月、6个月,之后每6个月随访1次,检测血清全段甲状旁腺激素(intact parathyroid hormone, iPTH)、钙及磷,以常规超声观察消融灶,必要时行CEUS及MIBI检查。记录并发症发生情况。
术后6个月评价治疗效果。判定标准[2,4]:治愈,血清iPTH、钙恢复并维持正常水平;持续性PHPT,血清iPTH、钙始终未恢复正常;复发性PHPT,术后6个月血清iPTH和/或钙再次升高。血清iPTH正常范围为12~88 pg/ml,血钙为2.00~2.75 mmol/L,血磷为0.81~1.78 mmol/L。
于术后6、12个月评估病灶体积,以球体公式计算,体积=π/6(长×宽×高),计算病灶体积缩小率(volume reduction rate, VRR),VRR=(术前病灶体积-术后病灶体积)/术前病灶体积×100%。
1.4 统计学分析 采用SPSS 20.0统计分析软件。以±s表示符合正态分布的计量资料,采用配对t检验进行比较;以中位数(上下四分位数)表示非正态分布者,行非参数秩和检验。P<0.05为差异有统计学意义。
2 结果
96例共109个PHPT病灶,其中85例存在1个病灶、9例2个病灶、2例3个病灶;病灶最大径0.40~4.70 cm,平均(1.50±0.90)cm。109个病灶均完全消融(图1),92个一次消融、4个分次消融;单个病灶消融时间66~375 s,中位消融时间137 s。术后随访时间7~43个月,中位随访时间18.5个月。
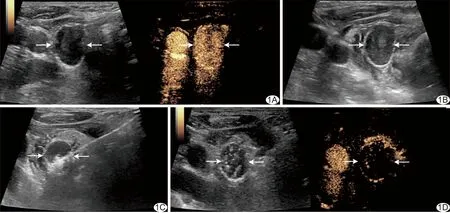
图1 患者男,51岁,PHPT,接受超声引导下MWA A.二维超声声像图示甲状腺左叶下极低回声病灶,CEUS动脉期呈高增强; B.于病灶周围建立液体隔离带; C.对病灶行MWA; D.消融后病灶CEUS动脉期无明显增强 (箭示病灶)
2.1 治疗效果 术后2 h血清iPTH测值骤降,1个月后逐渐趋于平稳;术后2 h、1天、7天血钙逐渐降低、血磷逐渐升高,7天后趋于平稳;见图2。术后6个月血清iPTH、钙较术前降低,磷较术前升高(P均<0.01),见表1。

图2 MWA治疗PHPT后患者血清iPTH、钙及磷随时间变化折线图
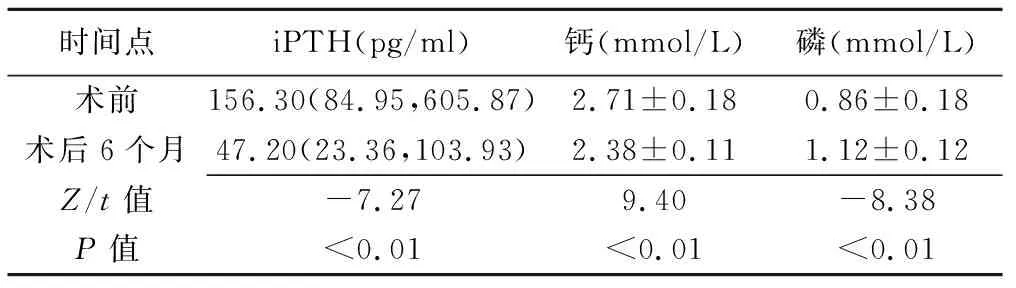
表1 MWA治疗PHPT术前与术后6个月患者血清iPTH、钙及磷水平比较
术后6个月85例血清iPTH及钙均在正常值范围内,治愈率为88.54%(85/96);9例(9/96,9.38%)持续性PHPT,其中2例术后CEUS及MIBI证实残余病灶,经补充消融后治愈,5例因病灶较小或与淋巴结混淆未能精确消融目标病灶;2例(2/96,2.08%)复发性PHPT及其余2例持续性PHPT影像学检查未发现甲状旁腺异常病变。
病灶体积自术后3个月始逐渐缩小,术后6个月病灶体积缩小率为74.20%,术后24个月病灶体积缩小率>90%并稳定维持甚至完全消失,见图3。
2.2 不良反应 1例术中出现局部血肿,予按压局部后停止出血。术后5例出现声音嘶哑,给予甲钴胺营养神经,6个月内均恢复;24例一过性甲状旁腺功能减退,13例手部麻木,3例一过性低钙血症, 1例头痛,后均未经特殊处理而好转。
3 讨论
超声引导下热消融已在治疗多种实体脏器肿瘤(肝脏、肾脏、乳腺、甲状腺等)中取得令人满意的效果[9-11],可有效灭活PHPT病灶,使血清iPTH、钙、磷恢复正常水平[7],疗效可与手术媲美[12]。治疗PHPT的热消融方法主要包括射频消融、MWA、激光及高强度聚焦超声等[13-15],但现有研究样本量均较小,治愈率差异较大,且缺乏中、长期随访资料。
本研究回顾性分析96例接受MWA治疗的PHPT患者,随访时间7~43个月,平均18.5个月;109个PHPT病灶均获完全消融,术后6个月85例血
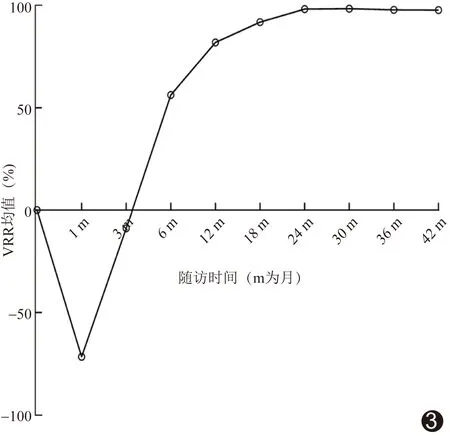
图3 MWA治疗PHPT消融灶VRR随时间变化折线图
清iPTH及钙已在正常值范围内,治愈率为88.54%,消融后6个月病灶体积缩小率为74.20%,12个月时为96.65%(即大部分消融灶基本吸收),表明实时超声引导下MWA可有效灭活PHPT病灶。相比既往文献[12,16]报道的89%~95%手术切除治愈率,本组MWA的治愈率略低,主要原因可能在于部分病灶过小或病灶与淋巴结相混淆而未能精确、完全消融[17]。本研究中未获治愈的4例患者随访期间影像学并未发现异常PHPT病灶,原因可能为超声和/或核素检查未显示某些腺体轻度增生;而部分患者术前维生素D缺乏、消融后未能有效补充维生素D可能为原因之一。
并发症方面,本组1例术中出现皮下血肿,5例术后出现声音嘶哑,部分患者出现一过性甲状旁腺功能减退、手部麻木、一过性低钙血症、头痛,提示MWA治疗PHPT安全性较好。
高频超声能清晰显示甲状旁腺,对正常甲状旁腺及甲状旁腺增生、腺瘤、结节、颈部淋巴结具有良好的显示及鉴别能力[18];应用CEUS可进一步提高定位及诊断准确性,并有助于及时评估消融区是否覆盖目标病灶。相比全麻下外科手术,超声引导下热消融仅需局部麻醉即可完成,手术时间短,创伤小;应用液体隔离技术可分离PHPT病灶与周围重要结构如血管、神经、气管及食管,既能增加安全性,又可保证足够的消融范围,减少术后炎性反应所致粘连。应用低功率、短间隔、多点消融策略,一方面可减少热量传导、保证安全性;另一方面,多个消融热场的重叠作用能使PHPT病灶被完全消融,有助于保证疗效。
本研究的主要不足:①为回顾性研究,不可避免地存在一定选择偏倚;②未能与手术治疗病例进行对比分析;③术前未对PHPT病灶进行活检,缺乏组织病理学支持。
综上,超声引导下MWA治疗PHPT安全、有效,疗效确切且持久。