血清IL-6联合淋巴细胞/单核细胞比值对严重烧伤患儿脓毒血症诊断及预后评估的价值*
2021-10-25李鹏程谢江帆靳三丁
李鹏程,谢江帆,靳三丁
(1.郑州大学附属儿童医院 烧伤与整形外科,河南 郑州450018;2.郑州市第一人民医院 烧伤科,河南 郑州450004)
烧伤是导致儿童意外伤害的主要致伤因素之一,全球范围内5 岁及以下儿童烧伤最为常见,尤其是1~3 岁,所占比例高达70%[1]。研究表明,火焰伤、热液烧伤和接触性烧伤是引起严重烧伤的三大原因,其中热液烧伤是引起儿童严重烧伤的最常见原因,占所有住院烧伤患儿60%~75%,其次是火焰烧伤和接触性烧伤[2-4]。烧伤不仅损伤局部皮肤屏障,而且可以产生大量细胞因子,引起全身炎症反应、贫血、白细胞减少、血小板减少及凝血障碍等。皮肤屏障及机体免疫系统的损伤使机体易发生感染和脓毒血症[5],是目前严重烧伤患儿的主要并发症之一,进一步发展可导致多器官功能障碍综合征,甚至死亡,是烧伤后引起死亡的首要原因,病死率高达50%~60%。因此寻找有效、可靠的生物标志物,对严重烧伤后脓毒血症的早期识别、诊疗及提高临床救治率至关重要[6]。淋巴细胞/单核细胞比值(lymphocyte/ monocyte ratio,LMR)是血细胞中两种独立的炎症标志物的组合,目前LMR 被认为是一种新的全身炎症标志物,与多数感染性疾病及恶性肿瘤的预后密切相关[7]。此外,烧伤后引起的机体炎症反应也会激活免疫细胞分泌细胞因子,如白细胞介素-6(Interleukin-6,IL-6)等[8]。研究证明,IL-6 的高表达与感染性疾病的严重程度和细胞因子风暴的产生有关,可作为预测疾病转归的重要指标[9]。因此,本研究旨在通过回顾性分析严重烧伤患儿血液中LMR 及血清IL-6 水平,探讨其对严重烧伤患儿脓毒血症的预测及预后意义,以期为临床救治提供参考。
1 资料与方法
1.1 研究对象
回顾性分析2015年12月—2020年6月郑州大学附属儿童医院和郑州市第一人民医院收治的78 例严重烧伤患儿的临床资料。脓毒血症患儿共33 例。其中,男性22 例,女性11 例;年龄1~16 岁,平均(6.0±4.1)岁;非脓毒血症患儿共45 例。其中,男性23 例,女性22 例;年龄1~13 岁,平均(5.7±4.2)岁。
1.2 纳入和排除标准
纳入标准:①年龄0~16 岁首诊烧伤患儿;②入院诊断符合重度及以上烧伤标准,即烧伤总面积TBSA>15%或Ⅲ度烧伤面积>5%;③患儿临床记录及病例资料完整;④既往无精神性疾病及其他重大疾病;⑤脓毒血症的诊断符合中国医师协会烧伤医师分会《烧伤感染诊治指南》编辑委员会的《烧伤感染的诊断标准与治疗指南(2012 版)》[10];⑥入组对象监护人对本研究均知情同意,签署知情同意书。排除标准:①烧伤合并外伤或严重脏器功能障碍甚至衰竭者;②合并其他先天性疾病、免疫系统疾病或有严重基础疾病者;③烧伤患儿中途转院或放弃治疗者。
1.3 分组及研究方法
根据脓毒血症诊断标准,将患儿分为脓毒血症组和非脓毒血症组;根据患儿病情结局分为生存组和死亡组;根据临界值的高低又将患儿分为低IL-6组和高IL-6 组,以及低LMR 组和高LMR 组。收集患儿的年龄、性别、TBSA、住院时间、是否伴有吸入性损伤、是否行机械通气及病情转归等临床资料;检测患儿入院时、伤后7 d、伤后14 d、伤后21 d 的血常规、血清IL-6 等。采用全自动血细胞分析仪检测血常规,采用酶联免疫吸附试验检测血清IL-6 水平;所有患者从烧伤开始进行60 d 观察。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析;计数资料以构成比或率(%)表示,比较用χ2检验;相关性分析用Pearson 法;绘制受试者工作特征(ROC)曲线;Kaplan-Meier 法绘制生存曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 非脓毒血症组与脓毒血症组患儿基本资料比较
非脓毒血症组与脓毒血症组患儿在是否伴有吸入性损伤、是否行机械通气、是否死亡、TBSA方面比较,差异有统计学意义(P<0.05)。见表1。
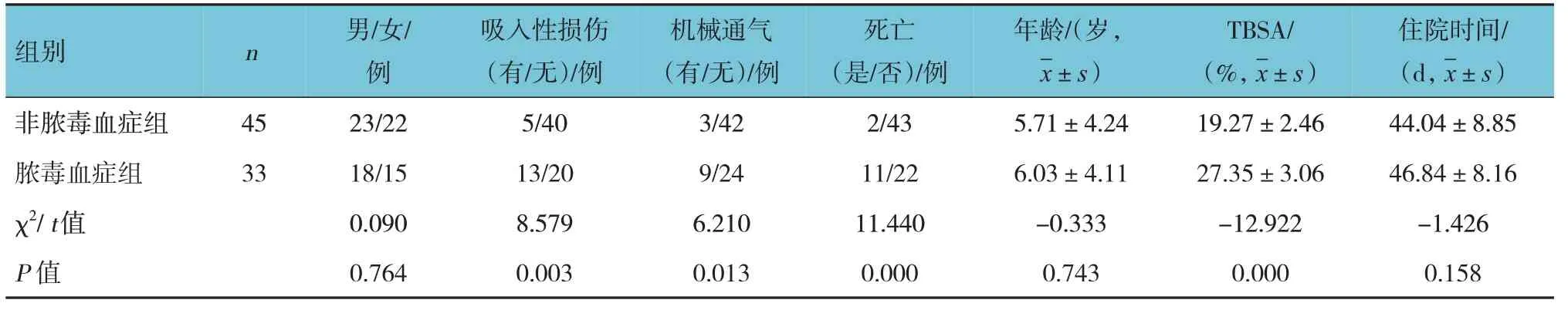
表1 非脓毒血症组与脓毒血症组基本资料比较
2.2 非脓毒血症组与脓毒血症组患者LMR、IL-6水平比较
非脓毒血症组与脓毒血症组入院时、伤后7 d、伤后14 d、伤后21 d 的LMR 比较,采用重复测量设计的方差分析,结果:①不同时间点LMR 有差异(F=102.034,P=0.000);②非脓毒血症组和脓毒血症组的LMR 有差异(F=63.367,P=0.000),脓毒血症组伤后7 d、14 d、21 d 的LMR 较非脓毒血症组降低;③非脓毒血症组与脓毒血症组的LMR 变化趋势有差异(F=16.781,P=0.000)(见表2 和图1)。非脓毒血症组与脓毒血症组入院时、伤后7 d、伤后14 d、伤后21 d 的IL-6 水平比较,采用重复测量设计的方差分析,结果:①不同时间点血清IL-6水平有差异(F=439.209,P =0.002);②非脓毒血症组与脓毒血症组的IL-6 水平有差异(F=34.337,P =0.011),脓毒血症组伤后7 d、14 d 的IL-6 水平较非脓毒血症组升高;③非脓毒血症组与脓毒血症组的IL-6 变化趋势有差异(F=9.228,P =0.003)(见表3和图2)。Pearson 相关分析结果显示,伤后7 d、14 d、21 d LMR 与TBSA 呈负相关(r=-0.441、-0.580 和-0.441,均P=0.000);伤后7 d、14 d、21 d IL-6 水平与TBSA 呈正相关(r=0.417、0.549 和0.293,均P=0.000)。

图1 非脓毒血症组与脓毒血症组LMR变化趋势图
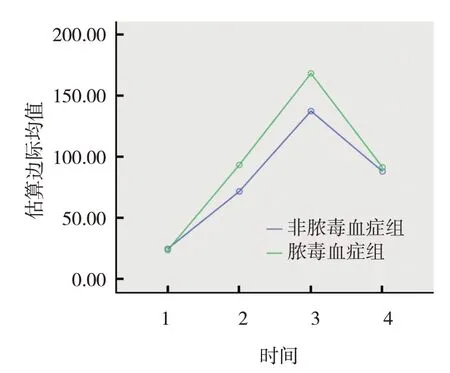
图2 非脓毒血症组与脓毒血症组IL-6变化趋势图
表2 非脓毒血症组与脓毒血症组患者不同时间点LMR水平比较 (±s)
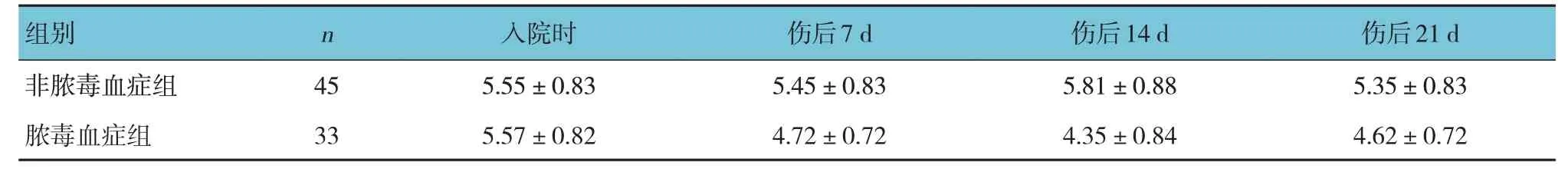
表2 非脓毒血症组与脓毒血症组患者不同时间点LMR水平比较 (±s)
组别非脓毒血症组脓毒血症组n 45 33入院时5.55±0.83 5.57±0.82伤后7 d 5.45±0.83 4.72±0.72伤后14 d 5.81±0.88 4.35±0.84伤后21 d 5.35±0.83 4.62±0.72
表3 非脓毒血症组与脓毒血症组患者不同时间点血清IL-6水平比较 (pg/ml,±s)

表3 非脓毒血症组与脓毒血症组患者不同时间点血清IL-6水平比较 (pg/ml,±s)
组别非脓毒血症组脓毒血症组n 45 33入院时24.62±6.57 23.49±5.01伤后7 d 71.55±20.30 93.31±27.52伤后14 d 137.33±32.56 168.13±44.03伤后21 d 87.87±21.18 91.21±29.20
2.3 LMR联合IL-6对严重烧伤患儿脓毒血症发生的预测价值
ROC 曲线分析结果显示,伤后7 d 单独检测IL-6 的ROC 曲线下面积(AUC)为0.717(95% CI:0.597,0.837),敏感性为57.6%(95% CI:0.333,0.788),特异性为62.2%(95% CI:0.511,0.867),临界值 为89.44 pg/ml(95% CI:85.33,93.50);IL-6 联 合LMR 检测的AUC 为0.767(95% CI:0.660,0.874),敏感 性 为93.9%(95% CI:0.818,0.970),特异性为59.3%(95% CI:0.510,0.800),临界值为0.24(95%CI:0.131,0.353),IL-6 联合LMR 比单独IL-6 预测更有效(P<0.05)。见图3。

图3 伤后7 d血清IL-6和LMR诊断严重烧伤后脓毒血症的ROC曲线
伤后14 d 单独IL-6 检测的AUC 为0.713(95% CI:0.587,0.840),敏感性为63.6%(95% CI:0.364,0.818),特异性为70.2%(95% CI:0.522,0.911), 临界值为79.96 pg/ml(95% CI:68.551,88.373);IL-6 联合LMR检测的AUC 为0.875(95%CI:0.798,0.952),敏感性为93.9%(95% CI:0.697,0.970),特异性为69%(95% CI:0.578,0.911),临界值为0.34(95% CI:0.221,0.563),IL-6 联合LMR 比单独IL-6 预测更有效(P<0.05)。见图4。
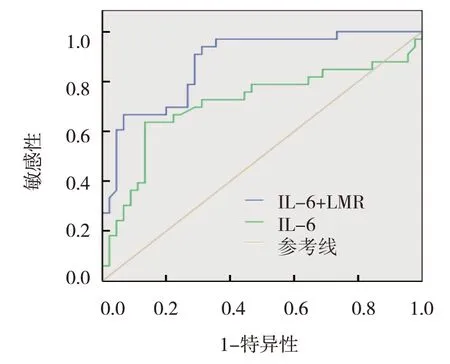
图4 伤后14 d血清IL-6和LMR诊断严重烧伤后脓毒血症的ROC曲线
2.4 严重烧伤患儿生存组与死亡组基本资料比较
生存组与死亡组在是否行机械通气、有无脓毒血症、TBSA 比较,差异有统计学意义(P<0.05)。见表4。

表4 生存组与死亡组基本资料的比较
2.5 严重烧伤患儿生存组与死亡组LMR、IL-6水平比较
严重烧伤患儿生存组与死亡组入院时、伤后7 d、伤后14 d、伤后21 d 的LMR 比较,采用重复测量设计的方差分析,结果:①不同时间点的LMR 有差异(F=64.520,P=0.005);②生存组与死亡组的LMR 有差异(F=9.797,P=0.000),死亡组在入院时、伤后7 d、伤后14 d、伤后21 d LMR 较生存组降低;③生存组与死亡组的LMR 变化趋势有差异(F=31.068,P=0.013)。见表5 和图5。

图5 生存组与死亡组LMR变化趋势图
表5 严重烧伤患儿生存组与死亡组不同时间点LMR比较 (±s)
表5 严重烧伤患儿生存组与死亡组不同时间点LMR比较 (±s)
组别生存组死亡组n 65 13入院时5.65±0.83 5.07±0.62伤后7 d 5.35±0.74 4.10±0.63伤后14 d 5.48±0.94 3.72±0.68伤后21 d 5.25±0.74 4.00±0.63
严重烧伤患儿生存组与死亡组入院时、伤后7 d、伤后14 d、伤后21 d IL-6 水平比较,采用重复测量设计的方差分析,结果:①不同时间点的IL-6 水平有差异(F=407.063,P=0.000);②生存组与死亡组的IL-6 水平有差异(F=32.975,P=0.001),死亡组在入院时、伤后7 d、伤后14 d、伤后21 d IL-6水平较生存组升高;③生存组与死亡组的IL-6 水平变化趋势有差异(F=35.960,P=0.000)。见表6和图6。
表6 严重烧伤患儿生存组与死亡组不同时间点血清IL-6水平比较 (pg/ml,±s)

表6 严重烧伤患儿生存组与死亡组不同时间点血清IL-6水平比较 (pg/ml,±s)
组别生存组死亡组n 65 13入院时23.36±5.73 28.05±5.65伤后7 d 74.65±21.67 111.28±23.81伤后14 d 140.06±34.98 201.88±24.19伤后21 d 85.63±24.61 107.56±16.51
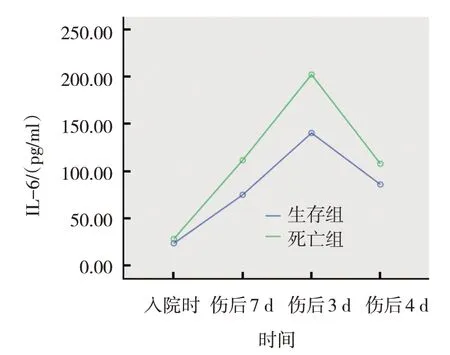
图6 生存组与死亡组IL-6变化趋势图
2.6 LMR及IL-6对严重烧伤患儿生存率的影响
通过ROC 曲线确定伤后7 d、伤后14 d LMR 的最佳临界值分别为4.41 和4.32;IL-6 最佳临界值分别为89.4 pg/ml 和165.6 pg/ml。Kaplan-Meier 生存分析曲线提示:伤后7 d 低LMR 组和高LMR 组严重烧伤患儿住院期间生存率分别为54.0%和94.8%,两组比较,差异有统计学意义(χ2=14.320,P=0.000);伤后14 d 低LMR 组和高LMR 组生存率分别为25.0%和98.4%,两组比较,差异有统计学意义(χ2=12.692,P=0.000)。伤后7 d 低IL-6 组和高IL-6 组严重烧伤患儿住院期间的生存率分别为98.0% 和55.6%,两组比较,差异有统计学意义(χ2=10.312,P=0.001);伤后14 d 低IL-6 组和高IL-6 组严重烧伤患儿住院期间的生存率分别为100.0%和45.8%,两组比较,差异有统计学意义(χ2=8.485,P=0.004)。见图7。

图7 高低LMR、IL-6组严重烧伤患儿的Kaplan-Meier生存曲线
3 讨论
烧伤后皮肤屏障受损,病原微生物及有害物质通过受损的创面侵入机体,导致感染,严重者会诱发脓毒血症。脓毒血症是烧伤患儿的严重并发症之一,也是主要死亡原因之一[6]。烧伤后由于机体的过度炎症反应导致免疫功能下降,使诊断脓毒血症的传统生物学标志物准确性降低[11]。近年来研究表明,降钙素原是诊断细菌感染及判断严重程度的一个有效指标,但相对单一,且特异性差[12]。因此探索简单、实用、特异性及敏感性较高的生物学指标用于预测烧伤后脓毒血症的发生,判断病情严重程度及预后,对成功救治患者至关重要。本研究从免疫炎症角度出发,探讨LMR 及IL-6 与烧伤后脓毒血症的关系,既可以排除烧伤后机体应激反应的干扰,又可以提高烧伤后脓毒血症发生及预后预测的准确性。
LMR 是淋巴细胞绝对数与单核细胞绝对数的比值,淋巴细胞体现免疫系统的调控过程,而单核细胞体现机体的非特异性炎症反应,通过抗原呈递作用,连接固有免疫与适应性免疫。作为一种新型炎症标志物,LMR 与许多疾病的发生及预后密切相关[13-14]。低LMR 与结核病及恶性肿瘤的预后有关。LMR 可以预测子宫内膜癌患者的存活率和侵袭性[15]。本研究结果也表明,脓毒血症组淋巴细胞数量较非脓毒血症组减少,单核细胞增多,LMR 降低;此外,死亡组的LMR 比生存组低。提示LMR 的降低与脓毒血症的发生及预后有关。
本研究将严重烧伤引起脓毒血症后淋巴细胞数量减少的原因归纳为以下几点:①机体的体液免疫和细胞免疫反应均发生显著改变,出现免疫抑制状态[16]。烧伤早期CD4、CD8 细胞表面抗原(HLA-DR、IL-IR 及转铁素受体)活化及淋巴细胞增殖能力明显降低,而辅助性T 细胞持续激活,导致T 细胞对正常生理刺激的反应性持续丧失及大量凋亡,机体对病原微生物的易感性增加[17]。②感染引起机体产生大量的前列腺素E2,进而抑制p59fyn激酶活性,使激活蛋白1 和核因子活性降低,从而抑制T 淋巴细胞增殖[18]。③严重烧伤引起脓毒血症激活Caspase-3 和Caspase-9,促进T 淋巴细胞凋亡,引起B 细胞和CD4 T 细胞大量凋亡等[19]。④淋巴细胞的激活需要淋巴细胞受体与MHC-II 分子结合后,辅助协同刺激分子。而在脓毒血症中CTLA-4 升高,CD86、HLA-DR 表达下降,引起T 淋巴细胞与单核细胞之间的亲和力减弱,影响T 淋巴细胞激活[20]。本研究中引起单核细胞数量增加的因素可归纳为:①脓毒血症引起单核细胞CD64 和CD14 分子表达增加,与机体内毒素及抗体结合增强,促进单核细胞增殖[21]。②脓毒血症后,骨髓造血干细胞在多集落刺激因子及粒-巨噬细胞集落刺激因子作用下,分化为单核祖细胞,从骨髓转移至血液,分化为单核细胞[22]。这与单核细胞在冠状动脉钙化(coronary artery calcification,CAC)中的研究[13]类似,动脉粥样硬化及轻中度CAC 者血液中炎症单核细胞数量增加,迁移至动脉损伤部位,体内分泌的黏附分子促进其黏附并浸润于血管内皮中。
严重烧伤后出现以炎症细胞因子如IL-6、IL-8及TNF-α 等过度产生为特点的全身炎症反应综合征,进而导致脓毒血症[23]。IL-6 是由单核细胞、上皮细胞及淋巴细胞等在外界因素刺激下产生的一种促炎细胞因子,可促进T 细胞、B 细胞增殖,诱导免疫球蛋白及C 反应蛋白生成。动物实验及临床研究均表明,严重烧伤后机体的IL-6 水平显著升高[24]。IL-6 水平与脓毒血症患儿感染的严重程度密切相关,是脓毒血症发生的重要预测因子[25]。本研究回顾性分析严重烧伤患儿血清IL-6 水平,比较脓毒血症组与非脓毒血症组、生存组与死亡组血清IL-6 水平的差异。结果显示,血清IL-6 水平出现先升高后下降趋势,脓毒血症组IL-6 水平在伤后7 d、14 d 高于非脓毒血症组;死亡组IL-6 水平高于生存组;且IL-6 与TBSA 呈正相关,提示IL-6 在预测严重烧伤后脓毒血症的发生及预后中具有重要意义。
由于LMR 降低及IL-6 水平升高与严重烧伤后脓毒血症发生有关,进一步探讨LMR 联合IL-6 对伤后脓毒血症的诊断价值,结果显示,伤后7 d、14 d LMR 联合IL-6 的敏感性和特异性比单独IL-6 预测更有意义。既往研究已经初步显示IL-6 在其他疾病引起脓毒血症中的诊断意义,而作为两种重要的炎症指标,本研究提示IL-6 联合LMR 对严重烧伤患儿脓毒血症的预测更具有准确性和特异性。
此外,本研究通过Kaplan-Meier 生存曲线进一步证明伤后7 d、14 d,高水平IL-6 组比低水平IL-6 组生存率低,低LMR 组生存率比高LMR 组低,这提示IL-6 及LMR 对严重烧伤患儿生存率的评估具有较好的预测价值。
综上所述,本文从炎症指标LMR 及促炎细胞因子IL-6 角度出发,揭示IL-6 联合LMR 对严重烧伤患儿脓毒血症的发生及预后具有更好的预测价值,动态监测这两个指标的变化对及时评估患儿病情与预后情况,尽早实施临床干预、提高救治率具有重要的指导意义。另外本研究属于回顾性分析研究且样本例数较少,存在一定局限性,尚需前瞻性临床研究进一步明确及扩大样本量,确保研究结果的准确性。
