苦参碱对对乙酰氨基苯酚诱导的小鼠药物性肝损伤的保护作用及机制*
2021-10-25常乐乐王思源窦乐贾蒙王腾飞胥冰
常乐乐,王思源,窦乐,贾蒙,王腾飞,胥冰
(陕西中医药大学1.临床医学系,2.医学技术学院,陕西 咸阳712000)
近年来,药物性肝损伤(drug-induced liver injury,DILI)是临床上较为常见的急性肝衰竭的主要病因,其危害仅次于病毒性肝炎、脂肪肝。据WHO 近期统计,每年发生率约20/10 万人,病死率已经跃居世界第五。然而,目前DILI 的预测及诊断相对困难,缺乏效果好的治疗方法[1]。对乙酰氨基苯酚(Acetaminophen,APAP)是目前临床上常用的解热镇痛类药物,长时间大剂量服用APAP 可致DILI[2]。苦参碱(KSJ)是提取于豆科植物苦参的干燥根、植株、果实的一种生物碱,具有多种重要的药理作用,如抗炎、抗纤维化、抗肿瘤、抗病毒等[3]。目前,KSJ 已被广泛应用于多种肝脏疾病和恶性肿瘤的治疗中[4],其对APAP 所致肝损伤的保肝效果尚未见报道,因此本实验以APAP 诱导的小鼠急性药物性肝损伤为模型,研究KSJ 对急性DILI的保护作用及机制,为临床预防和治疗DILI 提供一定的参考价值。
1 材料与方法
1.1 实验动物
40 只健康成年C57BL/6 小鼠,雄性,体重(20±2)g,购自西安交通大学医学部实验动物中心,动物许可证编号:SCXK(陕)2017-003。饲养室温度(24±1)℃,湿度40%~80%。实验开始前,动物需饲养1 周左右以适应环境。
1.2 药物与试剂
注射用KSJ(山东瑞阳制药股份有限公司,批号:H20040171);对乙酰氨基苯酚(上海麦克林生化科技有限公司,批号:M00118008);10%葡萄糖注射液(济宁辰欣药业股份有限公司,批号:1306251360);天门冬氨酸氨基转移酶(AST)试剂盒(批号:20180612)、丙氨酸氨基转移酶(ALT)试剂盒(批号:20180602)、超氧化物歧化酶(SOD)试剂盒(批号:20180608)及丙二醛(MDA)试剂盒(批号:20180603)购自南京建成生物研究所;小鼠血清肿瘤坏死因子-α(TNF-α)ELISA 试剂盒、白细胞介素-6(IL-6)ELISA 试剂盒购自研域(上海)生物科技有限公司。
1.3 仪器与设备
DQP-9010 型石蜡冷冻切片机(上海华岩仪器设备有限公司),精密电子天平(上海舜宇恒平有限责任公司),高速冷冻离心机(无锡昊特斯科技有限公司),全自动酶标仪[华泰和合(北京)商贸有限公司]。
1.4 分组及给药
小鼠适应环境1 周后,随机取40 只健康成年C57BL/6 小鼠分为空白对照组、APAP 组、KSJ 大剂量组、KSJ 中剂量组和KSJ 小剂量组,每组8 只。KSJ 小、中、大剂量组小鼠参考相关文献[5]分别尾静脉注射KSJ 0.7 mg/(kg·d)、1.4 mg/(kg·d)、2.8 mg/(kg·d),给药10 ml/kg,连续注射7 d,KSJ 用10%葡萄糖溶液配制。空白对照组、APAP 组小鼠注射等剂量溶媒(10%葡萄糖溶液10 ml/kg)7 d。末次给药后1 h,除空白对照组外其他各组小鼠一次性腹腔注射APAP 400 mg/kg,复制APAP 小鼠急性药物性肝损伤模型[6]。空白对照组小鼠则一次性腹腔注射等量生理盐水。禁食不禁水24 h。
1.5 标本采集与检测
1.5.1 小鼠血清AST、ALT 活力检测对乙酰氨基酚处理24 h 后,小鼠摘除眼球取血,37℃静置1 h,于离心机5 000 r/min 离心10 min,取上清液,用PBS 稀释10 倍,检测AST、ALT 活力。
1.5.2 小鼠肝脏MDA、SOD 含量检测眼球取血后,立即处死小鼠,取出小鼠肝脏后加生理盐水制成10%的肝匀浆,按照试剂盒说明书操作,于酶标仪450 nm 波长处读取各孔的吸光度值并记录,检测肝组织中MDA、SOD 活性。
1.5.3 小鼠血浆TNF-α和IL-6水平检测取出冷冻血浆样品,恢复至室温,混匀,常温下离心机5 000 r/min 离心5 min,取上清液50 μl,按照ELISA试剂盒说明书操作,检测血浆中TNF-α 和IL-6 的水平。操作完成后30 min 内,于酶标仪450 nm 波长处读取各孔的吸光度值并记录。最后根据标准曲线计算对应样品的浓度。
1.5.4 小鼠肝脏病理学检查10%甲醛固定小鼠肝脏,24 h 后梯度酒精脱水,二甲苯透明,常规浸蜡包埋,制片,HE 染色。观察肝脏组织病理变化。
1.5.5 免疫组织化学染色检测小鼠肝脏TNF-α 和IL-6 表达切片常规脱蜡,各级浓度酒精水化,抗原修复(微波修复),冷却至室温。滴加山羊血清封闭液,37℃恒温箱放置30 min,加稀释(1∶200)的一抗(TNF-α、IL-6),4℃冰箱过夜。PBS 洗片5 min×3 次,加二抗后,37℃恒温箱放置30 min,PBS 洗片5 min×3 次,滴加ABC 复合物50 μl,37℃恒温箱放置30 min,PBS 洗片5 min×3 次。每张切片加1 滴DAB 液显色20 min,苏木素复染60 s,各级浓度酒精快速脱水,二甲苯透明,中性树胶封片,光镜观察。阴性对照用PBS 代替一抗(TNF-α、IL-6),其他步骤相同。
1.6 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用秩和检验(H检验)或方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠血清AST和ALT活力比较
各组小鼠血清AST 和ALT 活力比较,经秩和检验,差异有统计学意义(P<0.05)。APAP 组AST、ALT 活力较空白对照组增强(P<0.05);APAP 组AST、ALT 活力与KSJ 小剂量组比较,差异无统计学意义(P>0.05);KSJ 中、大剂量组AST、ALT 活力较APAP 组降低(P<0.05);KSJ 小、中、大剂量组间AST、ALT 活力两两比较,差异有统计学意义(P<0.05),且呈剂量依赖性。见表1。
表1 小鼠血清AST、ALT活力比较 (n=8,u/L,±s)

表1 小鼠血清AST、ALT活力比较 (n=8,u/L,±s)
注:①与空白对照组比较,P <0.05;②与APAP 组比较,P <0.05;③与KSJ小剂量组比较,P <0.05;④与KSJ中剂量组比较,P <0.05。
组别空白对照组APAP组KSJ小剂量组KSJ中剂量组KSJ大剂量组H 值P 值AST 39.74±8.16 8 123.71±262.22①8 002.77±138.32 5 563.01±126.61②③2 295.62±553.09②③④12.900 0.012 ALT 35.97±9.20 8 065.28±257.95①7 926.69±143.22 6 107.02±547.94②③2 579.00±510.68②③④13.033 0.011
2.2 小鼠肝脏MDA和SOD含量的比较
各组小鼠肝脏MDA和SOD含量比较,经方差分析,差异有统计学意义(P<0.05)。APAP 组MDA 含量较空白对照组升高(P<0.05),SOD 含量降低(P<0.05);KSJ 小、中、大剂量组MDA 含量较APAP 组下降(P<0.05),SOD 含量升高(P<0.05);KSJ 小、中、大剂量组间MDA 和SOD 含量比较,差异有统计学意义(P<0.05),且呈剂量依赖性。见表2。
表2 小鼠肝脏MDA、SOD含量比较 (n=8,±s)
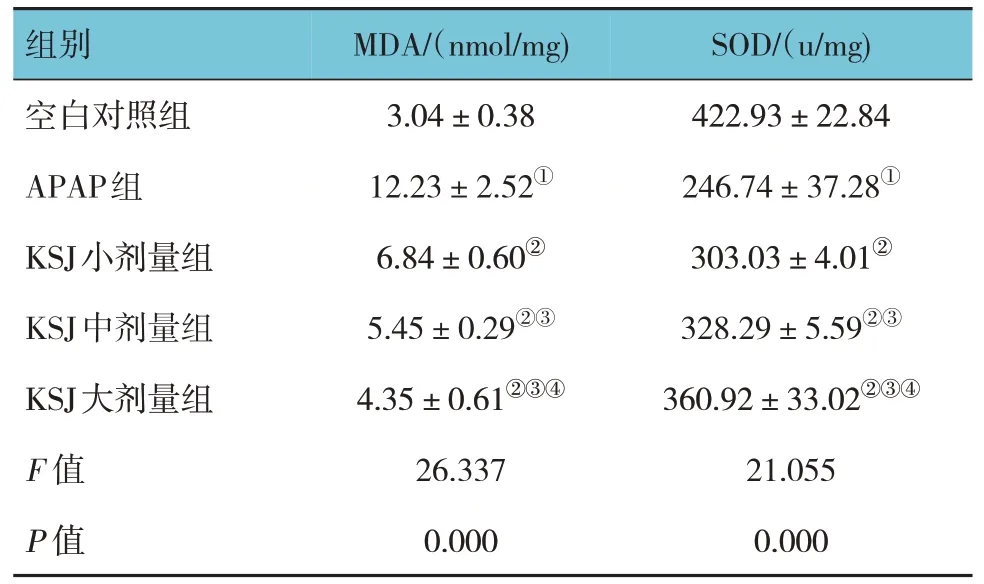
表2 小鼠肝脏MDA、SOD含量比较 (n=8,±s)
注:①与空白对照组比较,P <0.05;②与APAP 组比较,P <0.05;③与KSJ小剂量组比较,P <0.05;④与KSJ中剂量组比较,P <0.05。
组别空白对照组APAP组KSJ小剂量组KSJ中剂量组KSJ大剂量组F 值P 值MDA/(nmol/mg)3.04±0.38 12.23±2.52①6.84±0.60②5.45±0.29②③4.35±0.61②③④26.337 0.000 SOD/(u/mg)422.93±22.84 246.74±37.28①303.03±4.01②328.29±5.59②③360.92±33.02②③④21.055 0.000
2.3 小鼠血清TNF-α和IL-6水平比较
各组小鼠血清TNF-α 和IL-6 水平比较,经方差分析,差异有统计学意义(P<0.05)。APAP 组TNF-α 和IL-6 水平较空白对照组升高(P<0.05);KSJ 小、中、大剂量组TNF-α 和IL-6 水平较APAP组降低(P<0.05);KSJ 小、中、大剂量组间TNF-α和IL-6 水平比较,差异有统计学意义(P<0.05),且呈剂量依赖性。见表3。
表3 小鼠血清TNF-α、IL-6水平比较(n=8,pg/ml,±s)
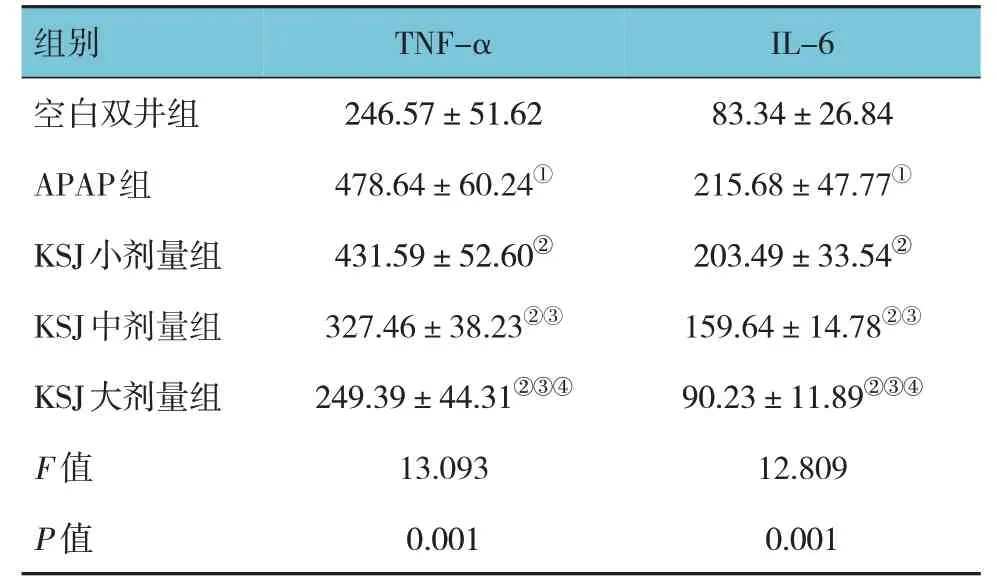
表3 小鼠血清TNF-α、IL-6水平比较(n=8,pg/ml,±s)
注:①与空白对照组比较,P <0.05;②与APAP 组比较,P <0.05;③与KSJ小剂量组比较,P <0.05;④与KSJ中剂量组比较,P <0.05。
组别空白双井组APAP组KSJ小剂量组KSJ中剂量组KSJ大剂量组F 值P 值TNF-α 246.57±51.62 478.64±60.24①431.59±52.60②327.46±38.23②③249.39±44.31②③④13.093 0.001 IL-6 83.34±26.84 215.68±47.77①203.49±33.54②159.64±14.78②③90.23±11.89②③④12.809 0.001
2.4 小鼠肝组织病理变化
各组小鼠肝脏大体病理变化肉眼观,空白对照组小鼠肝脏外观呈红褐色,表面光滑,质软,大小形态正常未见变性和坏死;APAP 组小鼠肝脏损伤明显,体积变大,表面有点状充血、变性和坏死;KSJ 小、中、大剂量组小鼠肝脏变性和坏死程度明显较APAP 组减轻,且KSJ 大剂量组效果更明显。见图1。
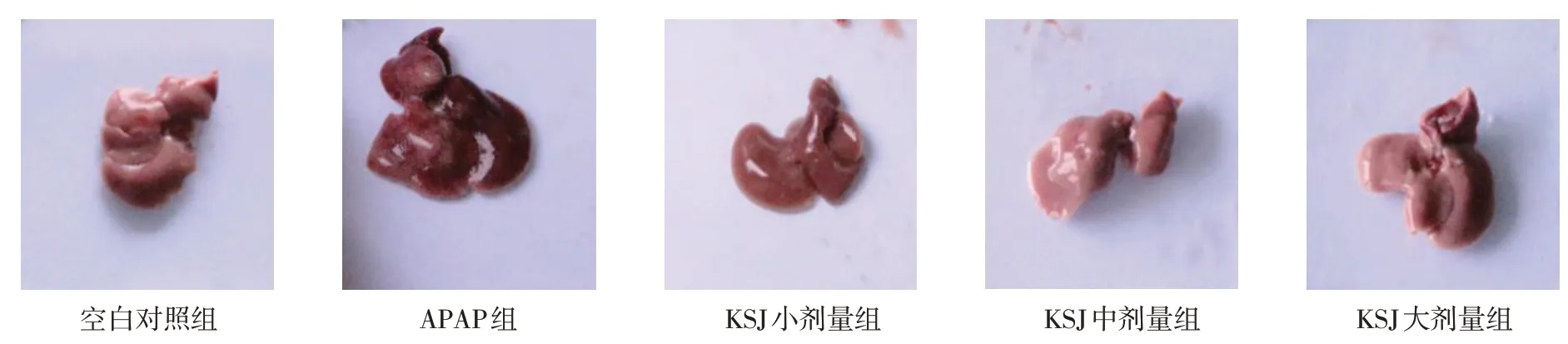
图1 各组小鼠肝组织病理变化
各组小鼠肝脏镜下病理变化光镜下,空白对照组肝细胞核排列规整,清晰可见肝小叶结构,肝细胞索呈放射状排列;APAP 组肝细胞结构破坏严重,肝细胞有不同程度的坏死和变性,肝细胞浆中出现大小各异的圆形空泡,中央静脉淤血;与APAP 组比较,KSJ 小、中、大剂量组可见肝细胞的坏死和变性程度有不同程度的减轻,其中以大剂量组的改善作用最为明显。见图2。
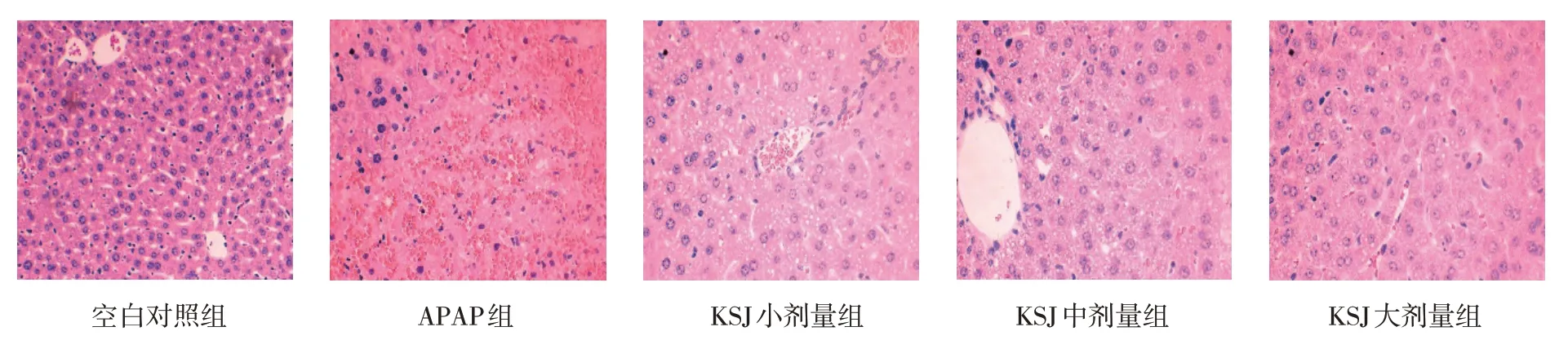
图2 光镜下各组小鼠肝组织病理变化 (HE染色×400)
2.5 各组小鼠肝脏TNF-α和IL-6的表达
各组小鼠肝脏免疫组织化学染色检测结果见图3、4。以细胞胞质中有明显的棕黄色颗粒作为TNF-α、IL-6 阳性表达判定。空白组肝细胞核排列规整,清晰可见肝小叶结构,肝细胞索呈放射状排列,肝脏中仅有少量TNF-α、IL-6 表达。相比空白组,APAP 组肝细胞结构破坏严重,肝细胞有不同程度的坏死和变性,肝脏中TNF-α、IL-6 表达水平升高;与APAP 组比较,KSJ 小、中、大剂量组可见肝细胞坏死和变性有不同程度减轻,肝脏中TNF-α、IL-6 表达水平逐级下降,其中以大剂量组的下降最为明显。

图3 各组小鼠肝脏TNF-α的表达 (免疫组织化学×400)
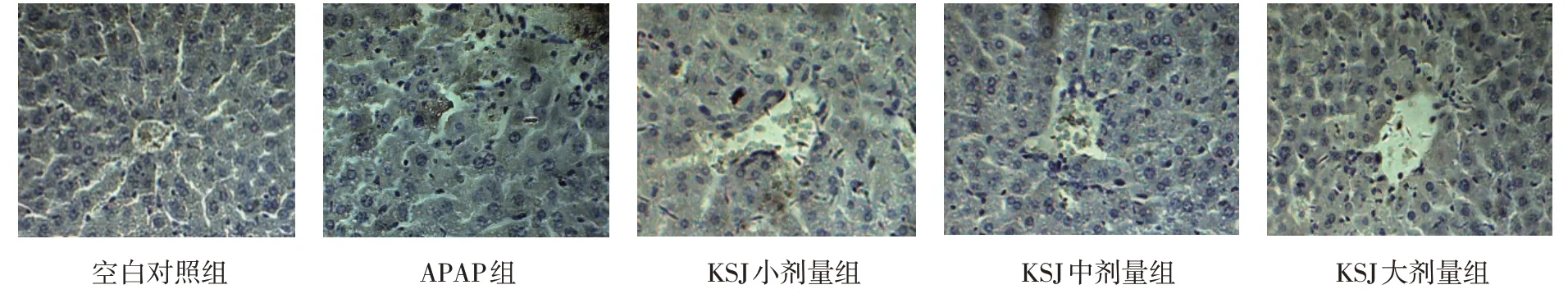
图4 各组小鼠肝脏IL-6的表达 (免疫组织化学×400)
3 讨论
肝脏是人体和动物最重要的代谢场所,许多重要的化学反应都在肝脏进行,也是体内重要的解毒和合成器官,所以易遭受各种药物和代谢产物的损伤[7]。
DILI 是目前临床常见的一种药物源性疾病,引起DILI 最常见的药物是APAP。在疾病早期,可通过停止使用致肝损伤药物并服用保肝药物恢复肝脏功能,如果未及时发现并积极治疗,可发展为急性肝损伤。近年来,中药在药物性肝损伤的治疗中发挥着独特优势。本实验通过复制APAP 所致小鼠急性药物性肝损伤模型,进而探究KSJ 对药物性肝损伤的保护作用及机制。
DILI 的发病机制尚未完全阐明,通过对其机制的研究可以为临床预防和治疗药物性肝损伤提供更多的可能性。肝细胞的坏死、凋亡几乎贯穿于所有肝脏疾病中,不同的是诱发其凋亡的机制存在特异性差异[8-10]。目前的研究发现[11-13],DILI的发生是多种因素共同作用的结果,包括药物的直接毒性损害、特异质肝毒性、线粒体功能损伤、炎症反应等。
AST 和ALT 绝大部分分布在肝细胞内,只有小部分存在于肌细胞中。所以当肝脏受损时,肝细胞膜遭到破坏,AST 和ALT 便进入血液,使得血液中AST 和ALT 含量升高,因此AST 和ALT 可作为评价肝脏生理功能的重要指标[14]。KSJ 组小鼠血清AST 和ALT 含量较APAP 组降低,这表明KSJ 在一定程度上减轻APAP 所致小鼠药物性肝损伤程度。
体内脂质过氧化物的最终代谢产物是MDA,所以MDA 可以反映脂质过氧化物指标和肝细胞损伤的程度[15]。SOD 是机体抗氧化系统中较为关键的酶,其活性降低时,机体内自由基含量就会上升,致使脂质过氧化,进一步损伤肝细胞[16]。本实验给予APAP 后APAP 组小鼠肝组织中MDA 含量明显提高,SOD 活性明显下降,说明小鼠抗氧化系统遭受严重破坏,肝组织发生氧化损伤,而给予KSJ 后MDA 含量较APAP 组有所下降,SOD 活性有所提高,其中KSJ 大剂量组作用更为明显。
炎症因子和氧自由基在肝损伤过程中发挥重要作用。研究发现[17-20],TNF-α 和IL-6 是在APAP 诱导小鼠肝损伤中比较重要的炎症因子,因此,TNF-α和IL-6 可以反映药效和肝损伤程度[21]。本实验结果表明,APAP 模型复制后TNF-α 和IL-6 水平明显升高,经过KSJ 治疗的小鼠血清TNF-α 和IL-6 水平下降,说明KSJ 可以抑制炎症因子TNF-α 和IL-6 的产生,保护APAP 所致肝损伤。HE 染色结果显示KSJ组小鼠肝组织变性、坏死明显减轻,说明KSJ 可以减轻炎症反应,抑制细胞变性、坏死。
目前,DILI 的主要治疗方法是停止使用可疑致肝损伤药物。临床药物治疗[22-24]主要包括N-乙酰半胱氨酸、双环醇和甘草酸制剂等,但大多都是经验用药。糖皮质激素疗效尚不明确,需结合治疗效果和有可能引起的不良反应充分权衡后使用。对有严重并发症的患者,可考虑进行肝移植。KSJ 生物活性广泛,具有抗炎、抗纤维化、抗肿瘤和抗病毒等多重药理作用[3]。临床已被用于治疗各种肝脏疾病。赵岩[25]指出,KSJ 可以降低四氯化碳(CCL4)所致大鼠肝损伤的ALT、AST、IL-6 和TNF-α 水平,减轻肝脏炎症细胞浸润和肝细胞损伤程度。吴洋等[26]指出,KSJ 可能通过抗氧化作用保护肝细胞。本实验结果表明,KSJ 可以降低血清ALT 和AST 水平、降低MDA 含量,提高SOD 活力,以及减轻肝脏病理损伤和肝细胞凋亡程度。同时对APAP 诱导产生的TNF-α 和IL-6 具有抑制作用,并且其效果呈剂量依赖性。
综上所述,KSJ 对APAP 诱导的小鼠DILI 具有良好的保护作用,其作用机制可能与抗炎抗氧化和抑制细胞凋亡有关,因此,KSJ 可作为DILI 肝损伤治疗的候选药,为临床治疗DILI 和探讨其发病机制提供了一定的实验数据。
