ERα基因过表达对去卵巢骨质疏松小鼠骨密度及钙磷代谢的影响*
2021-10-25王珊玺谢菊英李淑珍
王珊玺, 谢菊英, 谢 兴, 李淑珍
(1. 湘南学院医学影像检验与康复学院, 湖南 郴州 423000; 2. 湘南学院附属医院康复医学科, 湖南 郴州 423000;3. 湘南学院附属医院心血管内科, 湖南 郴州 423000)
骨质疏松症是以骨量减少、骨组织显微结构退化导致骨的脆性增高和骨折危险性增加的一种系统性、全身性慢性代谢性骨疾病,全球范围内,近2亿人受到骨质疏松症的影响,而且每年的患病率都在显著增加[1]。目前,诊断为骨质疏松症的妇女的治疗选择包括骨质疏松症专用药物,生活方式干预以及钙(Ca)和维生素D摄入量的增加。但是,许多患有骨质疏松症引起骨折的患者常常无法正确诊断,导致无法获得美国食品药品监督管理局认可的有效疗法[2]。据统计,其在老年人中更为普遍,尤其是绝经后妇女的发病率超过60%,卵巢激素缺乏症是绝经后骨质疏松妇女的主要危险因素[3-4]。雌激素是骨代谢的一个重要调节因子,雌激素缺乏被认为是导致骨密度降低、机械负荷增加导致骨重塑和骨质疏松发展的原因。由于雌激素的作用主要由雌激素受体(ER)介导,包括雌激素受体-α(ERα)和雌激素受体-β(ERβ)通过结合不同的配体来介导各种生物学效应[5-7]。然而,目前关于ERα基因过表达对去卵巢骨质疏松后骨代谢及钙磷代谢的影响研究报道较少。因此,本研究通过构建ERα基因过表达去卵巢骨质疏松模型小鼠,探讨ERα基因过表达对骨代谢及钙磷代谢的影响,为雌激素替代治疗绝经后骨质疏松首选方案提供基础实验依据。
1 材料与方法
1.1 实验动物
选择SPF级12-14周雌性小鼠30只,体重为18-22 g,购自武汉华联科生物技术有限公司。
1.2 实验试剂
戊巴比妥钠(上海生工生物工程公司);青霉素(华北制药股份有限公司);Ca试剂盒、P试剂盒、骨钙素ELISA试剂盒、碱性磷酸酶试剂盒(均购自南京建成生物工程研究所);DAB 试剂盒(北京中杉金桥生物技术有限公司);石蜡、苏木素(均购自Sigma);中性树胶(Wellbio);兔抗鼠TIMP-1抗体、兔抗鼠MCP-1抗体(美国Abcom公司);山羊抗兔二抗(武汉博士德生物工程有限公司)。
1.3 主要仪器
ZKKS-MCT型显微镜(micro-CT)系统(德国Siemens AG公司);5KN0405型材料试验机(英国劳埃德仪器公司);组织切片机(M199,德国莱卡公司);离心机(日本Kubota公司);显微镜(BA210T,Motic);分光光度仪(德国Eppendorf公司);双能X骨密度仪(美国Hologic公司)。
1.4 建立动物模型和分组
按随机化原则将小鼠分为假手术组、模型组和ERα过表达组,各10只。根据文献报道[8]建立去卵巢骨质疏松小鼠模型。假手术组不切除双侧卵巢,仅切除卵巢周围脂肪。术后给予青霉素抗感染,并注意保温。模型建立完成5 d后,ERα过表达组通过椎体髓腔注射的方法转染携带小鼠ERα基因的重组腺病毒载体15 μl,模型组转染空载病毒15 μl,假手术组不作处理。转染7 d后进行后续指标检测。
1.5 骨密度检测
造模结束后麻醉小鼠,置于双能X线吸收测量仪平台上测定股骨骨密度(BMD),根据BMD含量判断是否造模成功并进行后续实验。
1.6 qRT-PCR检测小鼠骨组织ERα基因表达水平
将股骨加入液氮,研磨至粉末后按体重体积比1∶9加入生理盐水在冰浴中充分研磨,制成10%骨匀浆,然后8 000 r/min离心10 min取上清,加入1 ml Trizol裂解液提取骨组织匀浆总RNA,并计算RNA的纯度和浓度;逆转录试剂盒将RNA逆转录成cDNA,并采用SYBR Green I实时荧光定量PCR方法检测ERα基因的表达水平。引物的设计与合成由上海生工公司完成。引物设计如下:ERα上游5'-AGGCGGCATACGGAAAGAC-3',下游5'-CATTTCGGCCTTCCAAGTCA-3';GAPDH上游5'-ACCACAGTCCATGCCATCAC-3',下游5'-TCCACCACCCTGTTGCTGTA-3’。反应条件:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环,每个样本重复检测3次,根据公式2-△△Ct计算ERα基因表达水平。
1.7 Micro-CT扫描
取小鼠左侧股骨,剔除肌肉组织,对股骨中心点及远心端进行Micro-CT扫描测量骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)、骨体积分数(BV/TV)。
1.8 骨代谢及钙磷代谢相关指标测定
腹主动脉取血,静置后3 500 r/min 离心5 min分离血清。按试剂盒说明说对小鼠骨钙素(BGP)、碱性磷酸酶(ALP)、钙(Ca)、磷(P)进行检测。
1.9 骨生物力学强度检测
取小鼠右侧股骨,剔除肌肉组织,放置于5KN0405材料试验机上进行三点弯曲试验。加载点于股骨中点,跨距为18 mm,加载速度为2 mm/min,记录并计算最大载荷和刚性系数。
1.10 免疫组化检测骨组织中TIMP-1和MCP-1的蛋白表达水平
将10%中性福尔马林溶液固定、石蜡包埋的标本切成4 μm厚的切片,经二甲苯脱蜡、乙醇逐步水化后将切片置于枸橼酸钠缓冲液中煮沸15 min进行抗原修复。3%双氧水浸泡10 min,用于去除内源性酶。每张切片的组织上滴加50 μl山羊血清,封闭30 min。弃去山羊血清,加50 μl兔抗鼠TIMP-1抗体和兔抗鼠MCP-1抗体孵育,4℃过夜。次日,弃去一抗后滴加二抗孵育30 min。滴加DAB显色剂,镜下观察组织颜色。之后进行苏木素复染。依次经过70%、80%、90%、95%、无水乙醇各5 min,二甲苯20 min后用中性树脂封片。显微镜下观察TIMP-1和MCP-1的蛋白表达,每个样本随机选择6个视野,分析各个视野的平均光密度值(A值)。
1.11 统计学处理
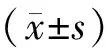
2 结果
2.1 各组小鼠骨组织ERα基因表达水平的比较
与假手术组(1.00±0.09)相比,模型组小鼠骨组织ERα基因表达水平(0.43±0.08)显著降低(P<0.05);ERα过表达组小鼠骨组织ERα基因表达水平(3.06±0.15)显著上升(P<0.05)。
2.2 ERα过表达对各组小鼠BMD及骨参数的影响
与假手术组相比,模型组和ERα过表达组小鼠BMD、BV/TV、Tb.Th显著降低、Tb.Sp显著升高(P<0.05);ERα过表达组小鼠BMD、BV/TV、Tb.Th较模型组小鼠显著上升、Tb.Sp显著降低(P<0.05)。各组小鼠Tb.N比较差异均无统计学意义(P> 0.05,表1)。

Tab. 1 Comparison of BMD and bone parameters of mice in each n=10)
2.3 ERα过表达对各组小鼠骨生物力学的影响
与假手术组相比,模型组和ERα过表达组最大载荷和刚性系数显著降低(P<0.05);与模型组相比,ERα过表达组组最大载荷和刚性系数均显著升高(P<0.05,表2)。

Tab. 2 Comparison of bone biomechanics of mice in each n=10)
2.4 ERα过表达对各组小鼠血清中骨代谢及钙磷代谢指标的影响
与假手术组相比,模型组BGP和ALP显著升高,Ca和P显著降低(P<0.05);与模型组相比,ERα过表达组BGP和ALP显著降低,Ca和P显著升高(P<0.05,表3)。
2.5 ERα过表达对各组小鼠骨组织中TIMP-1和MCP-1蛋白表达的影响
TIMP-1和MCP-1阳性表达均表达于胞浆中。与假手术组相比,模型组小鼠骨组织中TIMP-1平均光密度值显著降低,而MCP-1平均光密度值显著升高(P<0.05);与模型组相比,ERα过表达组TIMP-1平均光密度值显著升高而MCP-1显著降低(P<0.05,表4,图1)。

Tab. 3 Comparison of bone metabolism and calcium and phosphorus metabolism of mice in each n=10)
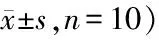
Tab. 4 Comparison of mean optical density of TIMP-1 and MCP-1 in bone tissues of mice in each group(A value,
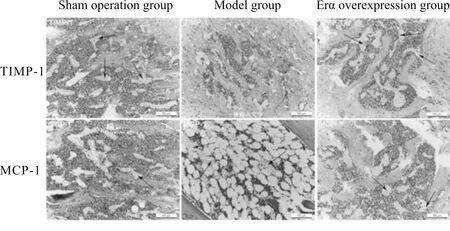
Fig. 1 The expressions of TIMP-1 and MCP-1 protein in bone homogenate of mice in each group (Scale bar=100 μm)
3 讨论
卵巢切除诱发骨质疏松症是最常见的骨质疏松症类型。在绝经后骨质疏松症中,骨形成和骨吸收是不平衡的,这是由于绝经后雌激素水平降低引起的[9]。ERα被认为是骨骼中雌激素保护作用的主要调节因子。ERα在成骨细胞和骨细胞中表达,并在这些细胞中起重要作用[10]。有研究发现,在激素水平正常的情况下,雌激素可通过ERα在骨代谢中发挥级联反应,参与维持骨代谢平衡,且骨组织中ERα的表达具有雌激素依赖性,雌激素水平降低后,其受体转录和翻译水平同时受到抑制[11]。另有研究发现,抑制microRNA-148a可通过ERα调控PI3K/AKT信号传导防止卵巢切除术引起的骨质疏松[12]。本研究在进行两侧卵巢切除术建立骨质疏松模型后转染携带小鼠ERα基因的重组腺病毒载体,结果表明ERα过表达组ERα基因表达水平显著高于假手术组和模型组,提示成功建立小鼠ERα基因过表达模型。
骨质疏松症的特点是由于骨转换率的增加,骨密度(BMD)和骨体积指数(BV/TV)过度降低。BMD是反映人体骨骼代谢状况的一项重要指标,是目前公认的诊断骨质疏松和疗效评估的金标准[13]。骨生物力学主要是研究骨组织在外界作用下的力学性能和骨在受力后所产生的生物学效应,骨量的减少和骨质内部结构的改变均能影响骨生物力学,并降低生物力学强度。骨组织骨量及内在的生物力学性能等指标是判定骨质疏松骨性能的重要指标。同时,在骨质疏松症的发展进程中,反映骨吸收与骨形成平衡状况的骨代谢生化指标也随之发生变化[14-15]。有研究发现,去除卵巢后,雌激素分泌减少,导致BMD下降,骨量增加受阻,骨吸收大于骨形成、骨生物力学发生改变,骨脆性增加,引发骨质疏松甚至骨折[16-18]。血清Ca和P测定可间接反应骨代谢情况,血Ca降低,甲状旁腺激素分泌增加,导致大量骨钙入血,引起骨质疏松。有研究发现,调节糖代谢可有效促进血Ca含量,改善BMD以缓解二型糖尿病大鼠骨质疏松[19]。本研究结果表明模型组小鼠BMD、Tb.Th、BV/TV、最大载荷、刚性系数、Ca和P等指标均显著降低,而Tb.Sp、BGP和ALP等指标均升高,提示雌性小鼠去除双侧卵巢后发生骨质疏松;ERα基因过表达后,BMD、Tb.Th、BV/TV、最大载荷、刚性系数、Ca和P等指标均显著升高,而Tb.Sp、BGP和ALP等指标均显著降低,提示ERα基因过表达后模型小鼠的各项指标均有所改善;ERα对于改善去卵巢引起的骨质疏松症具有良好的效果。
TIMP-1是由骨细胞分泌的一类蛋白酶抑制剂,主要调控骨基质代谢的平衡[20]。MCP-1是趋化因子家族中最具代表性的成员,作为炎症级联反应的起始因子,可趋化单核细胞、嗜碱性粒细胞等炎症细胞,也可诱导阳性端粒酶,使单核细胞在巨噬细胞集落刺激因子的刺激下产生破骨细胞,从而参与骨质疏松症的形成[21-22]。有研究发现,过表达ERα可通过增加实验性自身免疫性脑脊髓炎小鼠脑组织中TIMP-1及TIMP-2抑制炎症反应[23]。另有研究发现,雌激素E2和ERα对脂多糖刺激的脂肪细胞MCP-1有抑制作用,可能与p38 MAPK/NF-κB级联的抑制有关[24]。本研究结果表明,与假手术组相比,模型组小鼠骨组织中TIMP-1平均光密度值显著降低而MCP-1平均光密度值显著升高,ERα基因过表达后,TIMP-1平均光密度值显著升高而MCP-1平均光密度值显著降低,提示ERα基因过表达后可增加骨组织中TIMP-1的表达水平,同时降低MCP-1的表达水平,起到改善骨质疏松症的作用。
综上所述,ERα基因过表达对骨质疏松症具有重要作用,其可能是通过调节骨密度及骨体积指数,改善骨代谢和钙磷代谢,促进骨组织TIMP-1的表达并降低MCP-1的表达,从而改善骨质疏松。
