线粒体DNA U4b单倍群:中国塔吉克族高原原发性高血压的遗传易感因素*
2021-10-25陈兴书阳盛洪罗勇军
陈 郁, 高 亮, 龚 亮, 陈兴书, 阳盛洪, 罗勇军△
(1. 陆军军医大学陆军卫勤训练基地军事医学地理学教研室, 重庆 400038; 2. 解放军第950医院, 新疆 叶城 844900;3. 解放军第949医院, 新疆 阿勒泰 836300)
高血压作为心血管事件重要的危险因素,影响了全世界大约30%的人群身体健康[1, 2],而遗传因素在高血压的发生过程中发挥着显著作用,核基因和线粒体基因均参与其中[3, 4]。研究表明,线粒体DNA(mitochondrial DNA, mtDNA)变异与高原适应和高原疾病有关[5-7],但是其在高原原发性高血压(high altitude essential hypertension, HAEH)发生中的作用尚不十分清楚。近年来,越来越多的研究表明mtDNA变异与高血压的发生有关,包括mtDNA7492C、15927G[8]、4401A、5821G[9]及4263A[10]等,表明mtDNA变异是高血压发生的原因之一,其引起的异常调控变化在高血压的潜在发生机制。中国塔吉克族世代生活在塔什库尔干县,位于帕米尔高原东部,平均海拔在4 000 m以上。流行病学调查提示,中国塔吉克族的高血压发病率较高,远高于全国平均水平,但其中的原因和机制仍不清楚[11]。塔吉克族很少与外族通婚,遗传资源受外界干扰程度低,这为分析HAEH的致病基因提供了很好的遗传基础。上述研究提示,mtDNA变异极有可能参与了塔吉克族HAEH的发生。为从mtDNA角度探索塔吉克族HAEH的遗传基础,本研究拟通过聚合酶链式反应(polymerase chain reaction, PCR)扩增mtDNA片段,并经过拼接获得线粒体全基因组序列,结合生物信息学技术分析mtDNA碱基突变和单倍群变异在HAEH中的特点,分析mtDNA变异在中国塔吉克族HAEH中的作用,以进一步丰富对HAEH发生的认识,寻找潜在的治疗靶点。
1 对象与方法
1.1 研究对象
在新疆喀什地区的塔什库尔干县的中国塔吉克族人群中,收集了53例HAEH患者和46例高原健康者作为对照。病例的入选标准为:收缩压不低于140 mmHg,和/或舒张压不低于90 mmHg,并排除其他疾病所致的继发性高血压等情况。对照组为高原健康塔吉克族个体。
1.2 DNA提取
每名受试者取静脉全血2 ml,经EDTA-K2抗凝处理后,采用OMEGA全血基因组提取试剂盒(D3392-02,Omega Bio-tek, USA)提取全血DNA,经NanoDrop-2000测定DNA浓度后,分装存于-20℃备用[12]。
1.3 线粒体DNA扩增和拼接
参照Jiang[7]的方法,根据mtDNA的剑桥参考序列,分别设计不同的扩增引物和测序引物,将mtDNA分段扩增。PCR产物经测序后拼接,最终获得每个受试者的线粒体基因组序列。所得序列使用mtDNA序列在线分析工具MitoTool (http://mitotool.kiz.ac.cn/)与剑桥标准序列(NC_012920)对比[13],以获得每个个体的线粒体单倍群和mtDNA变异位点。利用Mitomap数据库(https://www.mitomap.org//MITOMAP)[14]对mtDNA变异位点进行检索,获取其相应的基因定位和生物学功能,对涉及氨基酸变异的位点纳入后期生物信息学预测当中。
1.4 生物信息学预测mtDNA所致氨基酸变异和功能改变
为进一步研究mtDNA变异所致的功能变化,本研究通过多种生物信息学在线软件探索mtDNA变异导致HAEH的可能机制。对具有明显分布差异的错义突变位点,在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中检索其所在蛋白质序列编号,并用一系列生物信息学软件分析变异所致的潜在功能变化,包括: Protparam(http://web.expasy.org/protparam)[15]分析突变前后的蛋白质理化性质变化,ProtScale(http://web.expasy.org/protscale)[16]分析突变前后的亲/疏水性变化,TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM)[17]分析蛋白跨膜螺旋结构变化,Psipred 4.0(http://bioinf.cs.ucl.ac.uk/psipred/)[18]和PredictProtein软件(https://www.predictprotein.org/)[19]预测变异前后蛋白质二级结构变化,Swiss-Model(http://swissmodel.expasy.org)[20]预测变异前后蛋白质三级结构变化,以及NCBI的蛋白质数据库预测变异前后的蛋白质四级结构变化。
1.5 统计学处理
2 结果
2.1 HAEH组和对照组基本情况的比较
HAEH组和对照组的基本信息见表1,可见HAEH组和对照组的年龄和性别比存在显著差异。为了平衡年龄和性别差异,本研究采用二分类的logistic回归分析来校正年龄和性别差异。
Tab. 1 Characteristics of subjects in HAEH and size)
2.2 HAEH组和对照组中mtDNA单倍群分布的比较
经与MitoTool在线软件对比后,获得所有受试者的mtDNA单倍群类型。HAEH组和对照组的单倍群分布具体如下(表2)。
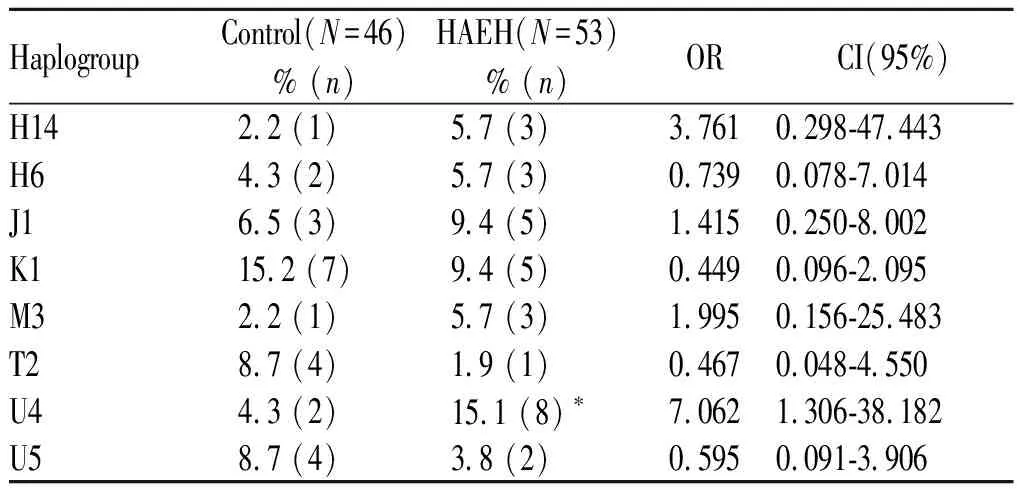
Tab. 2 Haplogroup distribution between HAEH and control
流行病学指出,优势比(odds ratio, OR)是暴露人群发病优势与非暴露人群发病优势之比,在logistic回归分析中,当OR值>1,P<0.05,提示该研究因素为危险因素(易感因素)。和对照组相比,HAEH组中U4单倍群的频率显著升高(P=0.023<0.05,OR=7.062,95%CI=1.306-38.182),表明U4单倍群会显著增加中国塔吉克族人群罹患HAEH的易感性。经MitoTool数据库进一步分析发现,所有U4单倍群的个体均隶属于U4b单倍群。经logistic回归校正年龄后,U4b单倍群在HAEH组和对照组之间分布差异的显著性P值为0.000, OR=1.071, CI=1.032-1.110;校正性别后,U4b单倍群在HAEH组和对照组之间分布差异的显著性P值为0.023, OR=5.351, CI=1.257-22.773。上述结果表明,即便校正年龄和性别之后,U4b单倍群依然是中国塔吉克人群HAEH的危险因素。
2.3 mtDNA变异在HAEH组和对照组分布的比较
经与剑桥序列对比,获取每名受试者mtDNA基因组中的每个位点的变异情况。前面分析的结果提示, U4b单倍群的分布具有显著差异,故在分析mtDNA各个位点的频率分布时,仅针对U4b单倍群的标签位点,结果见表3。在U4b的标签位点中,mtDNA的499、4646、5999、6047、7705、11332、15693和16356位点的基因型变异频率在HAEH组显著升高(499、4646、5999、6047、7705、15693和16356位点:P=0.023<0.05,OR=7.062,95%CI=1.306-38.182;11332位点:P=0.031<0.05,OR=6.573,95%CI=1.193-36.216),和对照组之间存在显著差异,提示携带上述位点的基因型变异可能提高塔吉克族罹患HAEH的风险。
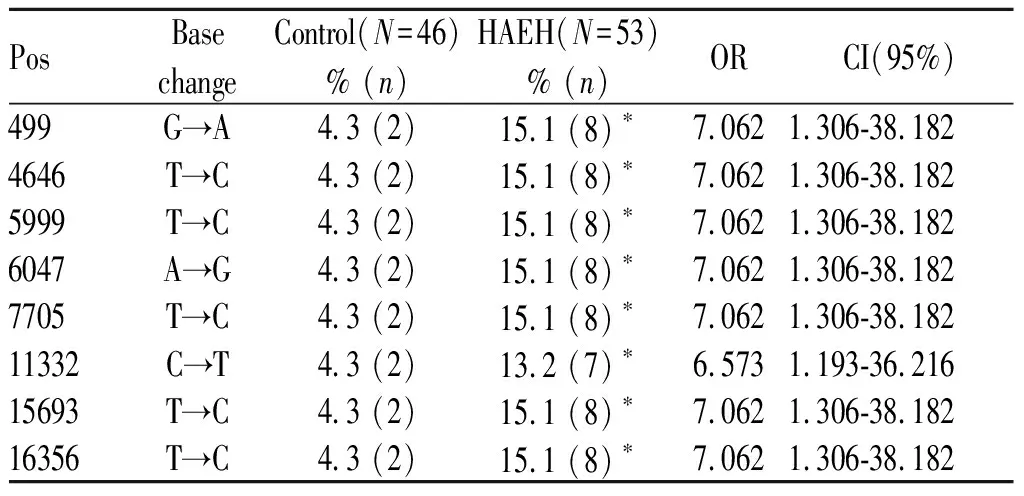
Tab. 3 Distribution of tag position of mtDNA haplogroup U4b between HAEH and control
2.4 阳性mtDNA关联位点的功能预测
结果2.3表明,mtDNA的U4b单倍群的8个标签位点在HAEH组和对照组的分布有着显著差异。经与MitoTool在线软件对比,并参阅Mitomap数据库后发现仅mtDNA15693T>C变异会导致氨基酸变化。该位点位于mtDNA的Cytb基因中,并编码第316位氨基酸,编码蛋白是线粒体CYB蛋白(复合体Ⅲ)的重要结构。当由T突变为C时,氨基酸由蛋氨酸变异为苏氨酸。由于氨基酸变异直接导致蛋白质及结构的变化,可能会进一步导致蛋白质高级结构的变化而影响蛋白功能。为进一步评估mtDNA15693T>C变异可能导致的功能变化,本研究通过生物信息学在线预测软件实现。
2.4.1 CYB和CYB(M316T)蛋白理化性质、亲疏水性和跨膜结构变化 在查阅NCBI的蛋白质数据库后,获取CYB蛋白全氨基酸序列,并将第316位氨基酸从蛋氨酸变异为苏氨酸之后,经Protparam、ProtScale和TMHMM 2.0软件分析,变异前后Cytb蛋白质的理化性质、亲疏水性和跨膜结构无显著影响。
2.4.2 CYB蛋白二级结构预测 经PisPred预测,CYB蛋白中各二级结构类型分布所占百分比为α螺旋66.84%,β折叠2.37%,无规卷曲30.79%,发生M316T突变之后其二级结构构成比例变为α螺旋67.63%,β折叠2.37%,无归卷曲30.00%。变异后其二级结构并没有发生改变,仍是属于Coil区域。
然而,由于CYB蛋白的第316号氨基酸发生了改变,由疏水的非极性氨基酸蛋氨酸变成了亲水性的极性氨基酸苏氨酸,这可能改变其二级结构的亲疏水性,甚至有可能对其二级结构产生影响。经PredictProtein预测后发现,在该位点氨基酸突变后会形成一个新的磷酸化位点,即TFR(苏氨酸、苯丙氨酸、精氨酸组合的氨基酸序列)的一个蛋白激酶C磷酸化位点,这个位点会导致蛋白磷酸化的Vmax和Km值都增加,结合CYB的功能推测,该磷酸化位点的形成可能会影响线粒体磷酸化和电子传递链的功能。
3 讨论
高血压是诱导恶性心血管事件的重要因素,而在高原地区经历寒冷低氧等刺激后,血压的波动更为剧烈,容易出现不良结局,对人体造成的危害也更为严重,因而深入研究高原血压异常的发病机制和防治策略对维护高原居民健康、推动高原地区经济发展有着重要意义。有关mtDNA变异与中国塔吉克族HAEH发生的关系研究鲜有报道。在本研究中发现,mtDNA的U4b单倍群是中国塔吉克族罹患HAEH的危险因素。其中,U4b单倍群的标签位点,即mtDNA499、4646、5999、6047、7705、11332、15693和16356的基因型分布在HAEH组和对照组之间存在显著差异。除了mtDNA15693位点外,其他有差异的位点均不导致氨基酸变异。mtDNA15693T>C变异会导致CYB蛋白第316号氨基酸由蛋氨酸变为苏氨酸,经生物信息学软件预测该突变诱导形成了一个新的蛋白激酶C磷酸化位点,可能与HAEH的发生有关。
分布有差异的U4b单倍群标签位点中,499和16356位点在mtDNA的D-loop区,而其他位点都位于基因编码区。mtDNA15693位于编码CYB蛋白的基因中,其T→C变异是一个高度保守性的致病性突变,可能与女性的左室心肌致密化不全有关[21]。此外,研究发现CYB蛋白结构和功能变化会导致女性动脉粥样硬化,而这也是高血压发生的重要原因[22]。mtDNA15059G→A变异与原发性高血压有关,该位点也位于编码CYB蛋白的区域内[23]。上述研究表明,CYB蛋白的结构和功能变化与高血压的发生密切相关。本研究中发现的mtDNA15693T>C变异虽然并未导致CYB蛋白的二级结构变化,但新形成了一个蛋白激酶C的磷酸化位点。蛋白激酶C不仅可以与5-羟色胺和5-羟色胺2A受体结合[24],还可以推动肾上腺素能激动剂和肾上腺素α1受体的结合[25]。α1受体主要分布在血管和突触前膜上,兴奋时引起血管收缩,而这也是高血压发生的重要机制之一。因此,mtDNA15693T>C变异通过诱导形成一个新的蛋白激酶C磷酸化位点,可能加强蛋白激酶C的磷酸化功能,但是中间涉及的环节较多,其如何诱导HAEH的发生还有待于深入的分子机制研究。
本研究还是采用的PCR片段扩增,产物测序并拼接以获取mtDNA全部序列,也就是传统的Sanger测序(一代测序)。Sanger测序准确率高,是基因检测的金标准,然而其主要作用在于确定基因型,并不能检测出低拷贝型的嵌合体。在实验过程中也发现,上述操作较为繁琐,而且相邻片段之间存在交叉,需要在拼接时对比剑桥序列进行剪切以排除重复序列。在拼接和对比时容易出现失误以致影响序列的准确性。伴随着测序技术的发展,二代以及三代测序已经发展得较为成熟可靠,虽然其测序的准确性不如一代测序,但是其快速、高通量、多重测序深度的特点可以有效降低测序中出现的错误,并且也能分析出低拷贝型的嵌合体。针对Sanger测序和二代、三代测序的优缺点,在不同的实验设计中分别组合利用,能够有效获取mtDNA的全部序列,为全面分析其所携带的遗传信息提供技术支持。
本研究中样本量较少,性别和年龄并不匹配,并且由于实验条件限制并未开展功能实验。在后续研究中,将继续从mtDNA角度探讨中国塔吉克族HAEH的发生机制,一方面扩大样本量,进一步平衡性别和年龄差异,采用高通量测序方法检测mtDNA的变异,另一方面通过细胞和分子实验进一步验证mtDNA变异在HAEH发生中的作用。
综上所述,本研究表明线粒体单倍群U4b是中国塔吉克族HAEH的遗传易感因素,携带mtDNA15693C基因型的个体可显著增加罹患HAEH的风险。功能预测提示该变异会诱导CYB蛋白形成一个新的蛋白激酶C磷酸化位点,但是并不会引起CYB蛋白二级结构的变化。深入探讨mtDNA在HAEH中的作用,将进一步从线粒体角度丰富对高原血压异常的认识,为高原血压异常的防治提供新的治疗思路和靶点。
