人脐带间充质干细胞的分离培养及多向分化潜能研究
2021-10-25李彦洁黄华鑫
陈 凤,杨 敏,李彦洁,彭 凌,黄华鑫,彭 运
(深圳市第三人民医院 感染病国家重点专科,深圳 518112)
间充质干细胞(mesenchymal stem cells,MSCs)是一类来源于中胚层的成体干细胞,具有自我更新和多向分化的潜能。研究表明,MSCs广泛存在于成体及胎儿的各种组织中,如骨髓[1]、外周血[2]、脂肪组织[3]、羊膜和脐带[4]、胎盘[5]、牙髓[6]、皮肤等[7]。迄今为止,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)仍是研究和应用最广泛的,但获取骨髓对人体伤害大,来源有限,限制了它在临床上的应用。目前的研究已证明,人脐带的华通氏胶内含有丰富的脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs),作为一种较原始的MSCs,具有容易获得、较低的免疫原性和多向分化的特点,成功避开了胚胎干细胞(embryonic stem cells,ESCs)和BMSCs在使用过程中的诸多限制,从而被广泛用于多种疾病的治疗,取得较好的疗效,是干细胞研究的重要来源[8-10]。目前,已有较多研究通过组织贴壁的方法成功分离培养hUCMSCs,但不同研究条件下可能导致所获得的细胞来自不同的亚群,其生物学特性可能存在差异,从而制约了人们对hUCMSCs的认识。因此,通过生物学方法不断丰富对hUCMSCs特性的认识,将有利于促进干细胞临床应用的发展。鉴于此,对脐带组织中的MSCs做分离培养,并对其生物学特性和多向分化潜能进行鉴定,以期为干细胞的临床研究提供参考。
1 材料与方法
1.1 材料
脐带组织取自深圳市第三人民医院妇产科健康产妇足月剖宫产的胎儿。研究内容已获得医院伦理委员会的批准和参加者的知情同意。
DMEM培养基、胎牛血清、成脂成骨成软骨分化培养基(Gibco公司);流式细胞仪、CD34-PE、CD44-PE、CD45-PE、CD105-PE单克隆抗体(BD公司);Easypure®RNA kit、TransScript®All-in-one first-stand CDNA Synthesis superMix for qPCR(北京全式金生物技术有限公司);引物由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 脐带间充质干细胞的分离培养
无菌采集健康产妇剖宫产中的胎儿脐带15~20 cm,装入预先放置PBS(含2%青霉素+2%链霉素)的密封玻璃瓶中带回实验室。于实验室超净工作台内,反复冲洗以除去脐带组织表面的血凝块,用止血钳夹住脐带两端,放入75%医用酒精浸泡1 min左右;然后转移至PBS中清除脐带表面残余的酒精,将脐带剪成2~3 cm的片段,放入PBS中,以除去脐带动脉、静脉中的血细胞;随后用组织剪剪开脐静脉,去除脐静脉、脐动脉及脐带外膜,分离出华通氏胶组织(Wharton gel),PBS反复冲洗后将Wharton gel剪成2~3 mm组织块均匀铺于60 mm培养皿中,加入少量DMEM培养基(含10%胎牛血清和1%青霉素+1%链霉素),于37 ℃、5% CO2培养箱中培养;待细胞长满后,用0.25%胰蛋白酶进行消化传代。
1.2.2 细胞表面抗原检测
取传代培养至P3的hUCMSCs,胰酶消化收集细胞,加入PBS调整细胞浓度为1×105个/mL,取200 μL细胞悬液按照抗体使用说明书分别加入相应量带有荧光标记的单抗(CD34-PE、CD44-PE、CD45-PE、CD105-PE)混匀,室温避光孵育30 min,随后1 200 r/min离心5 min,弃上清液,PBS洗2遍后,加入300 μL PBS重悬细胞,上流式细胞仪,检测细胞表面标志物的表达。
1.2.3 多能性相关基因的表达
取传代培养至P4的hUCMSCs,分别按照Easypure®RNA kit和TransScript®All-in-one first-stand CDNA Synthesis superMix for qPCR试剂盒的说明书进行总RNA的提取和反转录。PCR扩增反应条件:95 ℃预变性3 min;95 ℃变性30 s,Tm退火30 s,72 ℃延伸30 s,35个循环;最后72 ℃再延伸10 min。反应结束后进行琼脂糖凝胶电泳,观察hUCMSCs中与多能性相关基因Oct4、Sox2和Nanog的表达情况。各基因的PCR引物如表1所示。
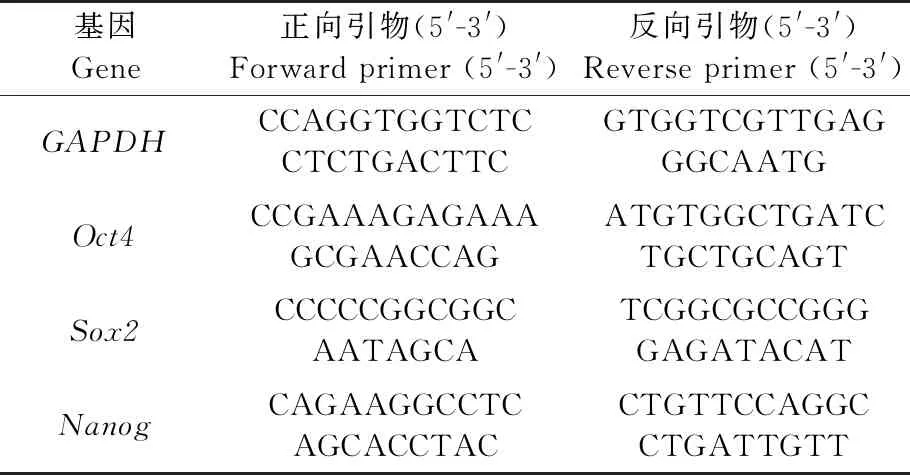
表1 多能性相关基因的引物序列Table1 Primers for pluripotent related genes
1.2.4 多向分化潜能的鉴定
取传代培养至P4的hUCMSCs,以1×105个/孔接种到6孔板中,成脂、成骨、成软骨及各自的对照各2孔,待细胞贴壁后,分化组分别加入分化诱导培养基,对照组加入普通培养液(DMEM+10%胎牛血清+1%青霉素+1%链霉素)。将所有组细胞置于37 ℃、5% CO2饱和湿度的培养箱中培养,每3 d换液1次。成脂、成骨、成软骨组分别在D10、D18和D21停止诱导。采用组织染色和RT-PCR方法对诱导产物进行鉴定。成脂分化组行油红O染色并鉴定LPL和PPAR基因的表达;成骨分化组行茜素红染色并鉴定ALP和OCN基因的表达;成软骨分化组行阿尔新蓝染色并鉴定CoI-II和COMP基因的表达。各基因的PCR引物如表2所示。
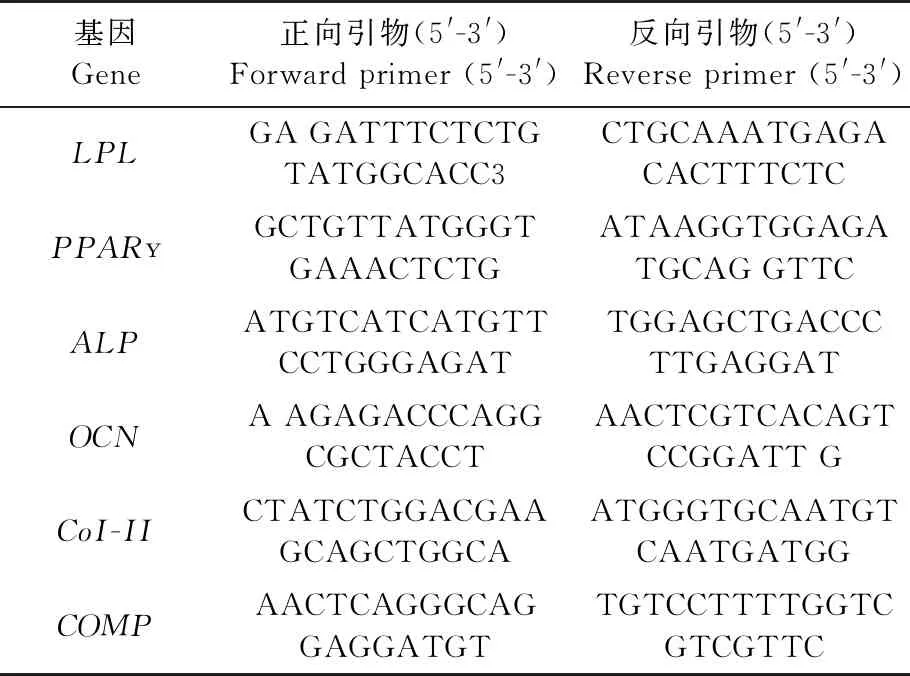
表2 成脂、成骨、成软骨标志基因的引物序列Table 2 Primers for expression of adipogenic,osteogenic and chondrogenic marker genes
2 结果与分析
2.1 形态学观察
脐带组织贴壁培养5 d,可见组织块的周围长出少量的贴壁细胞,形态呈细小的梭形,10 d左右细胞迅速增殖,14 d时局部细胞汇合度达80%~90%,形态为长梭形,排列紧密,呈平行或漩涡状生长。
2.2 细胞表面标志物检测
从脐带组织分离出的细胞高度表达间充质干细胞表面标志物CD44和CD105,但低表达造血细胞表面标志物CD34和CD45(图1),说明从脐带分离出的纤维样形态的贴壁细胞具有MSCs的生物学特性。
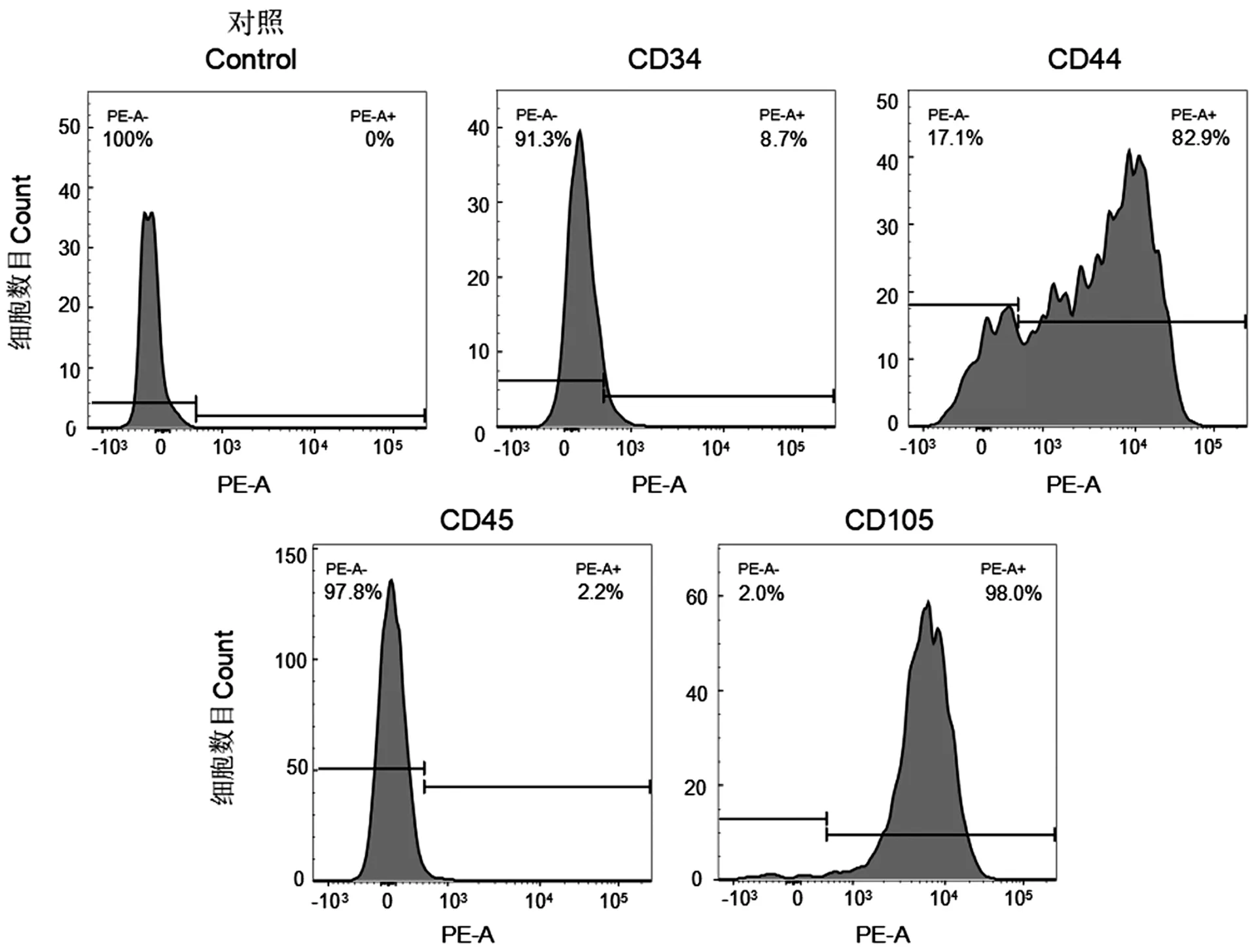
图1 底物/氧/铜离子的电子转移过程Figure 1 Substrates/oxygen/copper ions electronic transfer pathway of laccase
2.3 多能性相关基因的表达
通过进一步证实从脐带组织分离出的细胞表达胚胎干细胞的表面标志基因Oct4和Nanog,但是不表达Sox2基因,这些结果表明获得的细胞具有干细胞特性。
2.4 多向分化潜能
成脂分化诱导中,可见细胞由纤维状逐渐变为圆形或椭圆形,3 d时可见少量脂滴形成,随着时间延长,细胞内空泡样的脂滴增多变大,于第10天行油红O染色,可见细胞浆中有大量红色的油滴[图2(a)],对照组细胞未见明显的油滴形成[图2(a′)];RT-PCR表明诱导后的hUCMSCs表达PPAR,低量表达LPL基因(图3)。成骨分化诱导中,细胞逐渐变为短梭形,于第18天行茜素红染色,可见胞浆内有大量红色的钙结节[图2(b)],对照组未见明显的钙结节形成[图2(b′)];RT-PCR表明诱导后的hUCMSCs表达ALP和OCN特异基因(图3)。成软骨分化诱导中,细胞形态逐渐变为多角形、多边形,其中夹杂着纺锤状细胞,于第21天行阿尔新蓝染色可染成淡蓝色[图2(c)],对照组未变色[图2(c′)],提示分化后细胞产生软骨基质;RT-PCR表明诱导后的hUCMSCs表达CoI-II和COMP特异基因(图3)。
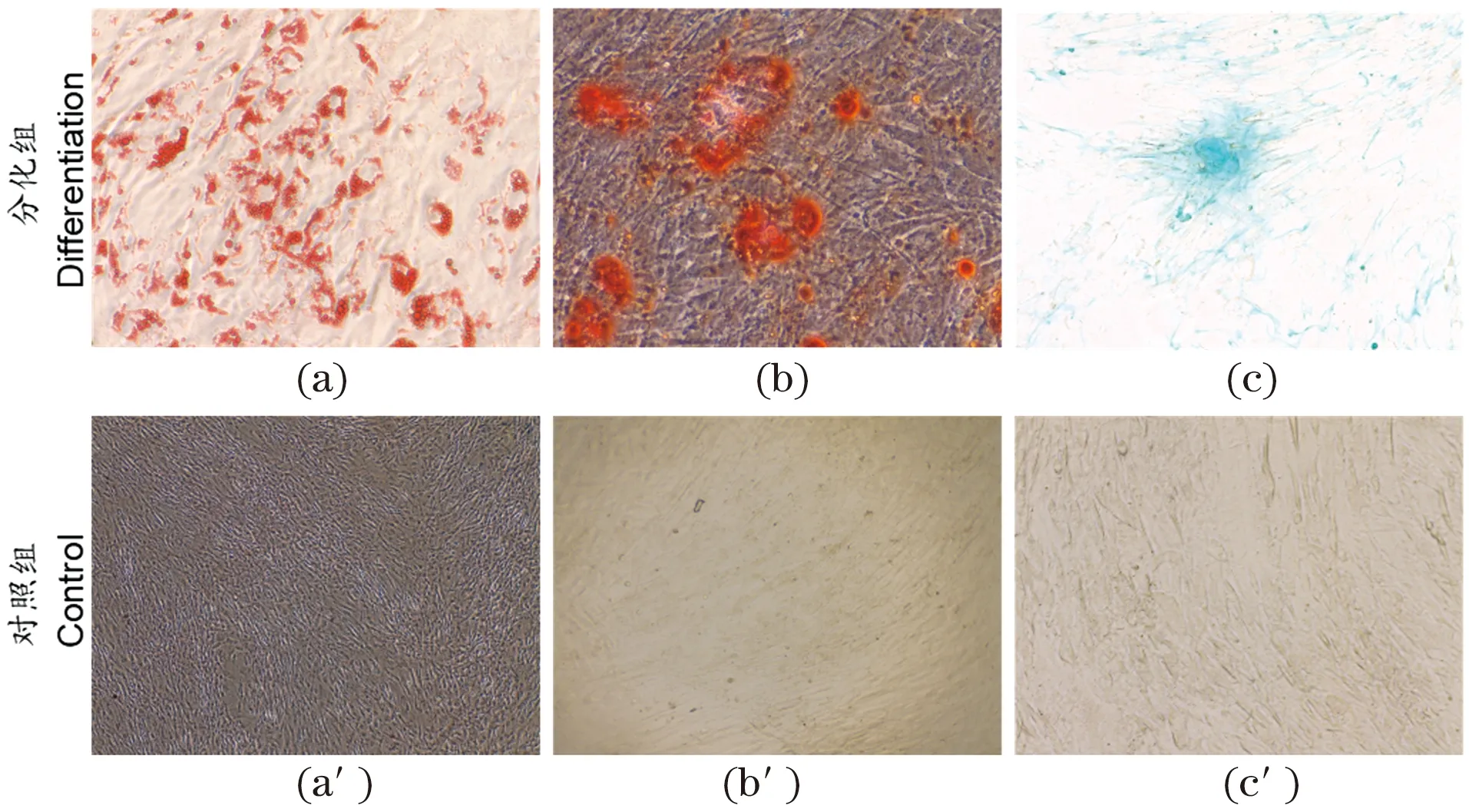
(a)成脂分化组;(a′):成脂分化对照组。(b)成骨分化组;(b′)成骨分化对照组。(c):成软骨分化组;(c′)成软骨分化对照组。图2 组织染色鉴定多向分化潜能Figure 2 Immunostaining identified the multipotent differentiation potential
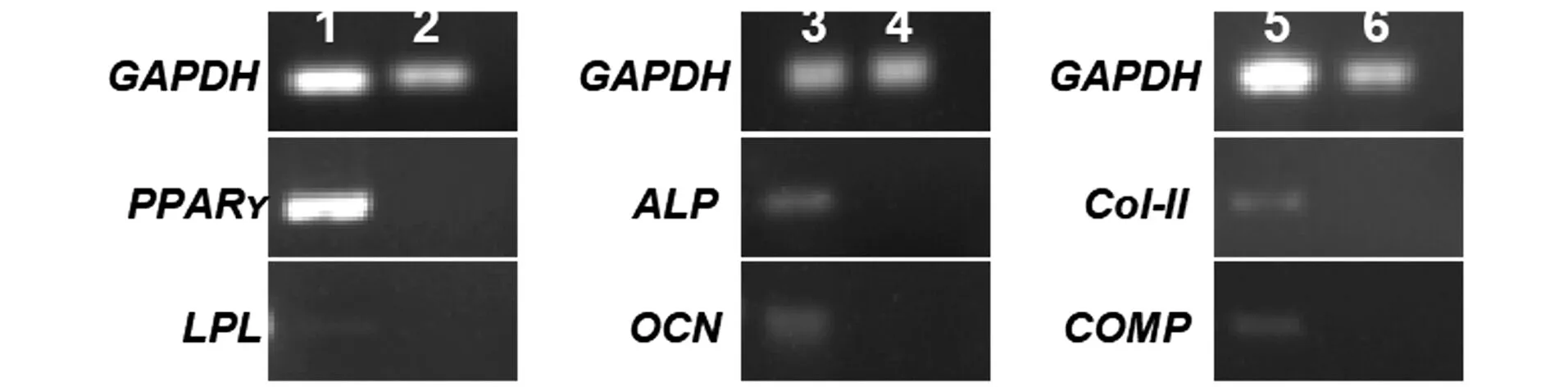
1:成脂分化组;2:成脂分化对照组;3:成骨分化组;4:成骨分化对照组;5:成软骨分化组;6:成软骨分化对照组。图3 RT-PCR鉴定多向分化潜能Figure 3 RT-PCR identified the multipotent differentiation potential
3 讨论与结论
hUCMSCs作为一种较原始的多能干细胞,其多向分化能力和可塑性已得到广泛证实,在组织工程和细胞替代治疗方面具有可观前景。已有研究表明,脐带组织中,每厘米含有4×105个干细胞,数量远高于骨髓[11],而且脐带组织容易获得、生长能力更强,多潜能特性能在体外保留更长时间[12],是干细胞研究的重要来源。
研究对脐带组织中的MSCs进行分离培养,目前常用的方法有酶消化法和组织块贴壁法,采用酶消化法所用时间虽短但获得的细胞纯度不高,且酶对细胞质量影响大,而组织块贴壁法虽需要较长时间,但更有利于保持细胞的活性。鉴于此,采用组织块贴壁法进行原代培养,14 d可见组织块的周围长出大量细胞,原代培养周期与其他研究相近[13],甚至短于另外一些文献的报道[14],可能与局部的细胞生长较快有关。hUCMSCs具有间质、内皮和上皮细胞的特点,不表达造血干细胞的标志物,结果表明获得的细胞低表达CD34和CD45,排除了它是造血细胞的可能,但高表达CD44和CD105,与相关文献报道的hUCMSCs标志物一致[15-16]。值得注意的是,获得的细胞高表达胚胎干细胞标记物Oct4和Nanog,但不表达Sox2,与课题组前期在脂肪间充质干细胞的发现类似[17]。可能是由于Sox2在体外主要表达在未分化的胚胎干细胞和胚胎癌细胞中,虽然hUCMSCs具有干细胞的特性,但可能随着传代逐渐分化,提示在传代培养hUCMSCs过程中,需要添加额外的细胞生长因子以维持其活性不发生变化。
MSCs具有的多向分化潜能特性一直被认为是其最大的应用价值,加上它较低的免疫原性、安全性更高的特点,使其成为组织工程的优良种子,因此,对MSCs进行诱导分化的研究具有重要的意义。成脂诱导3 d,胞质中开始有高折光性的小脂滴出现,标志着脂质开始积累,分化诱导10 d,高表达成脂分化的关键转录因子PPARY,而脂蛋白脂酶(LPL)只有微弱表达,表明hUCMSCs在分化液的诱导作用下可高度转变为脂肪细胞,但仅表现出轻微的脂肪细胞的分泌特性。成骨诱导18 d,组织染色可见明显的钙结节形成,同时表达了骨再生早期和后期的代表性因子ALP和OCN,提示其向成骨细胞进行了分化。成软骨诱导21 d,细胞产生软骨基质,并表达CoI-II和COMP。综上,证实了hUCMSCs具有成脂成骨成软骨的分化特性,与相关文献报道一致[4,18-19]。
通过组织块贴壁的方法,在第14天获得大量来自脐带组织的细胞,经鉴定其表达间充质干细胞标志物CD44和CD105,不表达造血细胞标志物CD34和CD45,表达多能性相关基因Oct4和Nanog,并具有成脂、成骨、成软骨的分化潜能,表明获得的细胞具有干细胞的生物学特性,属脐带组织间充质干细胞。研究为体外建立高效稳定的脐带组织间充质干细胞及临床移植治疗相关疾病提供实验基础。
