CRISPR/Cas9构建斑马鱼igf2bp3突变体及后代雌雄性别分析
2021-10-25徐伟伟陈良标
徐伟伟,陈良标
(1.中国科学技术部 海洋生物科学国际联合研究中心(上海海洋大学),上海 201306;2.水产种质资源发掘与利用教育部重点实验室(上海海洋大学),上海 201306;3.水产科学国家级实验教学示范中心(上海海洋大学),上海 201306)
胰岛素样生长因子2 mRNA结合蛋白3(IGF2BP3)是胰岛素样生长因子2 mRNA结合蛋白家族成员之一,之所以被称为IGF2BP是因为它们起初被认为是胎儿生长因子IGF2的转录后调节因子[1]。IGF2BP3通过结合目标mRNA编码区调节mRNA的转录和翻译,在细胞极化、运动、形态发生、新陈代谢、增殖及分化等过程中发挥重要作用。IGF2BP3由2个N端RNA识别基序(RRM)和4个C端K同源(KH)结构域构成[2]。
IGF2BP3也称为IMP3,1997年在筛选人胰腺癌组织和细胞系的差异表达基因时,因大量表达被发现,并命名为koc;但14周胎儿胰腺组织中koc却呈现低表达量[3]。IMP3在小鼠胚胎发育中存在明显的时间表达差异,胚胎早期发育阶段该基因均有表达;在妊娠晚期,该基因最高表达出现在肠、胸腺、胰腺、肾脏和发育中的大脑;在妊娠后期,表达仅限于肠和胸腺深部;在出生后第2天,肠上皮细胞中不再检测到该基因的表达[4]。这些结果暗示IGF2BP3可能和胚胎发育有关,但是仍无法证明。非洲爪蟾vg1 RBP是人IGF2BP3的直系同源物,vg1 mRNA存在于卵母细胞植物极皮质区域[5],该蛋白介导vg1 RNA和微管的结合[6-7]。同时非洲爪蟾vg1 RBP和人的IGF2BP3氨基酸序列相似性可达84%[8]。现有研究表明,vg1 RBP在非洲爪蟾中可以调控器官发生、神经发育、IGF2 mRNA翻译以及卵母细胞减数分裂过程。IGF2BP3在人类和小鼠的胎盘和生殖器官中高表达,意味着IGF2BP3可能和生物体早期发育和性腺发育有关。
2011年CRISPR/Cas9技术被发明[9],即核酸酶在RNA的引导下在设定的目标位置进行DNA的修饰。CRISPR/Cas9系统的结构主要由3部分组成:crispr RNA、tracr RNA和一个核酸酶Cas。Cas9蛋白可以用来切割DNA,crispr RNA和tracr RNA组成的一个复合体向导RNA(guide RNA)含有与目的位点对应的RNA序列,可以用来确定切割修饰的位置。同时该DNA序列打开需要一个PAM(protospacer adjacent motif)序列[10],一般为NGG。由于可以设计guide RNA识别PAM序列之前的序列,CRISPR/Cas9系统是易于设计的基因组编辑工具。
斑马鱼igf2bp3基因在物种间高度保守,在小鼠组织中缺乏可用的敲除模型,该基因在组织中的功能仍然未知。因此,以斑马鱼为研究对象,通过CRISPR/Cas9技术构建igf2bp3基因缺失的斑马鱼突变体模型,以期为研究igf2bp3基因的功能提供基础,同时为决定斑马鱼性腺发育相关基因提供候选基因。
1 材料与方法
1.1 材料
1.1.1 斑马鱼品系及饲养
AB系野生型斑马鱼购自中国科学院遗传与发育生物学研究所,igf2bp3-/-突变体在此品系下构建。循环系统水温28.5 ℃,pH 7.0~8.0,光周期14 h(8∶30—21∶30)光照和10 h(21∶30—8∶30)黑暗。每日投喂2次活体丰年虾。
1.1.2 试剂及仪器
主要试剂包括聚合酶链式反应试剂PremixTaqTMVersion 2.0 plus dye (TaKaRa,RR901A),基因组编辑试剂GenCrispr NLS-Cas9-NLS (金斯瑞,Z03389-25);荧光定量反应试剂SYBR Green (Roche,04887352001)。主要试剂盒包括海洋动物组织基因组DNA提取试剂盒(TIANGEN,DP324-03);普通DNA产物纯化试剂盒(TIANGEN,DP204-02);体外转录试剂盒MAXIscriptt©T7invitroTranscription Kit(Thermo Fisher Scientific,AM1314);反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa,RR047A)。主要仪器包括PCR核酸扩增仪(BIO-RAD公司);InjectMan NI2显微注射仪(Eppendorf公司);实时荧光定量PCR仪(Roche公司)。
1.2 方法
1.2.1 CRISPR/Cas9系统靶点和引物设计
通过斑马鱼基因组网站Ensembl (https:∥asia.ensembl.org/index.html)查找斑马鱼igf2bp3基因(ENSDARG00000010266)序列。使用靶点预测网站ZiFiT (http:∥zifit.partners.org/ZiFiT/)获得两个gRNA靶点序列,Target 6序列为5′-GGGCTGCCTCTCTGCAACA-3′,Target 8序列为5′-GGGTTTTTGTAATACATCTG-3′。两个靶点通过BLAST比对均在斑马鱼基因组中特异。在NCBI上设计靶点6和靶点8检测引物,由生工生物工程(上海)股份有限公司合成,检测引物和靶点合成序列如表1所示。

表1 靶点和引物序列Table 1 Sequences of target and primer
1.2.2 gRNA合成与纯化
通过PCR扩增技术,以pMD19-gRNA scaffold质粒为模板,含有T7启动子、靶点、骨架的序列为上游引物T7-target-sfd,固定序列为下游引物tracr rev (表1),按照PCR反应程序94 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃再延伸10 min,扩增用于gRNA转录的DNA模板。扩增的PCR产物大小约100 bp,回收纯化,使用MAXIscriptt©T7invitroTranscription Kit进行体外转录。利用3 mol/L醋酸钠沉淀纯化gRNA。2%琼脂糖凝胶电泳检测目的条带大小。制备好的gRNA保存于-80 ℃备用。
1.2.3 胚胎显微注射
于注射前一晚将野生型成年斑马鱼按雌、雄比例为1∶1或1∶2放置在配鱼缸中,隔板分开,暗处理10 h注射当天早晨,抽去隔板,雌雄鱼开始交配,一般10 min左右亲鱼即可产生受精卵。按照cas9蛋白质浓度为800 ng/μL,gRNA浓度为100 ng/μL配制注射体系,显微注射至野生型斑马鱼一细胞期的胚胎,每枚胚胎注射体积为1 nL。并留有同期未注射胚胎为对照。
1.2.4 突变体筛选
注射后胚胎置于28.5 ℃恒温培养箱,随机挑选注射组和对照组各20枚发育48 h的胚胎放于2个PCR管中,加入50 μL 50 mmol/L的NaOH,95 ℃裂解10 min,涡旋振荡1 min,重复裂解振荡,加入5 μL 1 mol/L Tris-HCl溶液(pH 8.0),振荡混匀,12 000 r/min离心5 min,上清液为基因组DNA。以靶点6的上游检测引物igf2bp3-6C-F和靶点8的下游检测引物igf2bp3-8C-R (表1),扩增该区域DNA序列,通过琼脂糖凝胶电泳判断靶点敲除是否有效。若靶点敲除有效,剩下的胚胎饲养至性成熟即F0,与野生型斑马鱼交配得到F1,剪取F1代尾鳍使用海洋动物组织基因组DNA提取试剂盒提取基因组,PCR扩增、Sanger测序筛选有效突变;选取突变类型一致的F1个体内交获得F2,通过PCR扩增和Sanger测序筛选F2纯合突变体。
1.2.5 qRT-PCR检测igf2bp3表达量
使用Trizol法提取RNA,以igf2bp3基因序列设计引物进行荧光定量,同时以斑马鱼β-actin为内参,每个样品进行3次重复实验,引物序列见表2。用2-△△ct方法计算斑马鱼不同组织中igf2bp3基因的相对表达量。
表2 qRT-PCR引物序列Table 2 Sequences used for qRT-PCR
2 结果与分析
2.1 Igf2bp3蛋白序列在物种间高度保守
斑马鱼igf2bp3基因位于19号染色体,编码582个氨基酸,包括2个N端RNA识别基序(RRM)和4个C端K同源(KH)结构域[图1(a)]。对斑马鱼和智人(Homosapiens)、小鼠(Musmusculus)、非洲爪蟾(Xenopuslaevis)该蛋白的氨基酸序列进行比较分析[图1(b)],结果表明,Igf2bp3在不同物种间保守性良好,斑马鱼序列与智人和小鼠的相似性分别为78%和77%,与两栖类的非洲爪蟾序列相似性为79%,提示igf2bp3可能在不同物种间发挥相似的生物学功能。

图1 不同物种的Igf2bp3功能域比较Figure 1 Comparison of Igf2bp3 functional domains among different species
2.2 igf2bp3在斑马鱼生殖腺中高表达
为了评估igf2bp3基因在斑马鱼不同组织中的表达量,使用Trizol法提取90 d野生型斑马鱼生殖腺(卵巢和精巢)、脑、鳃、眼睛、心脏、肾、脾、肠、肝脏、肌肉、等不同组织的RNA反转录后进行定量PCR。结果表明,igf2bp3基因在野生型成年斑马鱼不同组织中均有表达,在雌鱼中表达量最高的组织为卵巢,在雄鱼中表达量最高的组织为精巢(图2),暗示igf2bp3基因可能在斑马鱼性别发育中发挥作用。
2.3 利用CRISPR/Cas9构建igf2bp3突变体
为了破坏基因结构,抑制其功能的发挥,通过显微注射靶点6和靶点8体外转录合成的gRNA以及Cas9蛋白至野生型斑马鱼一细胞期的胚胎,对斑马鱼igf2bp3基因进行大片段敲除[图3(a)]。胚胎发育至48 h,随机挑选注射组和对照组各20枚通过碱裂解法提取基因组DNA,以靶点6的上游引物和靶点8的下游引物扩增该区域的DNA序列,该引物扩增序列全长1 949 bp,由于CRISPR/Cas9体系工作,两靶点之间发生碱基缺失,通过1%琼脂糖凝胶电泳检测,得到一条约460 bp的条带,即靶点6至上游引物的距离加上靶点8至下游引物的距离[图3(b)]。同时分别用靶点6和靶点8检测引物对PCR产物进行测序;结果显示在靶位点附近出现明显套峰,证明基因编辑有效[图3(c)]。胚胎饲养至性成熟,剪取斑马鱼尾鳍,筛选F0斑马鱼嵌合体共7尾,通过与野生型斑马鱼交配获得F1斑马鱼杂合突变体。
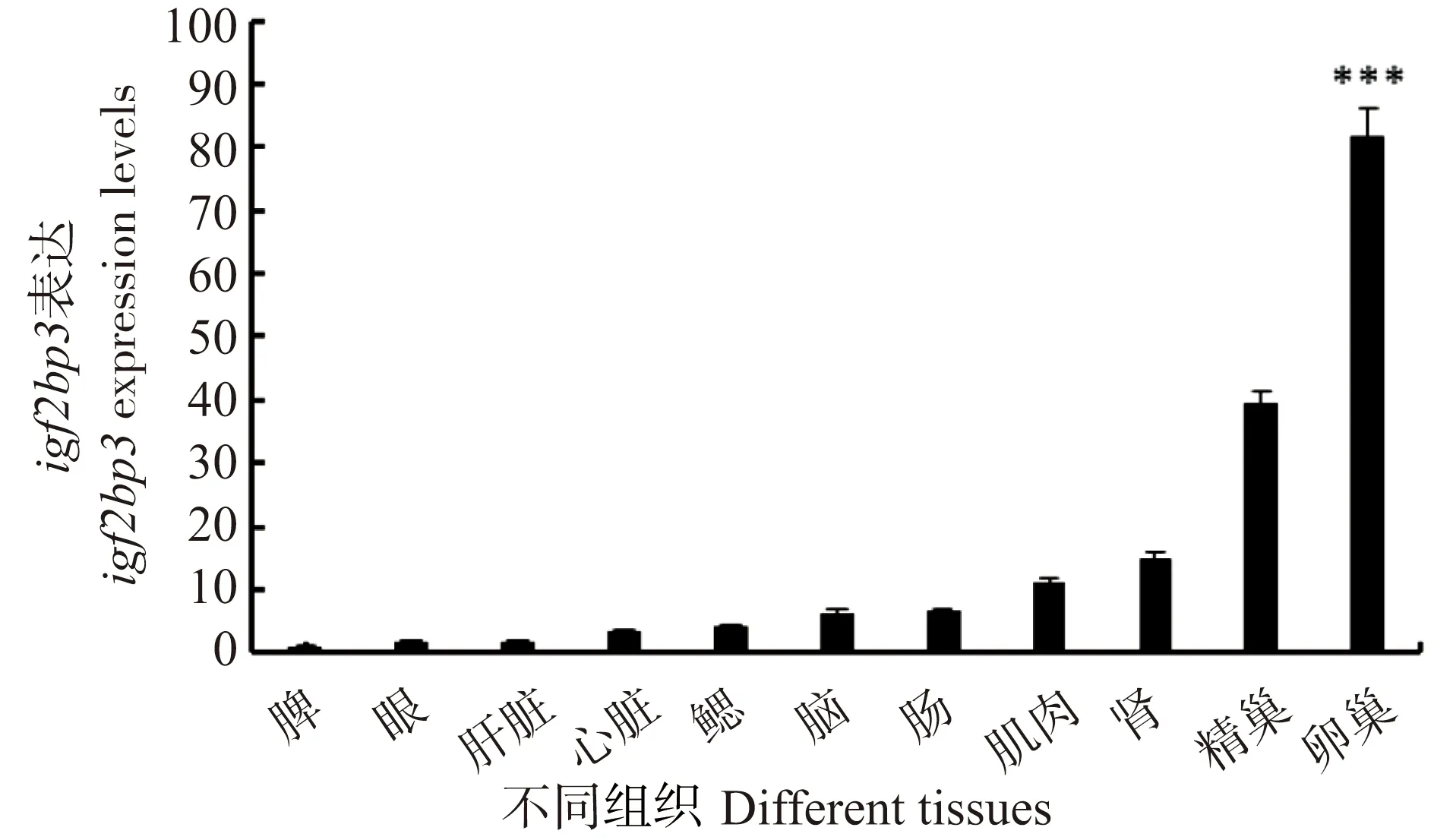
* * * 为P<0.001。图2 igf2bp3基因在野生型斑马鱼不同组织中的表达量Figure 2 The levels of igf2bp3 in different tissues of wild zebrafish
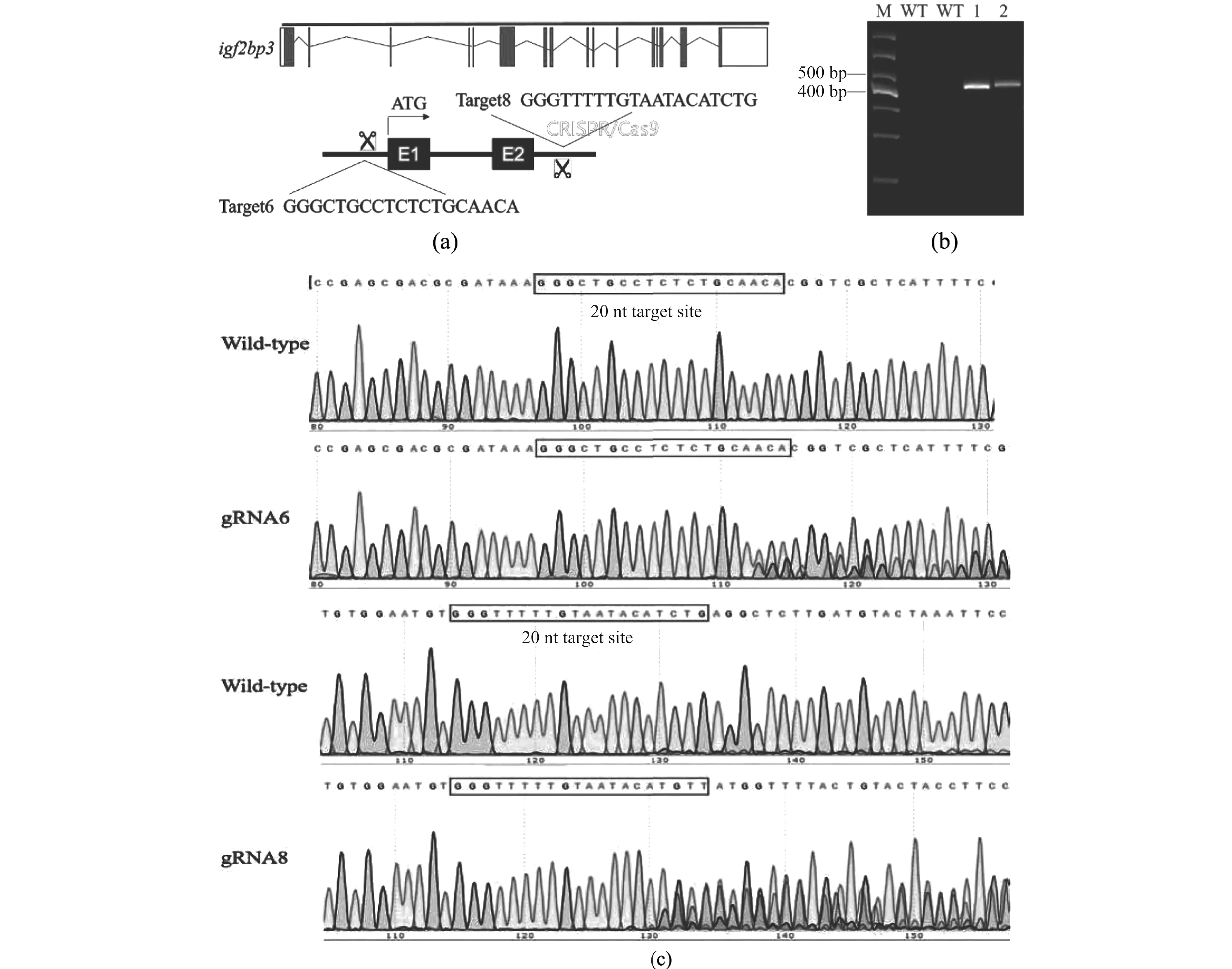
* * * 为P<0.001。图3 利用CRISPR/Cas9技术敲除斑马鱼igf2bp3基因Figure 3 Knocking out igf2bp3 gene in zebrafish using the CRISPR/Cas9 technology
2.4 igf2bp3影响斑马鱼性别发育
对F1杂合子斑马鱼通过剪尾筛选,将突变类型一致的,即缺失1 513个碱基的杂合子斑马鱼内交[图4(a)],获得F2斑马鱼。对F2通过Sanger测序法进行鉴定,序列比对结果表明,成功构建igf2bp3(Δ1 513)突变体。F2斑马鱼包括突变纯合子(homozygote)、杂合子(heterozygote)和野生型(wild type)3种类型。为了对F2突变体快速筛选,以靶点6上游引物和靶点8下游引物进行PCR扩增,扩增结果无条带对应的个体即为野生型;若扩增得到461 bp条带,则进一步以靶点6和靶点8两对检测引物扩增该基因组,无条带对应的个体即为突变纯合子;若有467 bp和458 bp的电泳条带产生,对应的个体即为杂合子[图4(b)]。
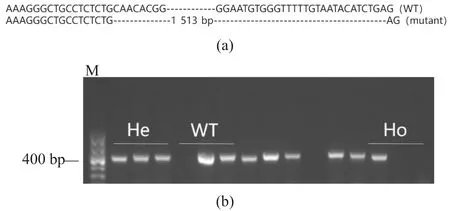
图4 F2代斑马鱼基因型鉴定Figure 4 Genotype identification of zebrafish F2 generation
对F2斑马鱼纯合子、杂合子、野生型数目进行统计,比例约为1∶2∶1,符合孟德尔单基因隐形遗传定律。斑马鱼纯合突变体胚胎发育无异常且可正常生长,但对F2成年斑马鱼性别比例进一步统计发现,野生型斑马鱼雌雄鱼比例约为27∶20,接近1.4,而纯合子突变体中雌雄鱼比例约为2∶21,甚至低于0.1(图5)。

* * * 为P<0.001。图5 斑马鱼的性别比例Figure 5 Sex ratio of zebrafish
3 讨论与结论
CRISPR/Cas9基因编辑技术,是由向导RNA引导Cas核酸酶至DNA特定位点上产生双链断裂,进而通过NHEJ或HDR[11-12]来修复,而单个靶点导致的脱靶突变仍然是CRIPSR /Cas9系统在基因组编辑中所面临的一个重大问题。因此实验通过使用两个特异性强的向导RNA,对斑马鱼igf2bp3基因进行编辑,提高了CRIPSR /Cas9的效率并且减少了由于脱靶引起的突变。
目前主要有3个信号通路参与斑马鱼的性别分化过程、Tp53凋亡通路、Wnt信号通路以及NF-κB通路。斑马鱼精巢的形成被认为依赖于“类卵巢”[13-14]卵母细胞的凋亡。激活的核因子活化B细胞κ轻链增强子(NF-κB)维持斑马鱼卵母细胞的发育,参与斑马鱼细胞生长、分化和凋亡的调节。活化NF-κB通路可以促使斑马鱼雌性的比例从30%上升到85%[15]。已有研究表明p65是NF-κB异二聚体转录因子复合物的成员,作为IGF2BP3的靶标[16]。在本研究中,敲除斑马鱼敲除igf2bp3后,抑制了p65的翻译,使NF-κB的活性受到了抑制,可能加快了“类卵巢”中卵母细胞的凋亡,最终发育形成精巢,使雄鱼明显增多。
实验利用CRISPR/Cas9基因编辑技术对斑马鱼igf2bp3基因进行大片段敲除,成功构建了缺失1 513 bp且稳定遗传的斑马鱼突变体。野生型成年斑马鱼igf2bp3基因在不同组织中均有表达,但在生殖腺中表达量最高。通过性别比例统计发现igf2bp3基因敲除的纯合突变体中雌雄鱼比例严重失调,表现出更多的雄性,暗示该基因在斑马鱼性别发育中发挥功能,研究结果为进一步研究斑马鱼性别决定机制提供基础。
