CRISPR/Cas9技术敲除hbae1.1基因对斑马鱼血红蛋白生成的影响
2021-10-25陈良标
孟 琳,陈良标
(1.海洋生物科学国际联合研究中心(上海海洋大学)中国科学技术部,上海201306;2.水产种质资源发掘与利用教育部重点实验室(上海海洋大学),上海201306;3.水产科学国家级实验教学示范中心(上海海洋大学),上海201306)
血红蛋白是一种由多肽链或4个附属单元组成的大分子蛋白质,在某些低等动物中以游离状态存在,在人类中存在于红细胞中,是血液不可缺少的成分,最重要的功能是将氧气运送到全身各处[1-2]。血红蛋白异常会引起多种血红蛋白分子病,如镰形细胞贫血症和地中海贫血症等[3-4],且糖化血红蛋白与糖尿病和心血管疾病有密切关系[5-6]。血红蛋白水平下降会造成生物体心力衰竭,严重损坏机体[7]。但是经过研究发现,南极水域中的一种生物体-冰鱼Chionodracohamatus体内完全不含有血红蛋白,只靠鳃和皮肤吸收水中的溶解氧,却可以在水中正常生活[8-10]。这种自然突变体生物的存在,为实验室构建血红蛋白缺失突变体提供了可行性。
与ZFN和TALEN基因编辑手段相比,CRISPR/Cas9基因编辑系统更高效[11-12],几乎可以准确编辑基因组中任何一个位点,被广泛应用于动植物等模式生物中[13-15]。斑马鱼(Daniorerio)是一种常见的小型淡水鱼,具有许多得天独厚的优点:如体积小,便于饲养;进行体外受精,易于得到受精卵;产卵多,一次可多达几百颗;受精卵透明度清晰可见,便于观察发育情况;达到性成熟时间短等,是一种适合研究基因功能的理想模式生物[16-17]。
目前NCBI上有14个已知的斑马鱼血红蛋白基因,可分为α亚型和β亚型两种类型,分布在3号和12号染色体上,这些基因有些调控斑马鱼胚胎期血红蛋白的生成,有些调控斑马鱼成熟期血红蛋白的生成。hbae1.1基因(GenBank号:NM_182940)是斑马鱼血红蛋白基因家族中的一员,是血红蛋白α链上的一个基因,且是位于3号染色体上的第一个调控胚胎期血红蛋白的生成,在血红蛋白基因家族中居于重要位置。此外,将斑马鱼的hbae1.1所编码的蛋白进行同源性分析,发现斑马鱼的hbae1.1蛋白与人HBA1蛋白两者之间具有同源性,而HBA1基因突变在人类中会引起多种异常血红蛋白病和α地中海贫血症。然而关于hbae1.1基因在斑马鱼中的具体功能和作用尚无研究报道,hbae1.1基因本身缺失造成的影响也未见报道。本研究利用CRISPR/Cas9技术敲除hbae1.1基因,研究hbae1.1基因对斑马鱼血红蛋白生成的影响,以期为研究鱼类血红蛋白的发生发育提供一定基础,同时也为与血红蛋白相关的人类疾病的探究提供一定的研究基础。
1 材料与方法
1.1 材料
1.1.1 斑马鱼
AB品系野生斑马鱼购自中科院遗传与发育生物学研究所,斑马鱼饲养环境均相同,养殖在上海海圣循环系统中,本实验室斑马鱼房饲养环境非常适宜斑马鱼的生长和繁殖。
1.1.2 主要试剂
PremixTaq酶(RR901)购自TaKaRa公司;gRNA体外转录试剂盒MAXIscriptTMT7 invitroTranscription Kit (AM1314 )购自Ambion公司;Cas9蛋白GenCrispr NLS-Cas9-NLS Nuclease(Z03389-100)购自金斯瑞公司;T7E1内切酶T7 Endonuclease I(M0302S)购自NEB公司;DNA产物纯化试剂盒TIANquick Midi Purification Kit(DP204-02)和基因组DNA提取试剂盒TIANamp Genomic DNA kit(DP304-03)购自天根公司;o-Dianisidine粉末购自Sigma公司;4% PFA购自Lab Top公司。
1.1.3 主要仪器
Eppendorf显微注射仪和ZEISS高端立体显微镜购自德国;常规PCR仪、电泳仪和凝胶成像系统购自Bio-Rad公司。
1.2 方法
1.2.1 敲除靶点及检测引物的设计
从Ensembl(http://asia.ensembl.org/index.html)网站上查找到hbae1.1基因序列,在ZiFiT(http://zifit.partners.org/ZiFiT/)网站上设计敲除的靶点,并将靶点在http://asia.ensembl.org/Danio_rerio /Tools /Blast?db =core网站上进行blast,检测靶点的特异性。设计的靶点位于反义链上,靶点名称是T-hbae1.1,靶点序列是GGAAAGCATGGAGCTCACTG。
根据靶点的位置,设计检测引物,由于利用T7E1酶(一种可以识别并切割错配DNA Holliday结构的酶)检测突变体,故设计引物有以下几个原则:(1)正反向引物各自距靶点位置不少于100 bp,且正反向引物距靶点的距离差距不少于50 bp;(2)PCR扩增片段要适中,大小为300~500 bp;(3)PCR条带要单一,无杂带。在NCBI网站上设计出检测引物,并在生工公司进行合成,引物序列见表1。

表1 引物序列Table 1 Primer sequence of hbae1.1
1.2.2 体外转录gRNA
gRNA模板的制备:用PremixTaq酶进行PCR扩增,反应条件为94 ℃预变性3 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共34个循环;72 ℃再延伸5 min;4 ℃,∞。再用DNA产物纯化试剂盒纯化PCR产物。纯化后的gRNA模板按照体外转录试剂盒步骤体外转录成RNA,并用氯化锂沉淀法纯化RNA。纯化后的RNA用NanoDrop测定浓度,凝胶电泳检测质量及大小,并保存在-80 ℃备用。
1.2.3 显微注射敲除的检测
gRNA和cas9蛋白按照100 ng/μL∶800 ng/μL的比例混合制成混合液,将混合液注射到斑马鱼受精卵一细胞期的动物极,注射量为1 nL。受精卵注射后,放在28 ℃培养箱中进行培养。随机取多条注射72 h后的小鱼于EP管中,每条小鱼置一个EP管,用基因组DNA提取试剂盒提取小鱼的DNA,并用表1中的检测引物进行PCR,反应体系为PremixTaq酶,12.5 μL;hbae1.1-F,0.7 μL;hbae1.1-R,0.7 μL;DNA,1.5 μL;ddH2O,9.6 μL。反应条件为95 ℃预变性3 min;95 ℃变性45 s,68 ℃退火30 s,72 ℃延伸1 min,共34个循环;72 ℃再延伸10 min;4 ℃,∞。PCR产物用T7E1酶进行酶切,将成功酶切出条带的PCR产物送到生工公司测序,若敲除成功,峰图会从靶点位置出现套峰。
1.2.4 可遗传的F0代斑马鱼的检测
将敲除成功的小鱼养至成鱼即为F0代,同时留一部分同一批未注射的WT受精卵作为对照组,与F0代小鱼一起饲养。性成熟的成鱼F0代与对照组WT交配,所产受精卵培养48 h后,每10颗卵为一管,提取其基因组DNA,并进行测序,检测F0代斑马鱼是否可将突变成功遗传至后代,若F0代能够遗传,并将有突变的F1受精卵饲养起来。
1.2.5 F1代杂合子的筛选
F1饲养2个月,通过剪尾提取DNA,PCR反应体系和反应条件同1.2.3,PCR产物送测,确定F1代的突变类型。并大量筛选F1代斑马鱼,筛选出具有相同突变类型的雌雄斑马鱼。
1.2.6 F2代纯合子的筛选
将相同突变类型的性成熟的成鱼F1代进行内交,将所产胚胎进行培养,并在孵化期间,每隔2 h观察F2代胚胎的发育情况,查看是否有异常死亡。所产后代饲养2个月,提取基因组DNA,T7E1酶切PCR产物,未酶切出条带的个体为WT或纯合子,再通过测序及序列比对,筛选出F2代纯合子。
1.2.7 固蓝(o-Dianisidine)染色
血红蛋白有类似过氧化物酶的活性,可以催化过氧化氢释放出氧,使o-Dianisidine发生颜色变化,最终呈现出铁锈色的颜色,从而观察斑马鱼胚胎血红蛋白的合成情况。其具体实验步骤如下:(1)将纯合子雌雄鱼和WT雌雄鱼分别进行交配,同时产卵,收集各自所产受精卵置于不同培养皿中,并放在28 ℃培养箱中培养。培养48 h后,进行o-Dianisidine染色,观察胚胎血红蛋白的合成情况。(2)配置o-Dianisidine染液:全程避光,现用现配。取6 mgo-Dianisidine粉末置于1 mL ddH2O中,配成浓度为6 mg/mL的o-Dianisidine溶液,取60 μL现配的o-Dianisidine溶液置于新的EP管中,加入质量分数为30%的双氧水13 μL,pH 4.5、3 mol/L的醋酸钠2 μL,无水乙醇240 μL,再加入ddH2O定容到600 μL,配置成o-Dianisidine染液。(3)分别收集纯合子和WT胚胎置于EP管中,向EP管中加入600 μL固蓝染液,放在摇床上避光染色15 min,去除染液,PBST漂洗3次,每次3 min。(4)向EP管中加入质量分数为4%的PFA固定6 h,去除4% PFA,PBST漂洗3次,每次3 min。(5)显微镜观察染色情况并拍照。
2 结果与分析
2.1 靶点gRNA的鉴定
将靶点设计在hbae1.1基因的2号外显子上(图1),并将靶点gRNA进行体外转录,体外转录后的浓度用NanoDrop测定为960 ng/μL,质量分数为2%的琼脂糖凝胶电泳结果显示(图2),条带大小为136 bp,条带大小正确,且质量良好、无降解,成功制备出gRNA。

图1 gRNA在hbae1.1基因上的位置Figure 1 The location of gRNA on hbae1.1 gene

图2 gRNA体外转录电泳图Figure 2 In vitro transcription electrophoresis of gRNA
2.2 F0代基因敲除的检测
为了检测敲除情况,用T7E1酶进行酶切,酶切结果显示:T7E1酶共酶切13个PCR产物,其中WT为2个,其余注射的PCR产物为1~11号,注射的11条小鱼中,有9条被酶切出2条带,其片段大小分别为289 bp和168 bp,而WT未被酶切出条带,只有一条目的条带,说明敲除靶点有效,且敲除效率很高。将切除条带的PCR产物送测,测序峰图显示靶点位置及以后全部出现套峰,表明敲除hbae1.1基因成功(图3)。

图3 F0基因敲除T7E1酶切结果和测序峰图Figure 3 T7E1 assay and sequencing analysis of F0 knock-out after injection
2.3 F1代杂合子的筛选
将F0代与WT进行交配,所产后代通过测序,筛选出突变类型为-11 bp和-4 bp两种类型的F1代杂合子。从图4可以看出,2种突变体类型均发生移码突变,所编码的氨基酸序列发生改变。
2.4 F2代纯合子的筛选
F1代杂合子内交,所产F2代胚胎通过观察,与WT斑马鱼发育相比,无明显异常。通过测序,成功筛选出-11 bp和-4 bp的F2代纯合子(图5)。

图5 2种突变类型的纯合子的筛选Figure 5 Screening of homozygotes of two mutation types
2.5 固蓝染色
同时对48 h后的纯合子和WT胚胎进行固蓝染色,结果显示:与野生型斑马鱼WT相比,hbae1.1基因缺失的纯合子突变体的血红蛋白含量明显减少。表明hbae1.1基因的缺失会影响斑马鱼血红蛋白的生成(图6)。
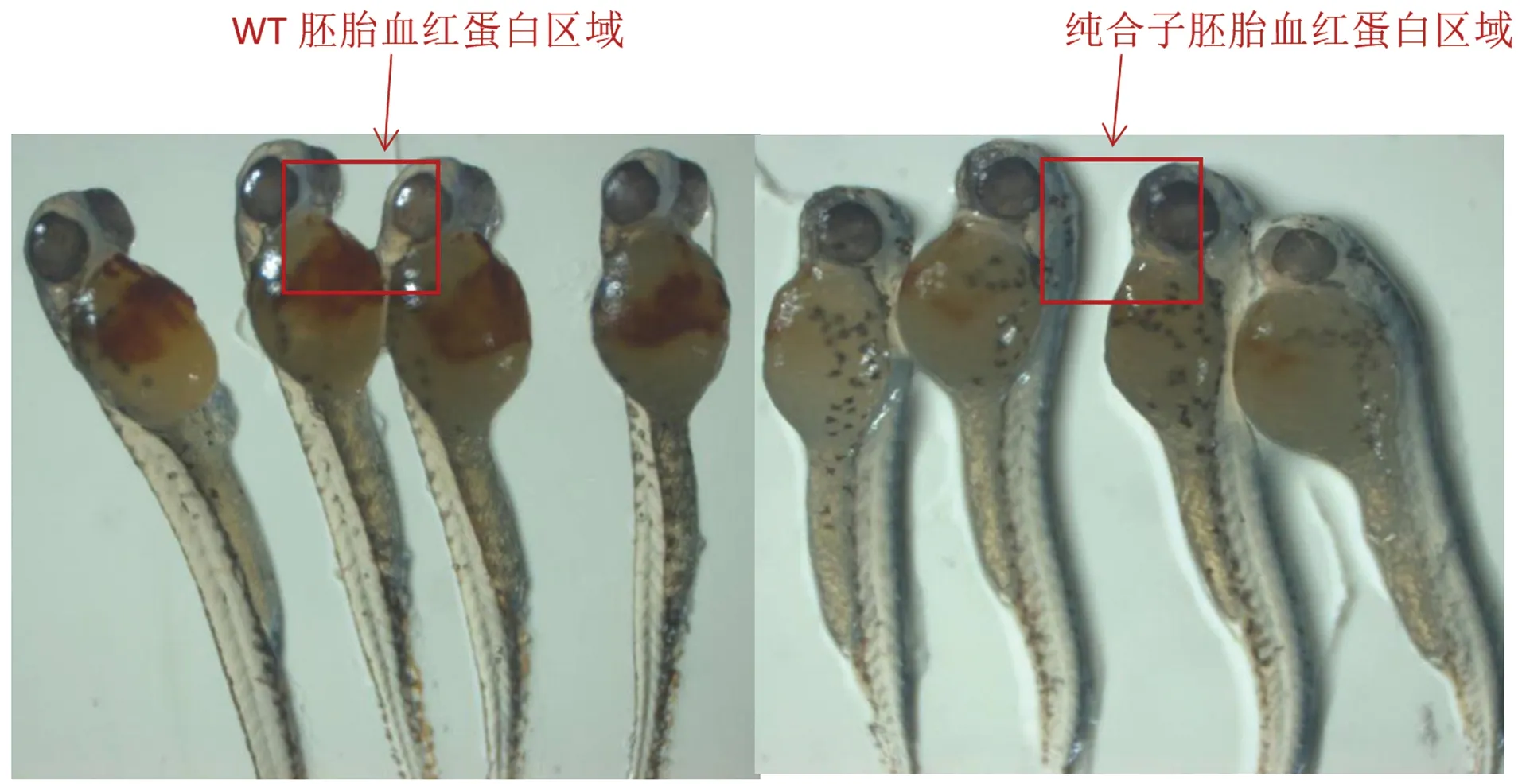
图6 固蓝染色结果Figure 6 Result of o-Dianisidine
3 讨论
血红蛋白在人类和大部分脊椎动物中起着多种功能,不仅有储存氧气,并将氧气从肺、鳃或其他呼吸器官运送到需要氧气进行高效新陈代谢的周围组织的功能,而且有维持血液酸碱稳定的功能[18-20]。此外,还有使血管扩张、维持血压以及抗菌等功能。所以人类和大部分脊椎动物缺失血红蛋白会无法正常呼吸进而导致死亡,但是完全无血红蛋白的冰鱼却依然能够呼吸,正常生存,因此,冰鱼可作为人类相关血液疾病的自然突变模型[21]。
斑马鱼和人类同为脊椎动物,两者之间血红蛋白具有同源性,利用同源性的特点,通过构建斑马鱼血红蛋白基因缺失的突变体模型,获得相应病理学知识,为人类血液疾病的治疗及预防提供有价值的参考[22]。研究利用CRISPR/Cas9基因编辑技术,通过显微注射技术注射Cas9蛋白-gRNA的混合物,同时同一批未注射的WT受精卵作为对照,敲除斑马鱼血红蛋白基因hbae1.1,且通过筛选成功得到F2代纯合突变体,成功建立了hbae1.1基因缺失的斑马鱼突变体模型。并通过固蓝染色表明,与WT相比,hbae1.1基因缺失的纯合突变体的血红蛋白含量明显下降,证明了hbae1.1基因的缺失会对斑马鱼血红蛋白的生成有明显的影响。
研究利用的CRISPR/Cas9系统是从产脓链球菌的免疫防御系统改造得到的,该系统以构建简单,成本低廉,效率高效等明显的优势脱颖而出,成为目前应用广泛的基因编辑技术[23]。斑马鱼的基因组已经被全部测序出来,且基因组与人类基因组高度同源,同源性大于70%[24]。所以本研究利用CRISPR/Cas9技术构建斑马鱼hbae1.1基因缺失的突变体的可行性被大幅度提高。
4 结论
研究成功获得了hbae1.1基因缺失的F2代纯合子,并通过固蓝染色结果,表明hbae1.1基因的缺失会严重影响到斑马鱼血红蛋白的生成,也说明hbae1.1基因在斑马鱼血红蛋白基因家族中有重要作用,为研究鱼类血红蛋白的发生发育提供一定基础,同时也为与血红蛋白基因突变所引起的人类疾病探究提供一定的研究基础。
