不同碳源细胞自噬对巴斯德毕赤酵母生长代谢的调控
2021-10-25陆文怡战春君刘秀霞詹锦玲杨艳坤白仲虎
陆文怡,战春君,刘秀霞,詹锦玲,杨艳坤,白仲虎
(1.江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122,2.江南大学 生物工程学院,无锡 214122)
巴斯德毕赤酵母能够利用甲醇作为唯一碳源和能源生长。近年来,随着基因工程技术的进步和全基因组序列的公开,毕赤酵母凭借其广泛的真核蛋白修饰能力、目标蛋白易分泌、胞外杂蛋白少、易于高密度培养等特性,逐渐被开发成为外源蛋白表达最常用的宿主之一[1-4]。
以甲醇为唯一碳源时,毕赤酵母的醇氧化物酶Ⅰ(alcohol oxidase 1,AOX1)可高效表达[1],因此AOX1的启动子(AOX1 promoter,PAOX1)作为表达外源蛋白的强启动子被广泛应用。然而,当培养基中含有葡萄糖、甘油或乙醇等碳源时,PAOX1的活性会受到抑制[5]。战春君等[6]将毕赤酵母中的甘油转运体1(Glyceroltransporter1,GT1)敲除后获得突变株(P.pastorisΔGT1),可以缓解甘油对PAOX1的抑制,AOX1酶在甘油或甘油甲醇混合培养基中均可获得一定的组成型表达。因此P.pastorisΔGT1在工业生产中有着广泛的应用前景。用混合碳源培养毕赤酵母时发现,培养基中甲醇含量越高,PAOX1表达水平越高,但是细胞的生长状态会下降,使外源蛋白产量受到限制。所以明确甲醇对细胞生长的抑制作用的内在机理,对外源蛋白生产至关重要。
细胞的生长与细胞自噬有着密不可分的关系,当细胞遇到缺氧,缺营养,细胞器损伤,细胞内异常蛋白累积,某些微生物入侵,或接触某些化学物质时[7],细胞自噬通过降解细胞内组分,维持细胞内生理平衡帮助细胞度过逆境[8]。细胞的自噬有很多种,根据目的降解物的不同又可以分成选择性自噬和非选择性自噬[9]。发现当碳源发生改变的时候,巴斯德毕赤酵母中明显变化的是宏自噬与过氧化物酶体自噬。宏自噬是一种非选择性自噬,通过细胞内形成的双层膜结构的自噬体,非特异性地包裹损伤或者多余的细胞质和细胞器,并递送至液泡或溶酶体以分解和再循环[10]。而过氧化物酶体自噬是自噬体通过与受体ATG30结合,特异性地降解多余的过氧化物酶体的过程[11-12]。过氧化物酶体是巴斯德毕赤酵母中代谢甲醇或油酸必需的细胞器[13],当碳源改变,或者碳源利用率降低时,过氧化物酶体过剩,过氧化物酶体自噬上调,降解掉多余的过氧化物酶体。
本文通过检测毕赤酵母在甲醇和甘油中的菌体密度和碳源代谢速度,以及自噬相关基因对碳源变化的响应,研究碳源对毕赤酵母细胞生长代谢和自噬的影响。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂
荧光分光光度计(上海棱光技术有限公司),紫外分光光度计(上海棱光技术有限公司),PCR 仪(朗基科仪),电泳仪(北京六一仪器),凝胶成像仪(美国 Aplegen),电转仪(美国 BIO-RAD 公司),高通量破碎仪(Bertin Technologies),高效液相色谱仪(日本岛津公司),有机酸柱(Shim-pack SCR-101H,日本岛津公司),qRT-PCR仪(美国Applied biosystem),微量可见分光光度计(美国Quawell);DNA聚合酶、内切酶、DNA连接酶、卡那霉素、博来霉素、G418抗生素、qRT-PCR试剂盒(Takara),6×His标签抗体(Takara),发光底物(Thermo Fisher Scientific)。
1.1.2 菌株和质粒
以毕赤酵母Pichiapastoris及突变株PichiapastorisΔGT1为对象,研究细胞自噬对毕赤酵母生长代谢的调控机理,涉及多个重组菌株的构建。所用质粒:pPICZB (Invitrogen)、pPic9-ARS-CEN-PHTX1-sgRNA (实验室构建)。各重组菌株如表1所示。

表1 所用毕赤酵母及其突变株Table 1 Pichia pastoris and its mutants in this study
1.1.3 培养基
Luria-Bertani(LB)液体培养基(酵母提取物5 g/L,蛋白胨10 g/L,NaCl 10 g/L;固体培养基加 2%琼脂,121 ℃,20 min灭菌);Low-salt LB (LLB)液体培养基(酵母提取物5 g/L,蛋白胨10 g/L,NaCl 5 g/L;固体培养基加2%琼脂,121 ℃,20 min灭菌);Yeast Extract Peptone Dextrose(YPD/YEPD)液体培养基(酵母提取物10 g/L,蛋白胨20 g/L,121℃灭菌20 min。冷却至60 ℃后在超净台中加入碳源);Bufffered Yeast-Extract Medium(BMY)液体培养基(酵母提取物 10 g/L,蛋白胨20 g/L,K2HPO43 g/L,KH2PO411.8 g/L,115 ℃灭菌30 min);Glycerol Complex BMY (BMGY)液体培养基(在BMY液体培养基中加入1%的甘油);Glycerol and Methanol Complex BMY (BMGMY)液体培养基(在BMY液体培养基中加入0.5%的甘油和0.5%的甲醇);Methanol Complex BMY(BMMY)液体培养基(在BMY液体培养基中加入1%的甲醇)。
1.2 方法
1.2.1 菌株培养
取甘油菌以1%~2%接种于5 mL的YPD液体培养基中,30 ℃、230 r/min下活化16 h后离心收集全部菌体,用无菌磷酸盐缓冲液洗涤3次,按初始OD600=0.1接种于不同碳源的BMY培养基中,在30 ℃、230 r/min下培养,按不同的实验设计时间取样,测所需参数。
1.2.2 碳源消耗速度检测(高效液相色谱法)
取培养基中发酵液,13 000 r/min高速离心10 min,收集上清液,200 μL的进样量装入色谱进样瓶中检测甲醇和甘油的浓度。色谱条件为:有机酸柱及示差折光检测器,流动相:5 mmol/L硫酸作,流速:0.5 mL/min,柱温:30 ℃。
碳源的消耗速度计算公式V=(S0-St)/Δt,其中:S0为碳源初始浓度,St为t时刻碳源浓度,Δt为取样间隔时长。
1.2.3 基因表达定量检测(实时荧光定量PCR,qRT-PCR)
分别在50 mL的BMMY和BMGY培养基中,30 ℃、230 r/min下培养WT和P.pastorisΔGT1菌株24 h后,每瓶培养液平均分成两份,每份25 mL,离心收集菌体,用无菌磷酸盐缓冲液洗涤3次,再将每份菌体分别转接到25 mL的BMMY和BMGY培养基中。在30 ℃、230 r/min 下发酵10 min 后,收集OD600=10的菌体,加入TRIZOL和玻璃珠,用高通量破碎仪对菌体进行破碎。破碎后加入1/5 TRIZOL体积的氯仿析出RNA,溶液分为水相和有机相,RNA在水相中。取出水相,用相同体积的乙醇沉淀回收RNA,加入Buffer1,Buffer2清洗,最后加入适量RNase free水溶解。提取出的RNA经核酸凝胶电泳验证,出现两条带,第一条带亮度约是第二条的两倍。用Takara的试剂进行反转录和qRT-PCR,检测不同碳源培养下,样品中与自噬相关基因:Atg8、Atg9、Pik3、Pka、Thiolase、Atg30、Pex14、Pex4和Pex5的相对表达量(Relative Quantity,RQ)的变化规律,RQ值采用StepOne Software的计算方式。
Cycle Threshold(Ct)值:每个反应管内的荧光信号到达设定的域值时所经历的扩增循环数。
ΔCt=Ct目的基因-Ct内参基因,
ΔΔCt=ΔCt目的样品-ΔCt对照样品,RQ=2-ΔΔCt。
1.2.4 菌株构建
因毕赤酵母自噬相关研究较少,自噬相关蛋白均无商业化的特异性抗体。利用CRISPR/Cas9基因敲除技术,将蛋白标签(6×His)连在酵母染色体上目的基因的C端[14],以检测目的蛋白的表达。以pPic9-ARS-CEN-PHTX1-sgRNA(sgRNA表达质粒)为模板,合成带有目的基因的sgRNA序列(sgRNA片段由http://chopchop.cbu.uib.no/网站设计)的pPic9-ARS-CEN-PHTX1-sgRNA质粒的同源片段,再用同源重组将片段整合到质粒上,构建出可以敲除目的基因的sgRNA质粒。以野生型菌株的基因组为模板,分别用引物up-F,up-R,down-F,down-R(up-R和down-F中含有6×His标签)将目的基因上下游同源臂扩增出来,再将两段同源臂融合,所用引物如表2所示,构建含有6×His标签的目的基因的同源片段,如图1所示。将sgRNA质粒和同源片段转化入P.pastorisCas9和P.pastorisΔGT1菌株中,培养组氨酸营养缺陷型筛选平板上的单克隆,并提取酵母基因组DNA,进行PCR验证。PCR反应所用引物F为基因组DNA上目的基因的上游序列,引物R为重组片段6×His标签附近序列,因此只有重组成功的转化子扩增出特异性的PCR产物。PCR产物经 1%琼脂糖凝胶电泳分析,筛选目的基因后连上了6×His标签的突变株进行测序验证。

表2 合成同源臂所用引物Table 2 Primers for construction homologous DNA fragment
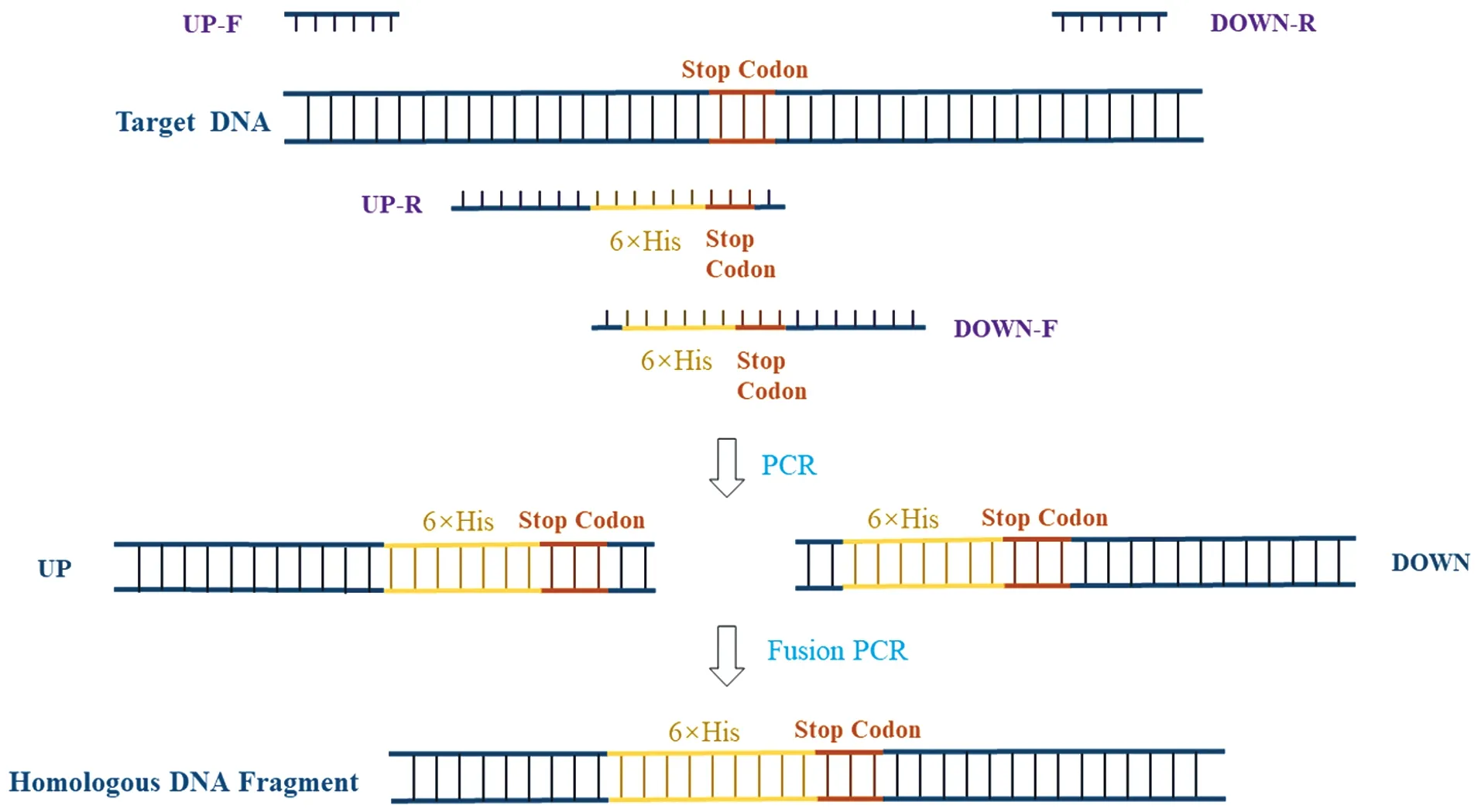
图1 同源臂构建Figure 1 Construction of homologous DNA fragment
1.2.5 蛋白表达量检测(化学发光法)
用1.2.3节相同的方式培养,相同的时间取样,收集OD600=10的菌体提取蛋白,加入与菌体等量的酸性玻璃珠和预冷的PEB酵母裂解液(含PMSF)重悬细胞,振荡破碎菌体后离心吸取上清至洁净的Eppendorf 管中,-20 ℃保存。经过Bradford法蛋白质定量之后将样品固定在塑胶孔盘上,封闭液封闭,加入6×His标签的抗体,最后加发光底物用酶标仪读出每孔的相对光单位(relative light unit,RLU),即可表征蛋白的表达量。
2 结果与分析
2.1 不同碳源培养对毕赤酵母代谢的影响
分别在BMMY、BMGY和BMGMY等3种不同碳源的培养基中培养WT和P.pastorisΔGT1菌株,每隔 6 h取样,收集上清发酵液,通过高效液相色谱仪,分析发酵液中碳源的消耗情况,计算细胞对碳源的利用速度,结果如图2和图3所示。毕赤酵母以甲醇为单一碳源培养时,细胞对碳源的代谢速度明显低于以甘油为单一碳源。在甘油和甲醇的混合碳源培养基中,甘油会抑制WT菌株的甲醇代谢,所以细胞对甲醇的利用率明显低于甘油;P.pastorisΔGT1菌株在对数期前会优先利用甘油,在对数期后细胞对甲醇的利用率大幅度提升,由于敲除了甘油转运体,细胞对甲醇的偏好明显高于甘油。证明单一碳源培养时,毕赤酵母细胞对甲醇的利用速度比甘油低,在甲醇培养基中,细胞代谢比在甘油培养基慢。混合碳源培养时,由于甘油抑制了毕赤酵母对甲醇的代谢,所以WT菌株倾向于代谢甘油,而P.pastorisΔGT1菌株解除了甘油对甲醇代谢的抑制,则优先选择利用甲醇进行代谢。
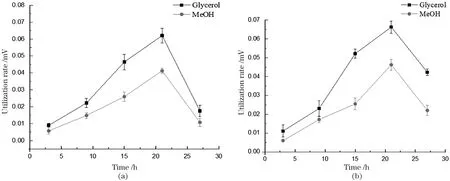
图2 单一碳源培养基中P. pastoris ΔGT1(a)和WT(b)对碳源的消耗速度Figure 2 Utilization rate of carbon source of P. pastoris ΔGT1 (a)and WT(b)in sole carbon source medium
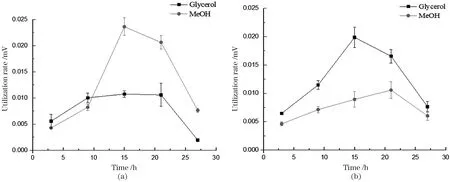
图3 BMGMY培养基中P. pastoris ΔGT1(a)和WT(b)对碳源的消耗速度Figure 3 Utilization rate of carbon source of P. pastoris ΔGT1 (a)and WT(b)in BMGMY
2.2 不同碳源培养对毕赤酵母生长状况的影响。
以甲醇或甘油为单一碳源培养的酵母,在100倍生物显微镜下的细胞状态如图4所示。发现毕赤酵母在甲醇培养基中生长时,细胞干瘪且破损率高,在甘油培养基中生长时,细胞圆润饱满。
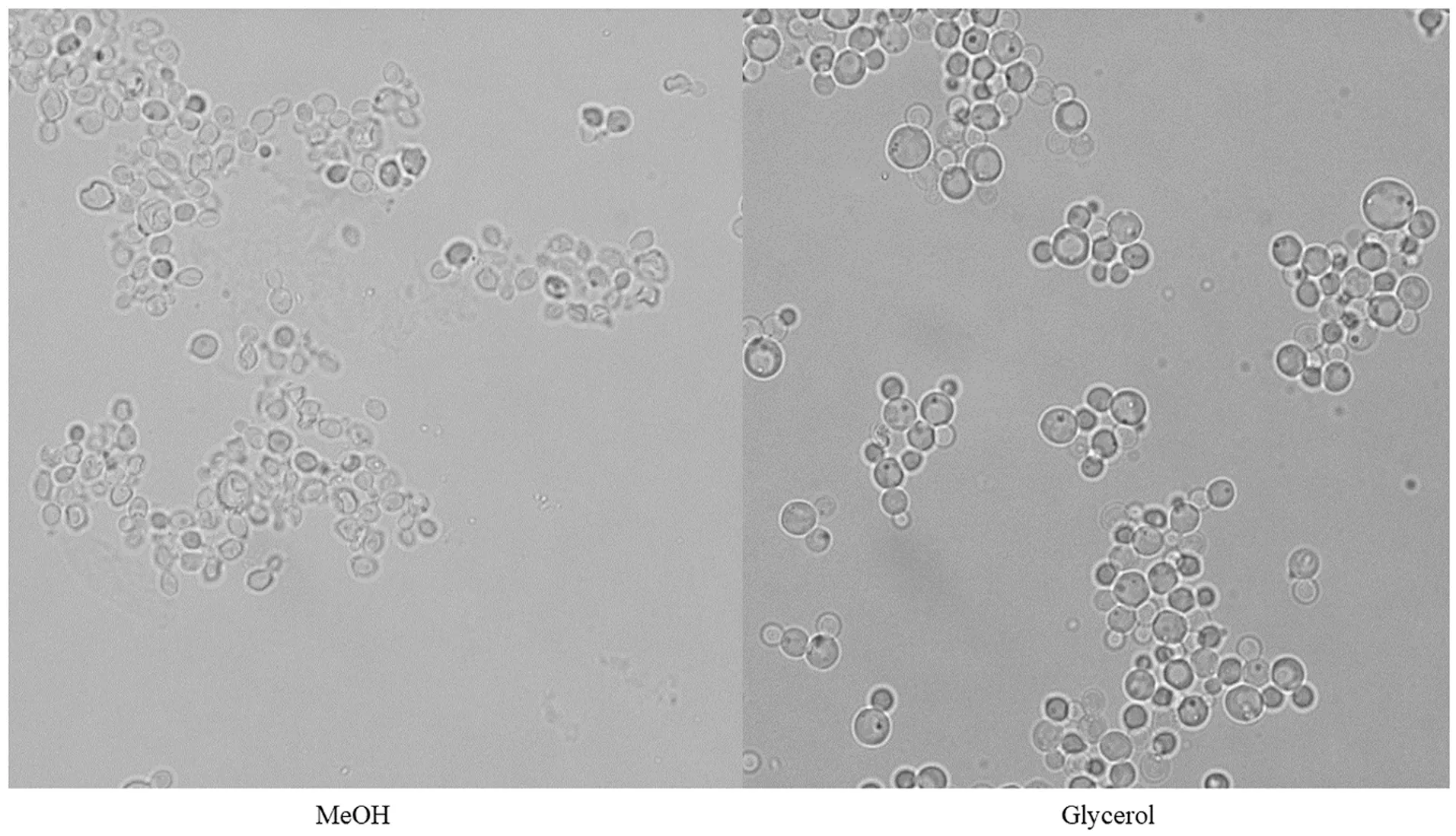
图4 毕赤酵母在不同碳源中的细胞形态Figure 4 Morphology of Pichia pastoris using different carbon sources
在BMMY、BMGY和BMGMY等3种不同碳源培养基中培养WT和P.pastorisΔGT1菌株,从12 h开始,每隔6 h取样,测OD600并绘制生长曲线,如图5所示。WT和P.pastorisΔGT1菌株以甲醇为碳源生长时,菌株生长密度比以甘油为碳源时低。并且在混合碳源培养基中培养时,菌株的生长密度依旧不如以甘油为唯一碳源培养的菌株。综上证明毕赤酵母在甲醇中生长状态不如甘油,并且只要细胞代谢甲醇,生长状态就会下降,甘油比甲醇更有利于毕赤酵母的生长。
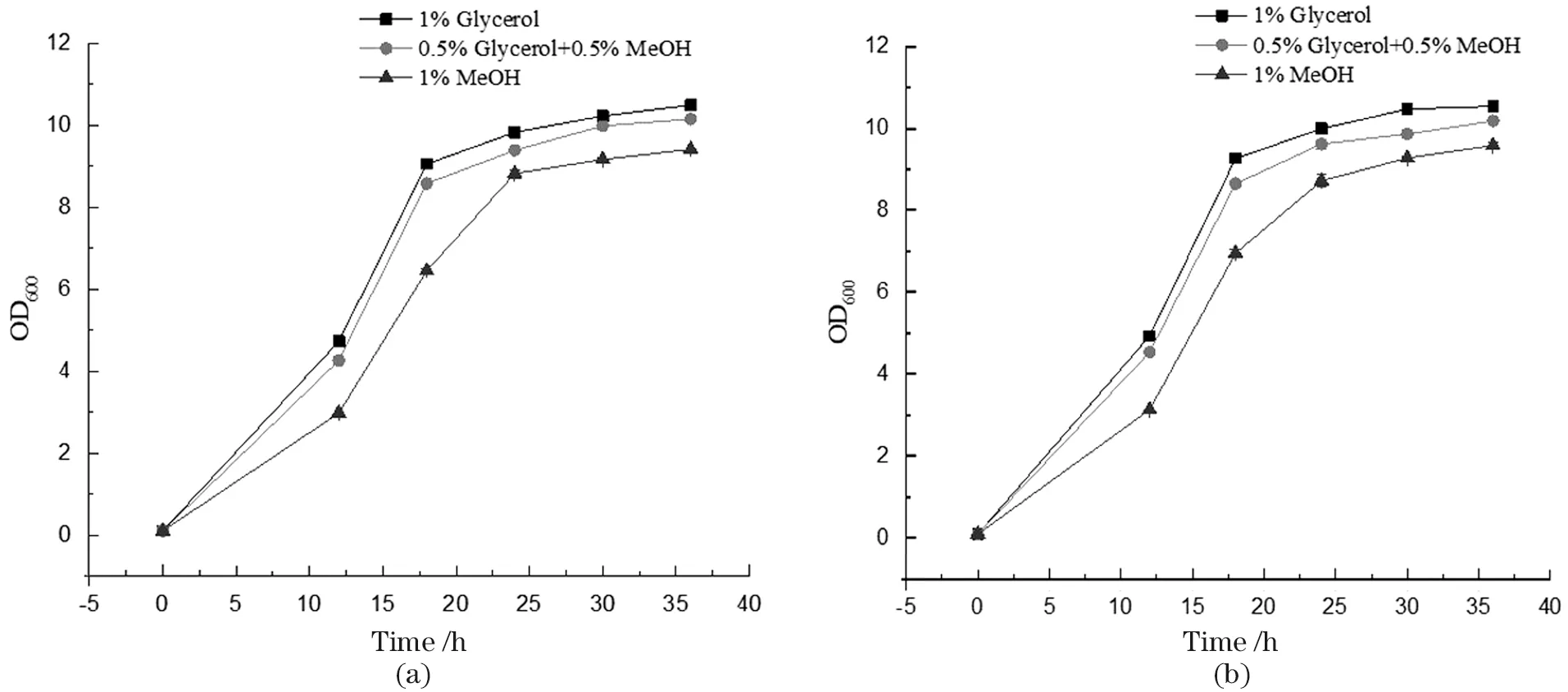
图5 不同碳源的培养基中P. pastoris ΔGT1(a)和WT(b)的生长曲线Figure 5 Growth curve of P. pastoris ΔGT1(a)and WT(b)using different carbon sources
2.3 不同碳源培养对毕赤酵母细胞自噬的影响
按1.2.3节所述的培养方法,得到4瓶培养液:碳源从甘油转到新的甘油(Glycerol→Glycerol),碳源从甘油转到新的甲醇(Glycerol→MeOH),碳源从甲醇转到新的甘油(MeOH→Glycerol),碳源从甲醇转到新的甲醇(MeOH→MeOH),取培养液中发酵10 min 后的样品。通过qRT-PCR检测发现两个自噬相关基因的表达量随碳源改变发生明显变化。Atg8:宏自噬过程中,自噬体膜上负责自噬体与液泡融合的蛋白,在自噬被诱导发生后表达量增加10到20倍,是酵母细胞内自噬研究中常用的标记物[14-15];Atg30:过氧化物酶体自噬过程中,自噬体特异性识别过氧化物酶体必需的受体因子,是酵母细胞内过氧化物酶体自噬研究中常用的表征物[11-12]。结果如图6~图8所示。
无论初始碳源是甘油还是甲醇,当碳源换成甲醇时,WT菌株和P.pastorisΔGT1菌株内Atg8基因的表达量均比碳源换成甘油时高(图6)。说明在甲醇培养基中,细胞内宏自噬水平高。在逆境中,宏自噬通过分解细胞内的多余组分维持细胞基本稳态,结合图4和图5的结果可以证明,甲醇能够诱导细胞内宏自噬水平提高,细胞生长状态下降,生长速度变缓,不同碳源可以通过调节宏自噬水平影响细胞生长。
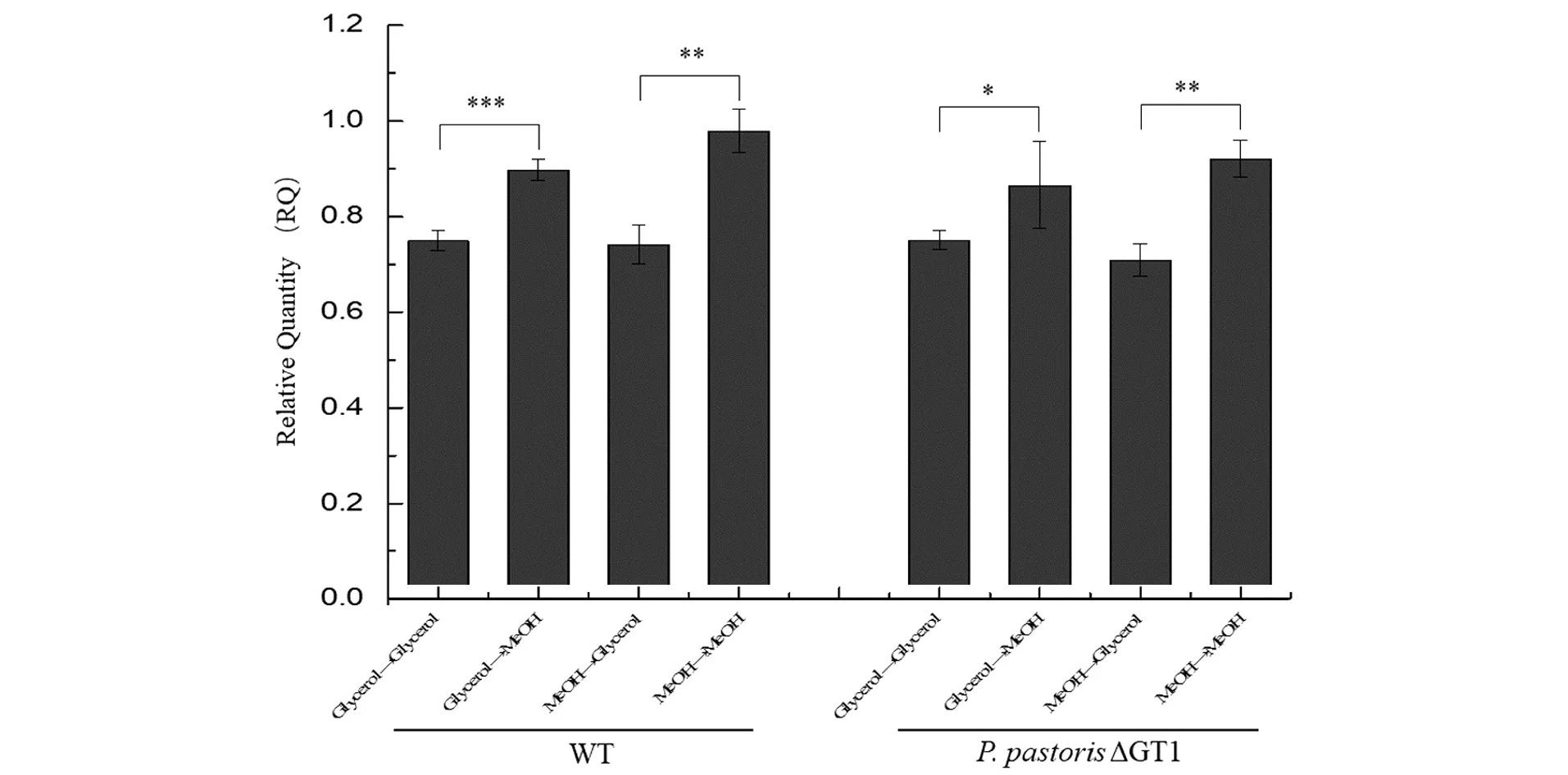
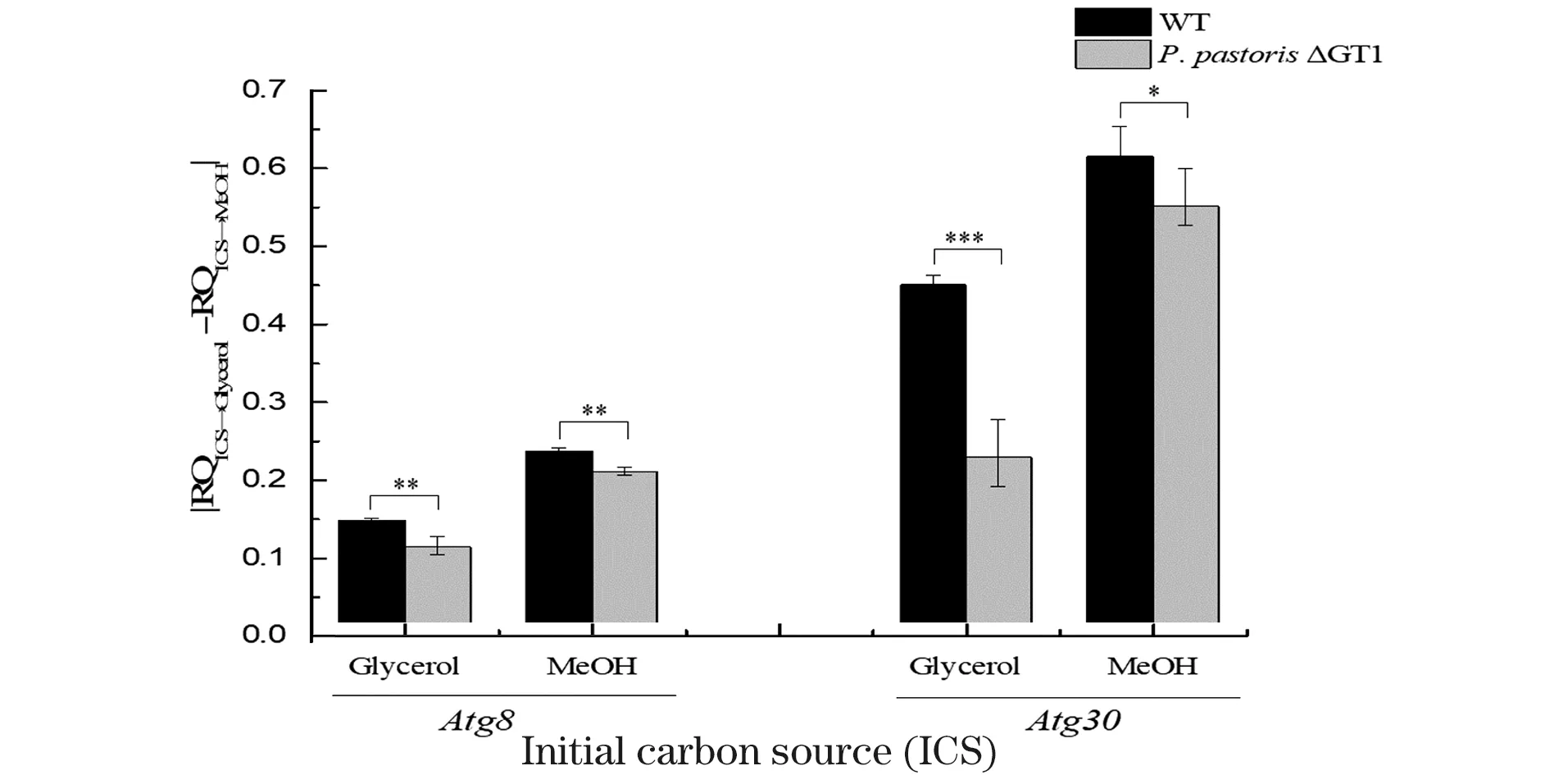
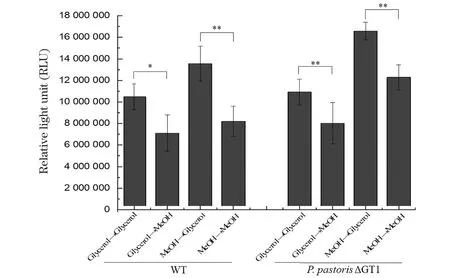
*** 为P<0.01;** 为0.01 无论初始碳源是甘油还是甲醇,当碳源换成甲醇时,WT菌株和P.pastorisΔGT1菌株内Atg30基因的表达量均比碳源换成甘油时低(图7)。说明在甲醇培养基中,细胞内过氧化物酶体自噬水平低。结合图2和图3的结果发现,甘油中细胞内过氧化物酶体自噬水平高,过氧化物酶体被分解利用为其他代谢通路的组分提供“营养”,从而甘油代谢速度加快;混合碳源中P.pastorisΔGT1菌株解除了甘油抑制后,过氧化物酶体自噬水平的抑制增加了细胞对甲醇的代谢。因此证明不同碳源通过调节过氧化物酶体自噬水平影响细胞代谢。 图 6和图 7显示,无论初始碳源是甘油还是甲醇,当碳源变成甲醇(ICS→MeOH)时,WT和P.pastorisΔGT1菌株中Atg8的表达量相较于碳源变成甘油(ICS→Glycerol)时均增加,Atg30的表达量均降低,但是两种菌株内Atg8和Atg30表达量的变化程度不同。用细胞从初始碳源(甘油或者甲醇)转接到甘油中基因的表达量与细胞从初始碳源(甘油或甲醇)转接到甲醇中基因的表达量的差值的绝对值(|RQICS→Glycerol-RQICS→MeOH|)来表征不同碳源引起的基因表达量变化的差异。结果如图8所示,P.pastorisΔGT1菌株内不同碳源引起的Atg8基因和Atg30基因表达量的差异显著低于WT菌株Atg8基因和Atg30基因表达量的差异,说明P.pastorisΔGT1菌株内宏自噬和过氧化物酶体自噬通量在不同碳源中的差异比WT小。这一实验结果从自噬角度论证敲除GT1基因能解除甘油对甲醇代谢的抑制,减小P.pastorisΔGT1胞内两种碳源代谢的矛盾和差异性。 *** 为P<0.01;** 为0.01 *** 为P<0.01;** 为0.01 为进一步验证上述结论,从蛋白表达水平检测ATG8和ATG30响应碳源变化的情况。因无商业化抗体,ATG8蛋白和ATG30蛋白后需连上合适的抗原标签才能进行检测。 通过胞内同源重组的方式,用带有6×His标签序列的同源臂替换原基因,可在目的蛋白后连上6×His标签。但是毕赤酵母细胞同源重组概率低,打靶效率可低至0.1%[16],因此,在构建突变株时增加了CRISPR/Cas9敲除系统,利用敲除质粒在目的基因的sgRNA序列靶向位点处形成DNA双链断裂,增加细胞内同源重组修复概率,提高毕赤酵母细胞同源重组编辑技术的效率[17],原理如图9所示。 将带有目标基因sgRNA片段的质粒和带有6×His标签的同源臂片段转化至P.pastorisCas9和P.pastorisΔGT1菌株,按1.2.4节所述的方法进行PCR验证,结果如图10所示,可以扩增出800 bp左右的条带的转化子即为阳性转化子,而未发生同源重组的转化子无法扩增出条带。经进一步测序验证P.pastorisAtg8:6×His,P.pastorisΔGT1-Atg8:6×His,P.pastorisAtg30:6×His和P.pastorisΔGT1-Atg30:6×His 4株在标签连接的突变株构建完成。本文创新性地将最新的CRISPR/Cas9基因敲除技术和同源重组技术联用,使细胞内同源重组概率(阳性转化子个数/总转化子个数)达到22%~33%(图10),有效降低了同源重组改造的筛选难度。 标签连接完成后,按1.2.5节所述的方法检测样品中蛋白ATG8和ATG30的表达量,结果如图11~图13所示。 图11和图12的结果显示,当碳源换成甲醇时,WT和P.pastorisΔGT1菌株内ATG8蛋白的表达量比碳源换成甘油时高;ATG30的蛋白表达量比碳源换成甘油时低,说明蛋白表达受碳源调控的变化规律与基因表达一致。本文从蛋白表达水平进一步证明,毕赤酵母在甲醇培养基中细胞内宏自噬水平上调,细胞生长速率被抑制;过氧化物酶体自噬水平下降,过氧化物酶体累积,甲醇代谢加快。图 13显示,P.pastorisΔGT1菌株转接到不同碳源时,细胞内ATG8蛋白和ATG30蛋白的表达量变化的差异同样低于WT菌株,在蛋白表达水平上进一步证明敲除GT1基因可以降低甘油和甲醇对细胞的自噬调控的差异。 *** 为P<0.01;** 为0.01 *** 为P<0.01;** 为0.01 *** 为P<0.01;** 为0.01 巴斯德毕赤酵母作为一种高效的表达外源蛋白的真核系统,已经被广泛地研究和利用。但是细胞在甲醇培养基中生长状态不佳,很大地局限了毕赤酵母利用甲醇代谢进行发酵。为进一步分析原因,提高酵母的发酵产率,本文发现了自噬这一重要的调控途径。不仅确定了甲醇能通过调控自噬水平影响细胞生长代谢,还阐明了具体调控方法:提高细胞宏自噬水平,使细胞生长受到抑制;降低细胞过氧化物酶体自噬水平,从而累积AOX1,提高AOX1酶活。这一发现为毕赤酵母内甲醇利用系统的改善和菌种的优化改造提供了新的思路。后期在此基础上通过基因操作人工调节自噬途径,有望得到更好生长且更高效利用甲醇发酵生产蛋白的菌株,因此实验结果在巴斯德毕赤酵母外源蛋白表达的工业应用中具有重要价值。 此外,P.pastorisΔGT1菌株拥有广泛的应用前景,在研究中发现,当碳源转变为甲醇时,细胞内过氧化物酶体自噬通量会减少,宏自噬通量会增加,而P.pastorisΔGT1菌株内细胞自噬通量的改变幅度显著低于野生型菌株。这一结果揭露了一条新的P.pastorisΔGT1菌株影响的细胞代谢途径,从一个新的角度解释了GT1的缺失对酶活的影响。
2.4 蛋白表达水平验证


3 讨论与结论
