潘氏细胞为小肠干细胞提供微环境信号因子研究进展
2021-10-25李艳丽郭煜晖熊正国张长城顿耀艳
李艳丽,郭煜晖,刘 雨,熊正国,张长城,顿耀艳
(三峡大学 医学院,宜昌 443002)
小肠干细胞(intestinal stem cells,ISCs)位于小肠隐窝(又名小肠腺)底部,具有强大增殖和分化能力,可分化为不同类型的肠上皮细胞。ISCs每3~6 d更新1次,以修复因大量外源性物质攻击而受损的小肠上皮细胞,因而ISCs的增殖和分化平衡是维持小肠上皮稳态的关键[1]。ISCs能分化为成熟的潘氏细胞,但与其他成熟的肠上皮细胞不同,潘氏细胞在分化后向下移动,定居于隐窝底部,与ISCs在隐窝底部交叉排列[2-3]。由于特殊的生理位置,潘氏细胞对干细胞功能的影响受到广泛关注。多个研究发现,与单独的ISCs体外培养相比,ISCs与潘氏细胞共培养形成的类器官的数量明显增加[4-5],提示潘氏细胞对ISCs发挥正常功能具有重要意义。进一步研究表明,ISCs的干性取决于其所在的隐窝微环境。隐窝微环境由ISCs附近的潘氏细胞和周围的间质细胞构成,它们特殊的凹形结构减少ISCs与肠腔物质接触,形成一个相对稳定的环境,并可提供多种信号因子,调控ISCs内部关键信号通路,决定ISCs增殖和分化命运,当ISCs离开隐窝微环境,便失去增殖潜能,并向特定的方向分化,最终成为成熟的肠上皮细胞[6]。潘氏细胞相关微环境能提供多种信号因子调控ISCs内多个信号通路,如Wnt、Notch、EGF、mTORC1等信号通路,对ISCs的增殖、分化发挥重要作用[6]。而潘氏细胞释放的信号分子变化则可因改变ISCs增殖分化状态,引起肠上皮稳态失衡。本文就潘氏细胞为ISCs提供的微环境信号因子及其在肠上皮稳态中的作用进行综述,旨在为相关的肠上皮稳态失衡提供治疗思路。
1 潘氏细胞为ISCs提供的微环境Wnt 信号因子
Wnt信号通路是ISCs增殖的关键信号通路,其中潘氏细胞是ISCs上皮Wnt配体的主要来源,能表达多种Wnt配体,如Wnt3、Wnt6和Wnt9b[7]。相关研究表明,Wnt配体溶解性较差,主要由细胞间的直接接触传递。Wnt蛋白在细胞内被翻译后,于内质网和高尔基体内进行修饰,如被酰基转移酶PORC(porcupine)棕榈酰化的脂质修饰、N-糖基化修饰,修饰完成后与高尔基体膜转运蛋白Wnless通过棕榈油酸部分结合,由囊泡运送至细胞膜分泌[8]。研究发现,敲除小鼠肠上皮细胞囊泡运输调控基因Rab8a,位于潘氏细胞顶端或基底外侧质膜的Wnless蛋白GPR177明显减少,而位于溶酶体的GPR177增多,肠隐窝Wnt信号活性明显降低[9],表明Rab8a敲除后潘氏细胞内Wnt蛋白囊泡运输至溶酶体增多,导致潘氏细胞Wnt蛋白的分泌减少。潘氏细胞分泌的Wnt3配体通过旁分泌途径覆盖在ISCs的细胞膜表面,并随着细胞分裂离开ISCs,形成独特的以隐窝底部浓度最高的Wnt3信号浓度梯度,这是Wnt信号浓度梯度从隐窝底部至绒毛部依次向上递减的原因之一[7]。
Wnt信号通路在ISCs中的具体过程:Wnt配体与ISCs膜表面受体FZD(frizzled)、LRP5/6(low density lipoprotein receptor related protein5/6)结合,经过一系列反应后,阻断β-连环蛋白(β-catenin,β-cat)磷酸化降解,导致β-cat与核转录因子TCF4(T cell factor)结合增多,促进靶基因的转录,包括细胞增殖、肿瘤发生等相关基因[10]。因此,该信号通路异常活化导致ISCs过度增殖,形成异常隐窝甚至发展为肿瘤[2,11]。Wnt靶基因Sox9参与ISCs分化为潘氏细胞的过程,通过上调Wnt信号通路促进Sox9表达,能诱导潘氏细胞增多[12],而增多的潘氏细胞又能为ISCs提供更多Wnt3配体[13]。由此可见,潘氏细胞能激活ISCs的Wnt信号通路,激活的Wnt信号通路又能通过增加ISCs分化为潘氏细胞的数量,形成一个正反馈。
不同病理情况下,潘氏细胞能通过Wnt信号通路影响肠上皮的稳态。研究发现:衰老小鼠潘氏细胞分泌的Wnt3配体减少,ISCs内Wnt信号通路下调,隐窝数量减少[14]。Pentinmikko等[15]研究显示,与青年鼠相比,衰老小鼠小肠潘氏细胞分泌更多的Notum,Notum为Wnt抑制剂,可使Wnt配体去酰化,因而导致Wnt配体与ISCs膜上的受体分离,局部Wnt活性降低,衰老小鼠ISCs的增殖能力减弱。以上衰老相关研究表明,衰老小鼠ISCs增殖能力减弱、肠上皮稳态失调与细胞内Wnt信号抑制密切相关,其中,潘氏细胞通过减少Wnt配体分泌,并增加Wnt抑制剂Notum分泌发挥重要作用。在DSS诱导的小鼠肠道炎症中,ISCs显著减少,肠上皮稳态失衡;而成熟的潘氏细胞内Wnt信号通路被激活,并重新进入细胞周期,去分化而获得自我更新和多能干细胞特性,维持干细胞的功能,促进受损肠上皮的修复和再生[16]。潘氏细胞提供的Wnt信号分子对维持肠上皮稳态发挥着关键作用,本课题组前期研究也发现,衰老大鼠小肠Wnt信号水平明显降低、干细胞增殖能力减弱、小肠上皮发生退行性变化[17];对高脂饮食小鼠研究发现,肠道Wnt/β-cat信号通路明显上调,ISCs过度增殖[18],潘氏细胞在其中功能的变化值得进一步研究。
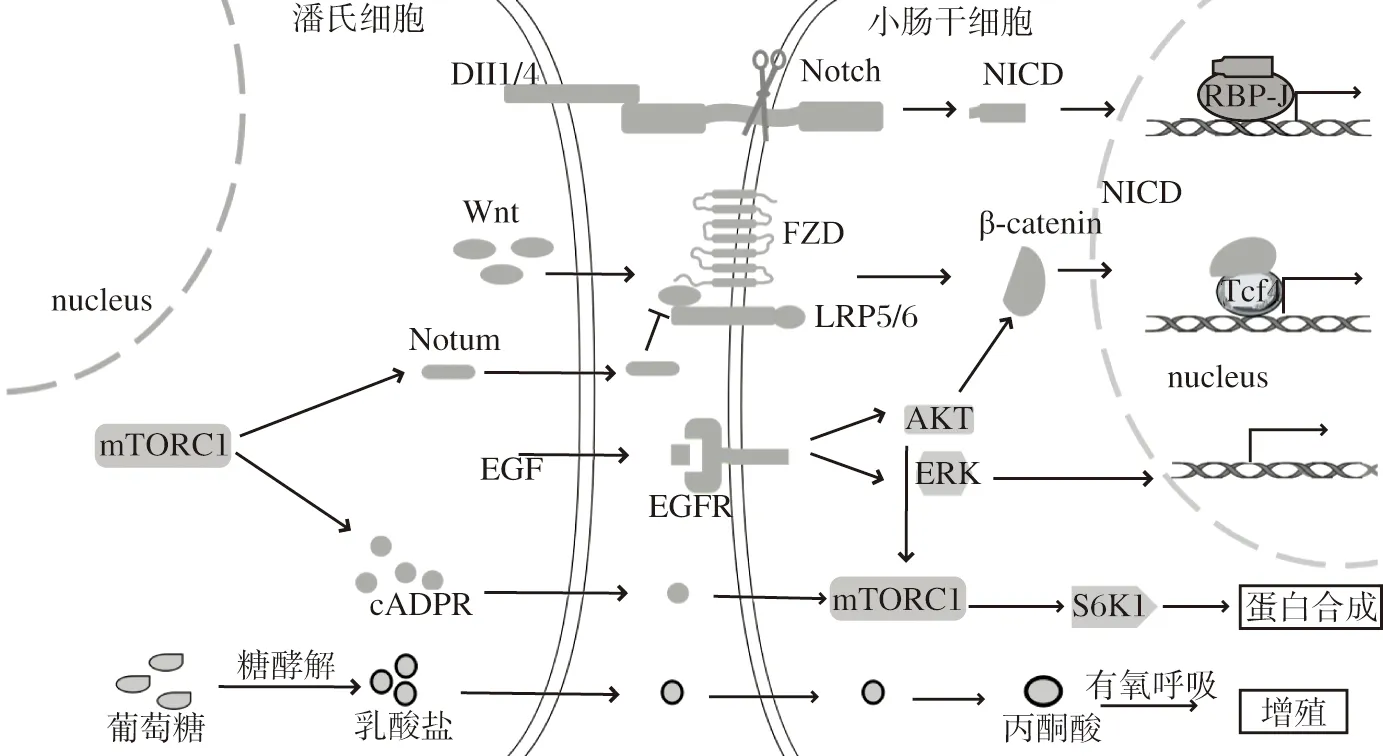
图 1 潘氏细胞为小肠干细胞提供微环境信号因子Figure 1 Microenvironment signaling factors of intestinal stem cells provided by Paneth cells
2 潘氏细胞为ISCs提供的微环境Notch 信号因子
Notch信号通路在调控ISCs分化命运方面发挥着关键作用。研究显示,Notch配体及其受体均为跨膜蛋白,主要存在于两个细胞的间隙中,是肠隐窝中作用最短的信号因子,故ISCs膜表面的Notch受体主要由邻近潘氏细胞的Notch配体Dll 1(delta-like 1)和Dll 4激活[13]。Notch配体在内质网和高尔基体进行糖基化、泛素化等修饰后,通过囊泡被运输至细胞膜。RFNG (radical fringe)高表达于潘氏细胞高尔基体,是一种能调节Notch配体活性的糖基转移酶,将RFNG基因敲除的ISCs体外培养形成类器官,发现由RFNG基因敲除ISCs分化而来的潘氏细胞表面的配体Dll 1和Dll 4减少,ISCs的Notch活性减弱,形成的类器官数量减少[19]。
Notch信号通路的具体过程:Notch配体和受体结合后,受体胞外区构象变化,暴露ADAM(a disintegrin and metalloprote)家族金属蛋白酶裂解位点,引起胞外段结构域断裂,Notch受体截余部分作为γ-分泌酶的作用底物,经蛋白水解反应剪切后释放转录因子NICD(notch intracellular domain)[20]。NICD能结合靶基因启动子区 RBP-J,促进碱性环螺旋转录因子Hes1转录,同时抑制碱性环螺旋转录因子Atoh1转录,导致ISCs更多地分化为吸收系细胞,减少分泌系细胞的分化[ 21]。
潘氏细胞Notch配体变化可影响ISCs的数量和肠上皮稳态。由RFNG基因敲除ISCs分化而来的潘氏细胞表面Notch配体减少,能明显减少体外培养形成的类器官、Lgr5+干细胞数量[19]。感染胃肠炎病毒后,仔猪小肠Lgr5+干细胞更多地分化为杯状细胞,绒毛明显萎缩,提示病毒感染后肠上皮稳态失衡。进一步研究表明,病毒能影响潘氏细胞Dll 4启动子的活性,降低Dll 4表达水平,通过Notch信号通路抑制Lgr5+干细胞的增殖和正常分化,导致肠道稳态失衡[22]。衰老相关研究表明,衰老小鼠小肠发生退行性变化与Notch信号水平下调有关[14]。本课题组前期研究也表明,衰老大鼠回肠Notch信号通路下调[23],但衰老大鼠潘氏细胞Notch配体表达是否下调仍有待进一步研究。
ISCs内的Wnt信号通路与Notch信号通路存在相互作用,共同调节ISCs的分化。Notch和Wnt能共同调控基因Bmi1的表达,该基因表达上调能促进小鼠ISCs增殖和吸收系细胞分化[24]。Van等[20]研究发现,抑制小鼠小肠Notch信号通路,隐窝内Wnt信号通路异常活化,ISCs大量分化为杯状细胞、潘氏细胞,运用Wnt抑制剂能恢复ISCs的正常分化水平,表明Noch信号能抑制Wnt信号通路,维持隐窝适当的Wnt信号水平,调控干细胞的增殖和分化。激活的Wnt信号通路能增加肠上皮细胞Notch信号通路的稳定性[25]。由此可见,两个信号通路之间的关联具有复杂性。潘氏细胞如何协调两个信号通路保持在合适的水平,以及其中的具体机制仍需进一步研究。
3 潘氏细胞为ISCs提供的微环境EGF信号因子
潘氏细胞能分泌表皮生长因子EGF和转化生长因子-α(transforming growth factor-α,TGF-α),作用于细胞膜上高表达EGF受体的ISCs,激活ISCs的EGF信号通路[13]。间质细胞通过囊泡运输向ISCs提供EGF配体[26],但潘氏细胞提供EGF配体的途径尚未见报道,仍需进一步研究。
EGF配体是肠道类器官培养基的核心成分之一,能明显增强ISCs的增殖能力[6]。EGF信号通路主要通过RI3K/PIP3/AKT轴和SOS/RAS/MEK/ERK轴发挥作用[27-28]。EGF信号通路可影响多个ISCs增殖和分化相关通路。首先,EGF可调控Wnt 信号通路:激活EGF信号通路促进Akt 发生磷酸化,进而导致细胞膜E-钙粘着蛋白(e-cadherin,e-cad)复合物中的β-cat发生磷酸化,并脱离 E-cad复合物,增加细胞质中游离β-cat的水平,上调Wnt 信号通路[29]。日粮中添加EGF的仔猪小肠隐窝Wnt信号水平上调,小肠上皮潘氏细胞、杯状细胞、内分泌细胞数量增加,表明EGF促进仔猪小肠增殖和分泌系细胞分化,且与Wnt 信号通路活化相关[30]。其次,EGF可调控mTORC1信号通路:EGF通过磷酸化AKT促进Rheb(ras homolog enriched in brain)的去泛素化,使Rheb从TSC(tuberous sclerosis protein)中释放,将被招募到溶酶体表面的mTORC1蛋白激活[31]。磷酸化的Akt通过引起细胞内L型氨基酸转运蛋白3的稳定和膜定位增加,促进亮氨酸的摄取,激活mTORC1信号通路,调节细胞生长的多种蛋白质合成[32]。
4 潘氏细胞与ISCs相关的微环境mTORC1信号通路
mTORC1信号通路是机体重要的能量感受机制,可感知机体营养状态,mTORC1激酶通过磷酸化p70核糖体S6激酶(S6K1)促进核糖体蛋白S6磷酸化驱动蛋白质合成,调控细胞的代谢与生长[31]。潘氏细胞和ISCs内均存在mTORC1信号通路。潘氏细胞的mTORC1信号通路可通过多种机制影响ISCs的功能。
Pentinmikko等[15]研究表明,进行热量限制时潘氏细胞内mTORC1信号通路明显抑制,从而增加骨基质抗原1(bone stromal antigen 1)的表达,促进环腺苷二磷酸核糖(cyclic adenosine diphosphate ribose,cADPR)形成和旁分泌,导致ISCs更倾向于自我更新而非分化。在热量限制中,小鼠潘氏细胞分泌的cADPR激活邻近ISCs中SIRT1和mTORC1信号通路,SIRT1通过促进S6K1去乙酰化增强mTORC1激酶磷酸化S6K1的作用,增加ISCs蛋白质合成、自我更新和隐窝扩张[33]。因而,热量限制相关研究表明,在机体的营养状况发生变化时,ISCs并不直接感受能量的信号,而是由潘氏细胞内mTORC1信号通路发生变化感知能量信号,并分泌因子cADPR作用于ISCs,调控ISCs内mTORC1信号通路,促进ISCs增殖。
衰老小鼠的小肠潘氏细胞mTORC1信号通路活化,抑制过氧化物酶体增殖物激活受体α作用增强,导致潘氏细胞分泌的Notum增加,通过Wnt信号通路抑制衰老小鼠ISCs的增殖能力[15]。衰老小鼠ISCs中的mTORC1信号通路异常激活,小肠发生绒毛和隐窝数量减少、增殖水平降低、电离辐射刺激后上皮恢复能力降低等一系列退行性变化,通过雷帕霉素治疗抑制异常活化的mTORC1信号,能挽救衰老小鼠这一系列变化,表明衰老小鼠肠上皮退行性变化与ISCs中的mTORC1信号通路异常激活有关[34];衰老果蝇的相关研究表明,衰老导致肠上皮干细胞丢失与干细胞内mTORC1信号的反复激活密切相关[35]。衰老的ISCs增殖能力减弱、数量减少与潘氏细胞和ISCs中mTORC1信号通路活化有关,但潘氏细胞是否参与ISCs中mTORC1信号通路的激活尚不清楚。
5 其他
潘氏细胞进行糖酵解产生的乳酸盐是支持ISCs功能所必需的。潘氏细胞能量代谢的方式主要为无氧酵解,其最终产物主要为乳酸盐和氢离子;ISCs则表现出更强的线粒体活性,通过线粒体氧化磷酸化的有氧途径提供能量[36]。抑制潘氏细胞糖酵解与抑制ISCs线粒体氧化磷酸化,均可影响ISCs的功能;体外小鼠ISCs培养,加入乳酸盐比加入葡萄糖形成的类器官多,表明潘氏细胞糖酵解的能量代谢方式可影响干细胞的功能,潘氏细胞经过糖酵解产生乳酸盐,能提供给邻近ISCs。乳酸盐在ISCs内能氧化为丙酮酸,增强ISCs线粒体氧化磷酸化,并通过线粒体活性氧激活下游p38 MAPK信号通路,诱导ISCs增殖和分化,促进隐窝形成[36-37]。
6 总结与展望
潘氏细胞是ISCs的重要微环境信号因子提供者,目前大量研究证实其能直接提供Wnt、Notch、EGF等因子影响ISCs的增殖与分化,也能通过mTORC1信号通路影响干细胞的功能;近期研究更是开始关注潘氏细胞内部的代谢变化对ISCs的影响。随着老龄化社会的到来,衰老的研究日益受到重视,大量研究显示衰老时ISCs的功能减退。同样,随着生活水平的提高,高脂饮食所致的各种疾病也越来越多,研究发现高脂时小肠干细胞增殖活跃甚至会导致肠道肿瘤的发生。作者所在课题组也发现在衰老和高脂时,小肠干细胞Wnt信号通路或Notch信号通路都会发生明显改变,影响干细胞功能[17-18,23]。但是小肠干细胞增殖分化功能在不同情况下的变化都与干细胞微环境的改变密切相关,因而研究者们逐渐认识到潘氏细胞在其中的重要作用。就目前的研究进展来看还存在以下问题:(1)潘氏细胞分泌的ISCs微环境因子在不同情况下的囊泡转运调控机制目前研究较少;(2)潘氏细胞内部其他信号通路(如自噬、氧化应激、内质网应激等)如何间接影响Wnt、Notch、EGF等因子的表达水平;(3)潘氏细胞内部代谢相关研究较少;(4)潘氏细胞分泌防御素等炎症因子是否与ISCs微环境因子相关也值得关注。对潘氏细胞进一步研究,有望揭示在不同病理条件下潘氏细胞功能的变化导致ISCs关键信号通路不平衡的机制,并提供新的防治思路。
