异氰基乙酸乙酯与环丙烯酮[3+3]环合反应一步合成4-羟基吡啶化合物研究
2021-10-24冯万忠
冯万忠,陈 哲
(吉林化工学院 材料科学与工程学院,吉林 吉林 132022)
吡啶及其衍生物是一类重要的六元含氮杂环化合物[1-5],随着科研人员对合成吡啶环方法的不断探索,含有吡啶环骨架的化合物被证实具有生物活性[6-7],并且许多吡啶类化合物及其衍生物也在药物化学中得到广泛应用.例如:一种新型的激酶抑制剂Pan RAF,其骨架结构为苯并咪唑反向酰胺1-1[8-9],BMS-777607(1-2)是Met激酶一种选择性口服有效抑制剂[10-11],以4-氨基吡啶醇1-3,1-4和1-5为基本单元的结构骨架已被证实具有抑制脂质过氧化的作用[12].
活性亚甲基异氰酸酯,例如异氰基乙酸乙酯[13-14]由于存在亲核活性亚甲基部分和亲电子异氰基,它们通常被切断为1,3-偶极可以与多个键反应,通过正式的[3+2]环加成反应形成五元杂环.最近,活性亚甲基异氰酸酯的[3+3]环加成反应被认为是合成六元杂环最佳方案.在2014年,徐显秀团队报道了关于活性亚甲基异氰酸酯与偶氮甲亚胺[3+3]环加成生成1,2,4-三嗪衍生物的研究[15].四年后,该课题进行了一种阴离子中继[3+3]活性亚甲基异氰酸酯与共轭烯-炔酮的环加成反应合成呋喃[3,2-c]吡啶的研究[16].同年,Zhao[17]和Ghorai[18]独立完成了[3+3]环活性亚甲基异氰酸酯与氮丙啶的加成反应,以制备四氢嘧啶衍生物.尽管已发现异腈在杂环的生产中有许多应用[19-21],由异腈合成吡啶的方法相当有限[22-23],特别是由活性亚甲基异氰酸酯的[3+3]环加成合成官能化的单环吡啶至今仍未开发.考虑到吡啶的实用性[24],本论文开发出一种以异氰基乙酸酯与环丙烯酮的[3+3]一步合成4-羟基吡啶化合物的方法.
1 实验部分
1.1 仪器和试剂
1H NMR和13C NMR谱图由核磁共振仪(Bruker 400)测定,所用氘代试剂为氘代氯仿(CDCl3)或氘代二甲亚砜(DMSO-d6);高分辨质谱(HRMS)用Bruker micro TOF IV仪测定;化合物的熔点使用巩义予华出产的X-4数字显示显微熔点测定仪测定,熔点仪使用前已校正温度;柱层析硅胶(300~400目)产自于青岛谱科分离材料有限公司;所有的反应都由TLC silica gel 60 F254检测.实验中所用试剂都是直接从药品、试剂公司购买,除特别指出外均未经纯化处理,具体规格型号厂家见表1.

表1
1.2 实验步骤
选取1,2-二苯基环丙烯-3-酮1a和异氰基乙酸乙酯2a反应为例,描述实验过程:


2 结果与讨论
选取1,2-二苯基环丙烯-3-酮1a和异氰基乙酸乙酯2a作为模型反应,通过控制反应变量的方式,分别在催化剂类型和用量、溶剂的种类、反应温度、投料比几方面对反应的条件进行了优化:


表2 温度筛选
反应条件:1a(0.2 mmol),2a(0.24 mmol),solvent(2 mL).
实验结果显示,温度在100 ℃(Entry-4)时,得到目标产物产率较好.温度较低时,没有达到反应所需的能量,反应时间较长、产率较低;随着温度的升高,反应时间减少,但随着温度升到120 ℃时,反应剧烈,副产物增多,导致目标产物产率降低.反应如下所示:

根据表2实验结果,继续对实验进行条件优化,在选择了实验温度为100 ℃基础上,在其他条件不变的情况下,对催化剂银盐(Entry 6-9)进行了筛选,如表3所示.
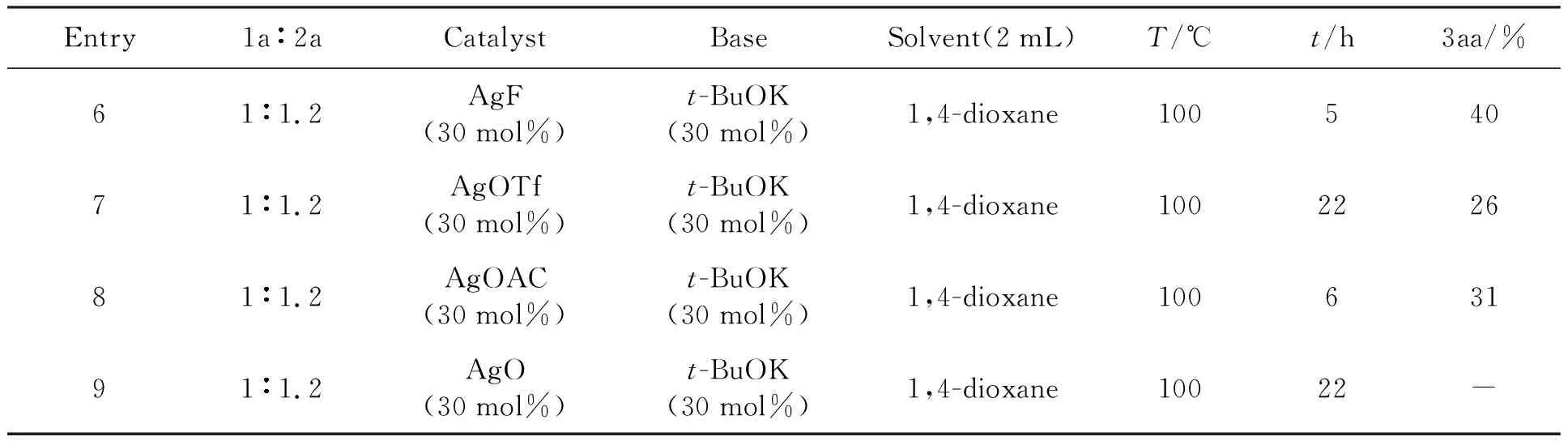
表3 银盐的筛选
反应条件:1a(0.2 mmol,1eq),2a(0.24 mmol,1.2eq),solvent(2 mL).
实验结果表明:碳酸银(Ag2CO3),实验条件较好.其原因是银与异氰基配位,活化了异氰基的反应性能,提高了反应活性,产率有所提高,其中以碳酸银为最优,其原因是碳酸银分解成的碳酸离子有助于异氰基乙酸乙酯中亚甲基位形成氢质子化.从而促进反应的进程,反应式为:

根据表3实验结果,继续对实验进行条件优化,在选择了实验温度为100 ℃,催化剂为碳酸银(Ag2CO3)基础上,在其他条件不变的情况下,对碱(Entry 10-17)进行了筛选,如表4所示.

表4 碱的筛选
反应条件:1a(0.2 mmol),2a(0.24 mmol),solvent(2 mL).
实验结果表明:碱选择叔丁醇钾t-BuOK,实验条件较好.随着路易斯碱的碱性加强,强化了异氰乙酸乙酯α-位反应〗位点的酸性,增强了其反应性能,提高了产率,反应式为:

根据表4实验结果,继续对实验进行条件优化,在选择了实验温度为100 ℃,催化剂为碳酸银(Ag2CO3),碱为叔丁醇钾t-BuOK基础上,在其他条件不变的情况下,对溶剂(Entry18-22)进行了筛选,如表5所示.
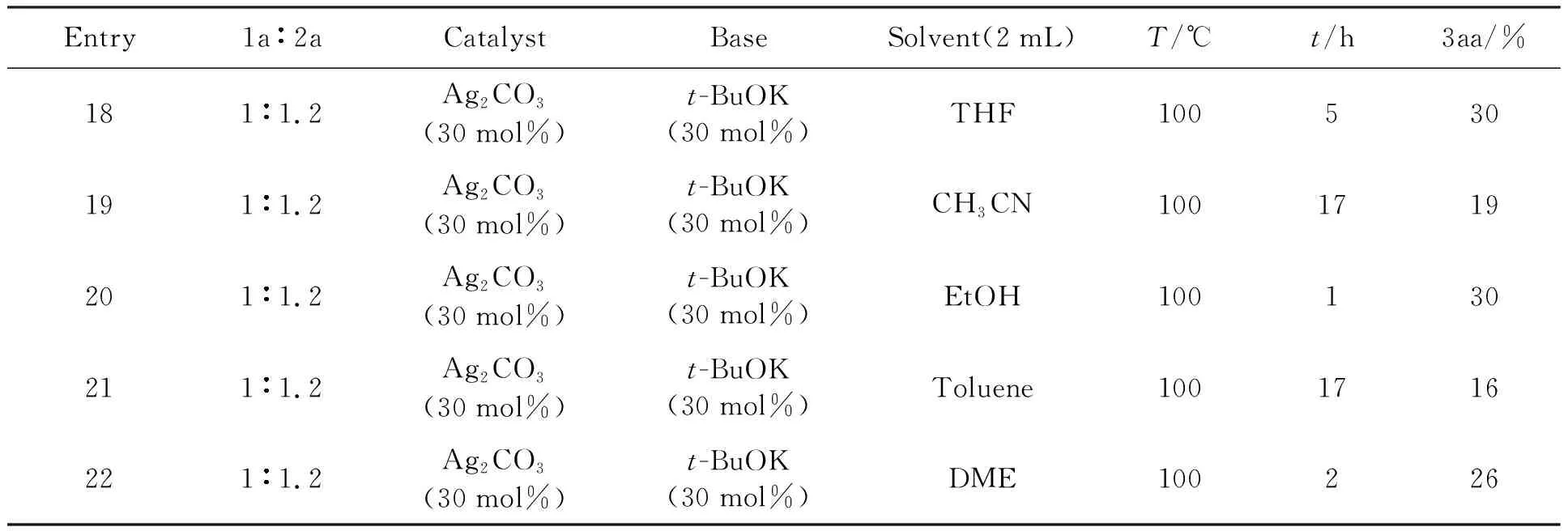
表5 溶剂的筛选
反应条件:1a(0.2 mmol),2a(0.24 mmol),solvent(2 mL).
实验结果表明:与烷烃类(DME)溶剂、醇类(EtOH)溶剂以及腈类(CH3CN)溶剂相比较,醚类溶剂1,4二氧六环(1,4-dioxane)产率较好,反应式如下所示:

根据表5实验结果,继续对实验进行条件优化,在选择了实验温度为100 ℃,催化剂为碳酸银(Ag2CO3),碱为叔丁醇钾t-BuOK,溶剂为1,4二氧六环(1,4-dioxane)基础上,在其他条件不变的情况下,对碳酸银(Ag2CO3)的量(Entry 23-26)和叔丁醇钾t-BuOK的量(Entry 27-29)进行了筛选,如表6所示.
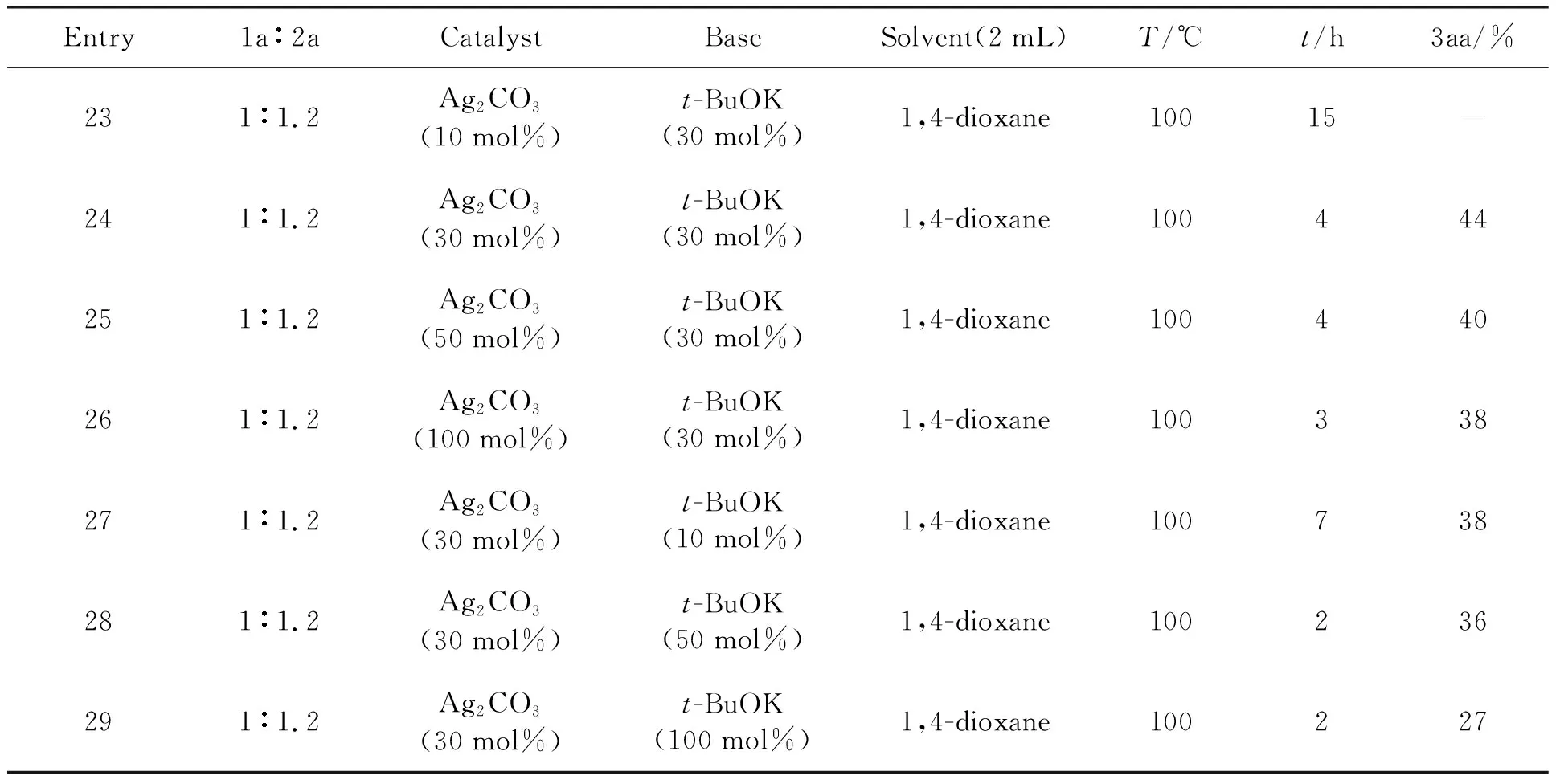
表6 银量、碱量筛选
反应条件:1a(0.2 mmol),2a(0.24 mmol),solvent(2 mL).
实验结果表明:碳酸银(Ag2CO3)量为30 mol%,t-BuOK量为30 mol%,实验条件较好.
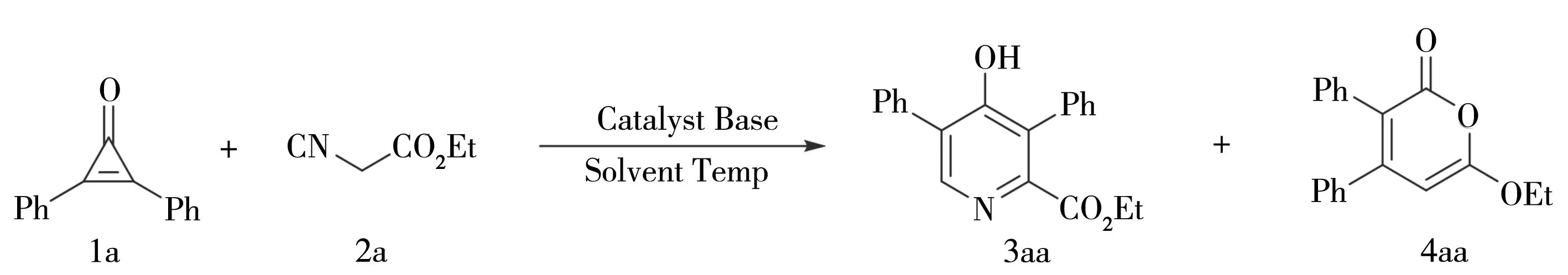
除此之外,在对该实验继续优化时,发现在铜盐与碱搭配催化时,没有生成4-羟基类化合物,而是生成的另外一种单一的产物4aa(6-乙氧基-3,4-二苯基-2H-吡喃).通过实验优化(Entry 30-35),在Cu2O(10 mol%),Cs2CO3(30 mol%),25 ℃时((Entry 35)就可以得到较高的产率,如表7所示.
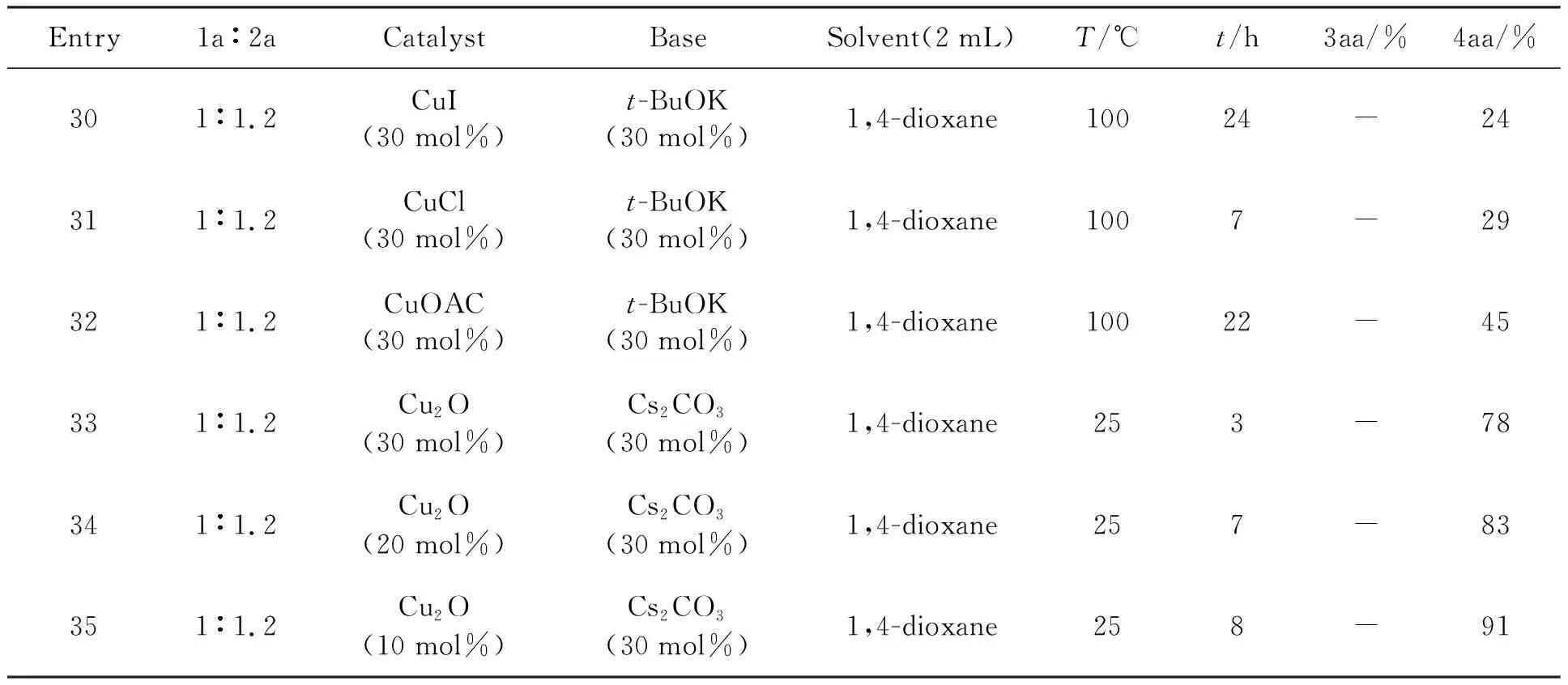
表7 铜盐以及含量的筛选
反应条件:1a(0.2 mmol),2a(0.24 mmol),solvent(2 mL).
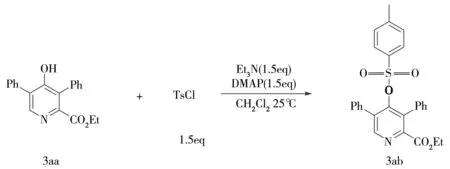
3 单晶3ab化合物生成实验步骤
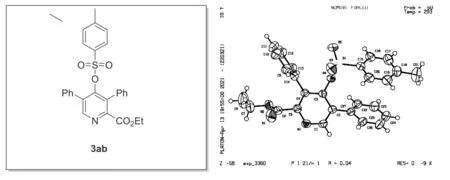
为了证实产物3aa的结构,将产物3aa进行酰化生成3,5-二苯基-4-(甲苯磺酰氧基)吡啶甲酸乙酯(3ab),实验步骤如下:

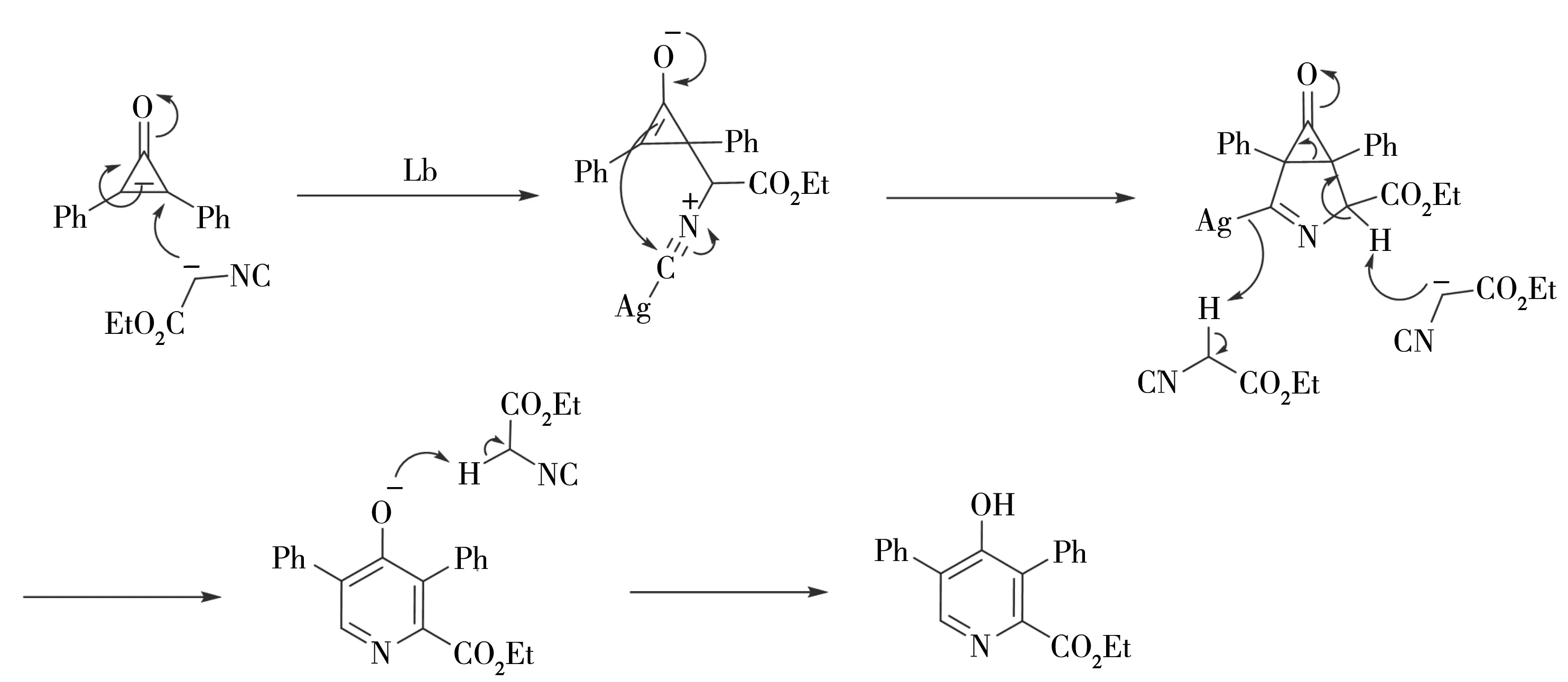
4 机理探讨
根据实验的结果,并参考相关文献,提出异氰基乙酸乙酯与环丙烯酮[3+3]环合成产物4-羟基-3,5-二苯基吡啶甲酸乙酯3aa可能的机理如下:
5 化合物的结构表征
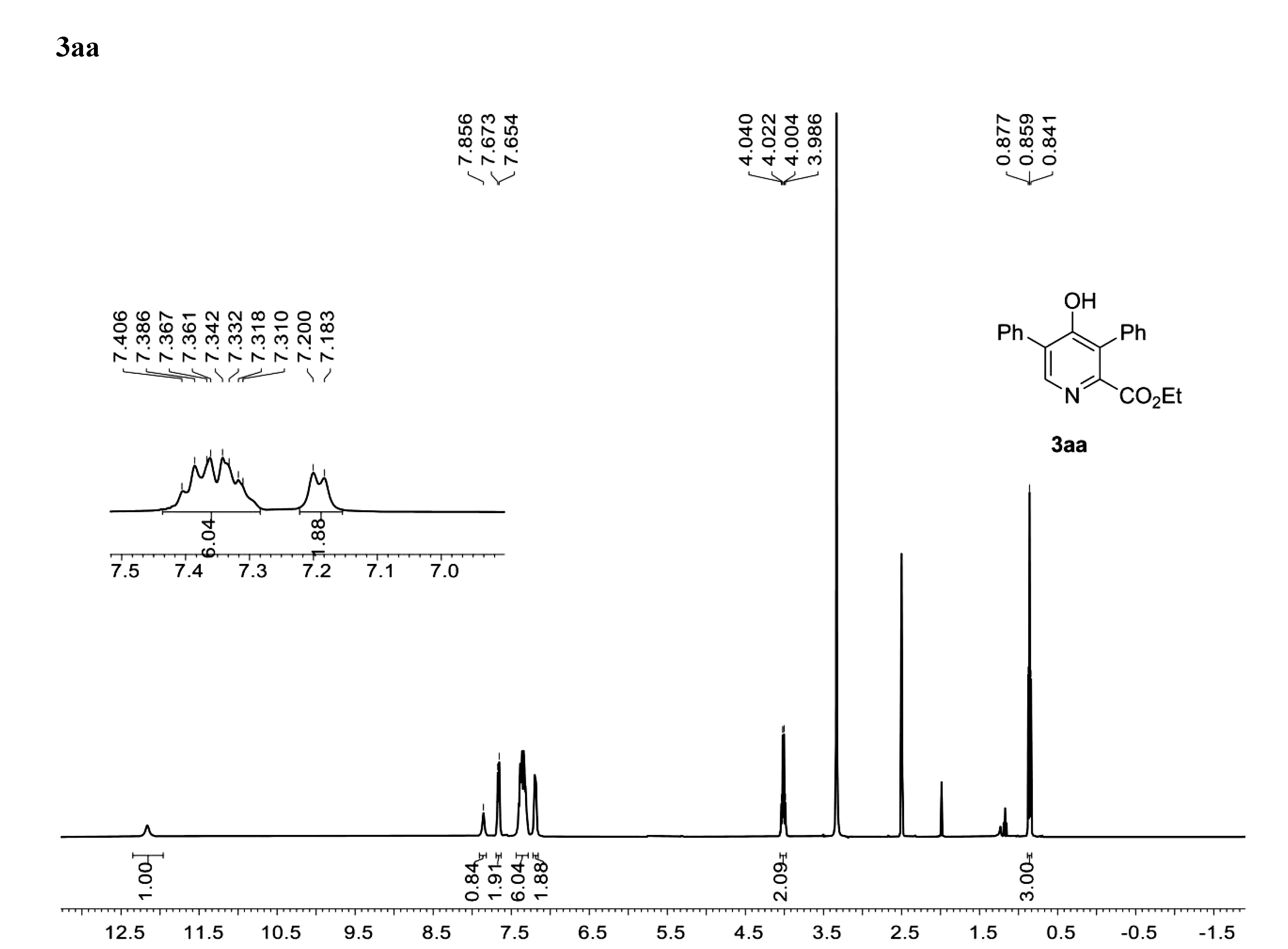
3aa,Ethyl 4-hydroxy-3,5-diphenylpicolinate:White solid,44% yield,28 mg.
1H NMR(400 MHz,DMSO-d6)δ12.16(s,1H),7.86(s,1H),7.66 (d,J=7.6 Hz,2H),7.41-7.31(m,6H),7.19 (d,J=7.2 Hz,2H),4.01(q,J=7.2 Hz,2H),0.86 (t,J=7.2 Hz,3H).HRMS(ESI-TOF) m/z calculated for C20H17NaNO3+([M+Na]+) 342.1011,found 342.1018.
3ab,Ethyl 3,5-diphenyl-4-(tosyloxy)picolinate:White solid,60% yield,57 mg.
1H NMR(400 MHz,CDCl3)δ8.59 (s,1H),7.34(dd,J=6.8,2.8 Hz,2H),7.25(td,J=5.0,2.8 Hz,8H),7.01-6.97(m,2H),6.82(d,J=8.1 Hz,2H),4.05(q,J=7.2 Hz,2H),2.25(s,3H),0.96(t,J=7.2 Hz,3H).HRMS(ESI-TOF) m/z calculated for C27H23NaNO5S+([M+Na]+) 496.118 9,found 496.119 7.
附图:
1H NMR (400 MHz,DMSO) for 3aa
1H NMR (400 MHz,CDCl3) for 3ab
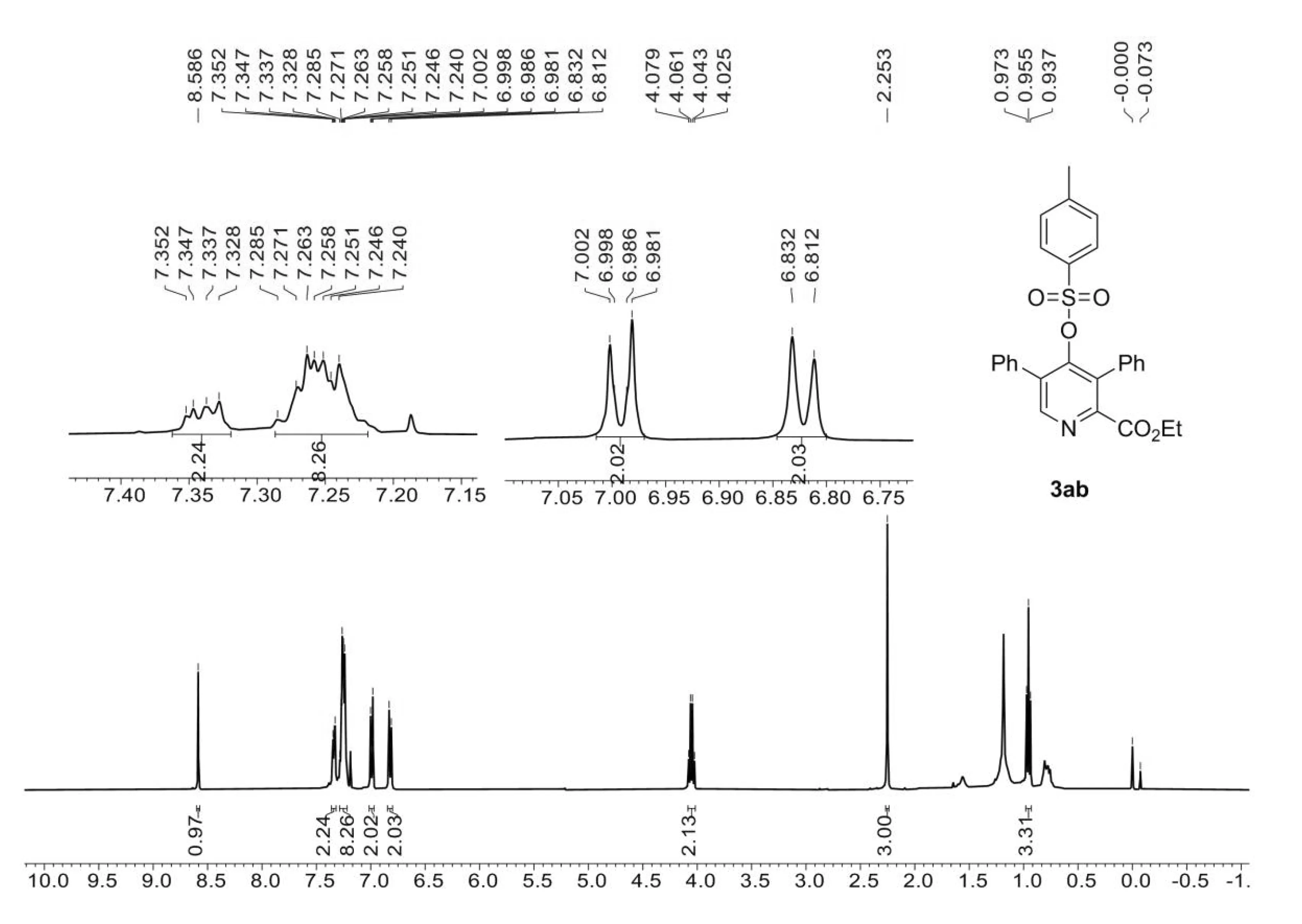
吡啶化合物3ab单晶数据
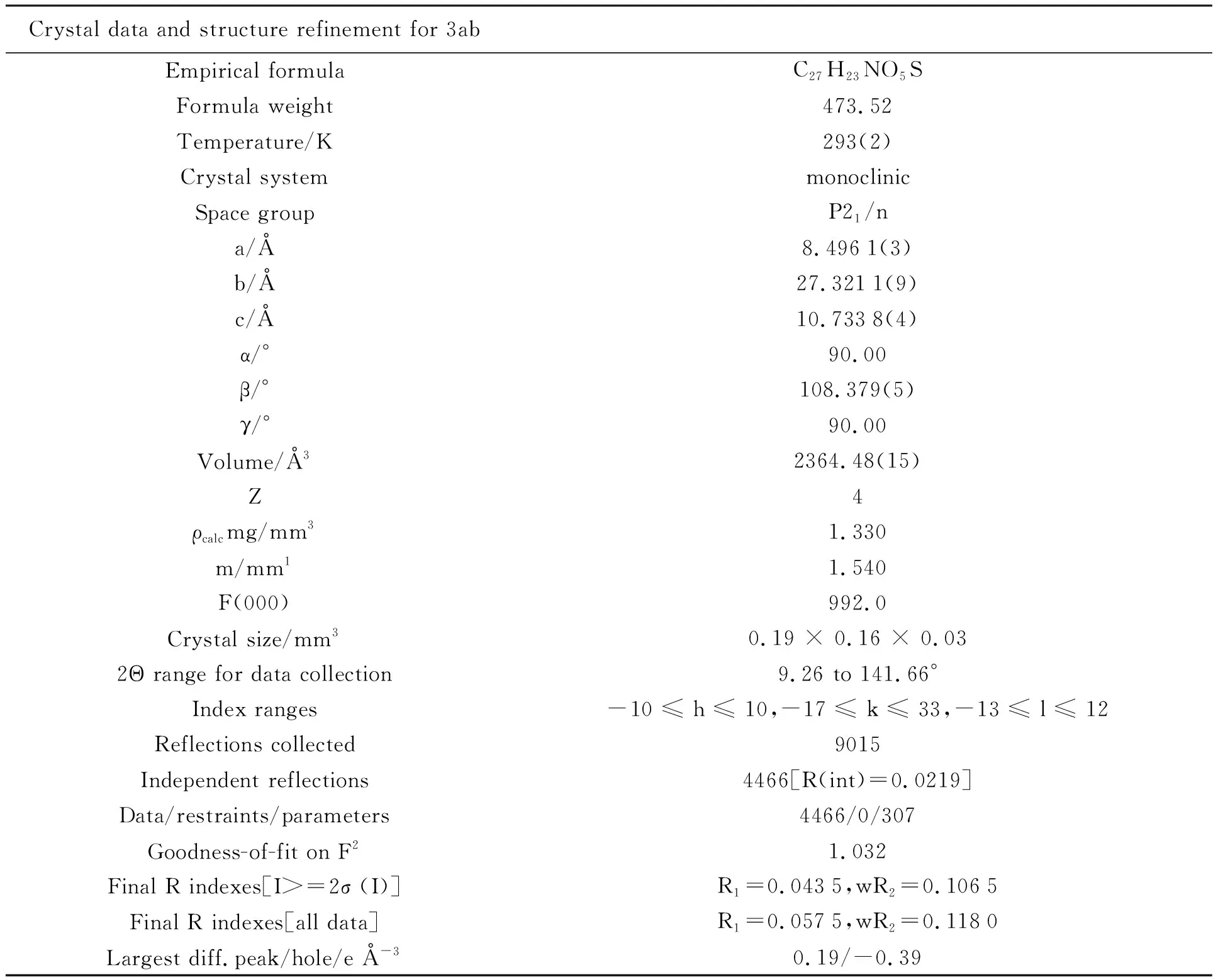
Crystal data and structure refinement for 3abEmpirical formulaC27H23NO5SFormula weight473.52Temperature/K293(2)Crystal systemmonoclinicSpace groupP21/na/Å8.4961(3)b/Å27.3211(9)c/Å10.7338(4)α/°90.00β/°108.379(5)γ/°90.00Volume/Å32364.48(15)Z4ρcalcmg/mm31.330m/mm11.540F(000)992.0Crystal size/mm30.19 × 0.16 × 0.032Θ range for data collection9.26 to 141.66°Index ranges-10 ≤ h ≤ 10,-17 ≤ k ≤ 33,-13 ≤ l ≤ 12Reflections collected9015Independent reflections4466[R(int)=0.0219]Data/restraints/parameters4466/0/307Goodness-of-fit on F21.032Final R indexes[I>=2σ (I)]R1=0.0435,wR2=0.1065Final R indexes[all data]R1=0.0575,wR2=0.1180Largest diff.peak/hole/e Å-30.19/-0.39
6 结 论

