规模化奶牛场犊牛腹泻产气荚膜梭菌的分离与鉴定
2021-10-23秦玉明李伟杰许冠龙沈青春杜吉革谢士杰孙石静丁家波范学政
秦玉明,李伟杰,许冠龙,沈青春,杜吉革,谢士杰,孙石静,丁家波,范学政,董 浩
(1.中国兽医药品监察所,北京 海淀 100081;2.中国动物疫病预防控制中心,北京 大兴 102600)
产气荚膜梭菌(Clostridiumperfringens,C.perfringens)是一种革兰氏阳性条件致病菌,广泛存在于人和动物的各种自然环境以及胃肠道中[1]。这种细菌与多种人类和动物的系统性和肠道疾病有关。在人体内,产气荚膜梭菌可引起气性坏疽[2]、食物中毒[3]、胃肠紊乱[4]、肝和肾损害等疾病[5-6]。产气荚膜梭菌可导致2周内新生儿患败血症而死亡[7]。
产气荚膜梭菌是动物坏疽性皮炎[8]、肠毒血症[9]和坏死性肠炎的主要病原体[10-11]。同时该菌也是牛乳房炎的主要病原之一,会导致奶牛产奶量下降、过早淘汰奶牛等,引起巨大的经济损失[12]。在我国20世纪80年代就有犊牛发生产气荚膜梭菌病的报道[13-14]。自20世纪90年代以来,产气荚膜梭菌引起的腹泻病日趋严重,发病地区也不断扩大。目前已广泛分布于全国各地,严重危害畜牧业的发展[15]。产气荚膜梭菌作为一种可引起多种疾病的人兽共患病病原体,近年来在全球受到越来越多的关注[16]。
2019年10月,某规模化奶牛场1头3月龄犊牛出现腹泻、拉血便等症状,引起驻场兽医重视。本试验采集腹泻犊牛和同群犊牛血清及肛门拭子样品、大罐奶样品,进行常见腹泻病原检测、细菌分离鉴定、毒力因子多重PCR分型等,最终确诊造成该牛场发病的病原为A型产气荚膜梭菌。并用多位点序列分型(Multi-locus sequence typing,MLST)技术对分离株进行了菌群结构分析。本研究可为规模化奶牛场预防产气荚膜梭菌感染引起的犊牛腹泻提供一定参考。
1 材料与方法
1.1 样品采集 采集腹泻犊牛和同群犊牛血清及肛门拭子样品各15份。大罐奶样品100 mL,迅速放入含冰袋的泡沫箱带回实验室,24 h内进行检测。
1.2 主要试剂 犊牛腹泻五联检测试纸条[轮状病毒+冠状病毒+大肠杆菌F5(K99)+隐孢子虫、产气荚膜梭菌,货号:BioK396],购自青岛瑞尔生物技术有限公司;牛病毒性腹泻病毒(BVDV)抗原检测试剂盒(货号:99-43830),购自IDEXX公司;产气荚膜梭菌选择性培养基(货号:PF652),购自上海欣中生物工程有限公司;5%马血清TSA培养板(每升含硫酸卡那霉素12.0 mg,多黏菌素B 3 mg),实验室制备。
1.3 毒力基因多重PCR和MLST引物 序列均参考文献[17-18],由生工生物工程(上海)股份有限公司合成,用TE缓冲液稀释备用。
1.4 对照菌 A型(CVCC37)、B型(CVCC53)、C型(CVCC57)、D型(CVCC82)和E型(CVCC90),均来自中国兽医微生物菌种保藏管理中心(CVCC)。同时从GenBank中下载部分序列用于比较分析(表1)。

表1 参考菌株来源Table 1 Origin of reference strains
1.5 方法
1.5.1 病原检测 应用犊牛腹泻五联检测试纸条对15份肛门拭子和大罐奶样品进行检测,用BVDV抗原检测试剂盒对15份血清样品进行检测,均按照各自说明书进行操作。
1.5.2 产气荚膜梭菌分离培养 将15份肛门拭子样品各用1 mL生理盐水混悬,取150 μL混悬液涂布于产气荚膜梭菌选择性培养基平板,倒放于厌氧罐中,37 ℃培养箱中培养48 h;48 h后各取1个典型桔红色菌落于产气荚膜梭菌选择性培养基平板上划线,倒放于厌氧罐中,37 ℃培养箱中培养24 h;取典型桔红色菌落涂布于5%马血清TSA培养板,倒放于厌氧罐中,37 ℃培养箱中培养24 h;次日用无菌生理盐水洗脱,80 ℃灭活1 h后12 000 r/min离心2 min,取上清于-40 ℃冻存备用。将100 mL大罐奶分装至50 mL离心管,8 000 r/min离心15 min,弃乳液,取沉淀涂布于产气荚膜梭菌选择性培养基平板,按肛门拭子样品的处理方法培养和克隆。
1.5.3 毒力基因多重PCR分型鉴定 取克隆纯化后的菌落灭活,取上清及对照菌DNA,按文献[17]进行分型PCR。
1.5.4 MLST分析菌群结构 3个阳性样品各取1个 典型克隆灭活,取上清及对照菌DNA按文献[18]进行MLST PCR。PCR产物送生工生物工程(上海)股份有限公司测序。将双向测序获得的8个看家基因序列,由DNASTAR 8.0 软件拼接组装,并在拼接时进行校正,所有基因均与NCBI下载的12条参考序列进行比对,并修整为相等的长度。之后,将所有检测基因序列(FASTA格式)导入Bionumerics软件(Applied Maths Inc.,Austin,TX)进行MLST分析。
2 结果
2.1 病原检测 对15份肛门拭子和大罐奶样品用犊牛腹泻五联检测试纸条进行检测,结果显示,所有样品均未检出轮状病毒、冠状病毒、大肠杆菌F5(K99)、隐孢子虫,而只有腹泻犊牛产气荚膜梭菌呈弱阳性;对15份血清样品用BVDV抗原检测试剂盒检测,结果全部为阴性。说明产气荚膜梭菌是引起此次犊牛腹泻的主要病原。
2.2 产气荚膜梭菌的分离培养 经产气荚膜梭菌选择性培养基厌氧培养和克隆,腹泻犊牛及同群犊牛共3份肛门拭子样品培养物产生典型的桔红色产气荚膜梭菌菌落(阳性率为3/15=20.0%)。而大罐奶未分离到产气荚膜梭菌。说明大罐奶中产气荚膜梭菌污染风险较低,带菌量少,成年泌乳奶牛患病风险不大。
2.3 毒力基因分型PCR鉴定 取3份阳性样品的典型菌落进行增菌培养。经毒力基因分型PCR鉴定,3个样品的克隆菌均为A型产气荚膜梭菌(图1)。说明A型产气荚膜梭菌是导致该牛场犊牛腹泻的主要毒素型。
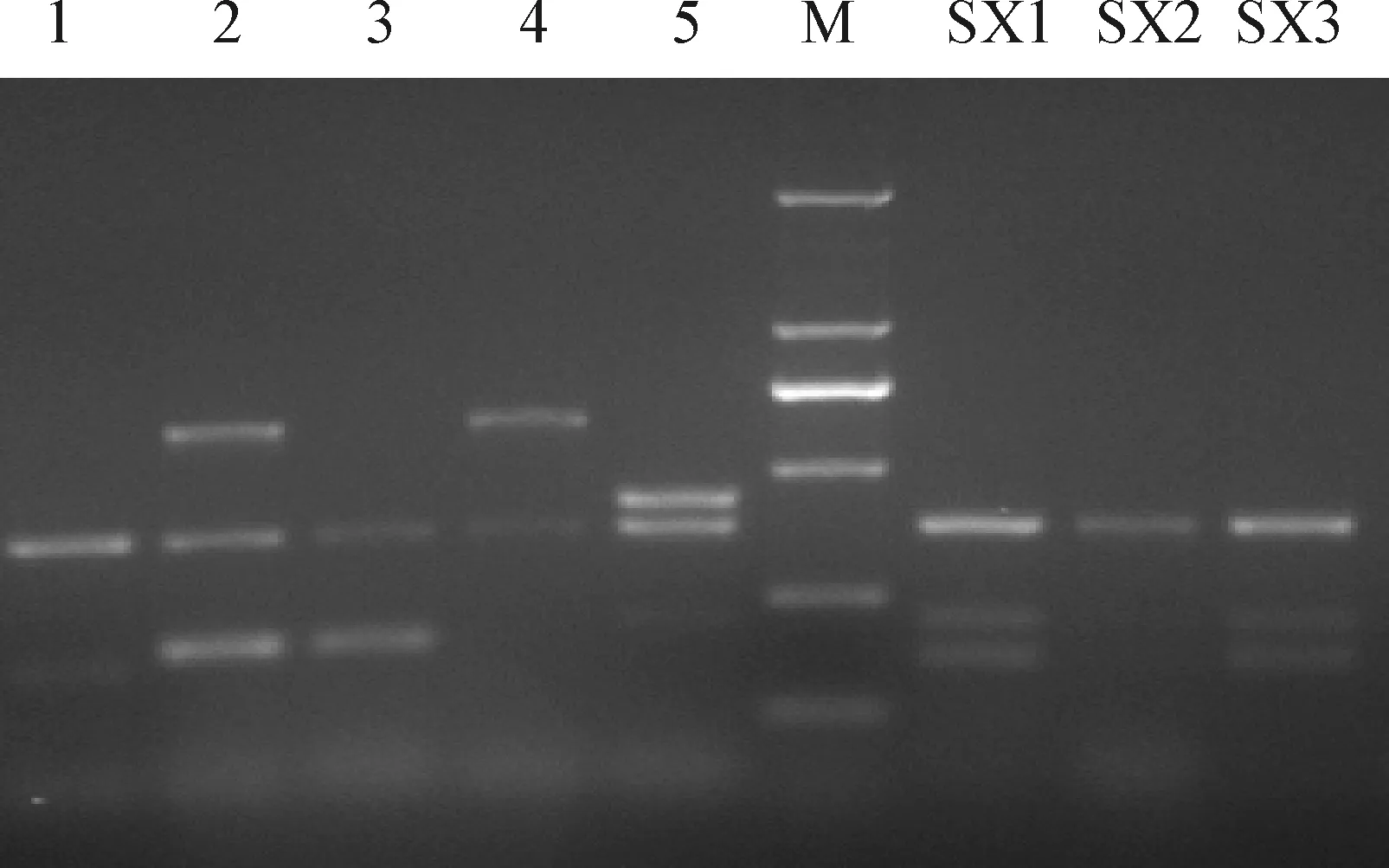
图1 克隆菌毒力因子多重PCR鉴定Fig.1 Clones identification of virulent gene by multiplex PCR1~5:A、B、C、D、E型对照;SX1~SX3:克隆株;M:DL2 000 marker(2 000,1 000,750,500,250,100 bp)1-5:Control of A,B,C,D,E genotype;SX1-SX3:Clone strains;M:DL2 000 marker(2 000,1 000,750,500,250,100 bp)
2.4 MLST分析菌群结构 将3个阳性克隆菌、5个对照菌及来自NCBI的12个菌株的8 个等位基因序列用Bionumerics 软件进行MLST分析(图2)。结果表明,3个克隆并不在同一分支。SX1克隆(来自腹泻牛)与ATCC13124、Del1、CVCC37、JXJA17株在同一分支,而这个分支数量最多(5株),且均为气性坏疽或坏死性肠炎的致病株,而SX2(来自健康牛)与EHENE18、Str13在同一分支,SX3(来自健康牛)、LLYN11、JP838、CBA7123均自成一支。表明该牛场产气荚膜基因型较为复杂。

图2 不同菌株MLST分析Fig.2 MLST clustering analysis of different strains
3 讨论
产气荚膜梭菌是典型的条件性致病菌,在健康牛的肠道和畜舍环境中均普遍存在,通常情况下并不致病。但它可通过污染的土壤、水、灰尘、饲料、垫草、器具等传播。当饲料、气候等条件发生急剧改变时,由于牛的抵抗力下降,在应激条件下,牛肠道内的正常菌群失调,微生态平衡被打破,原有的产气荚膜梭菌就会大量生长繁殖,瞬间产生大量的毒素会进入犊牛血液循环,发生毒血症(或败血症),引起对心脏、肝脏、肾脏和脑等重要器官的毒害,导致机体衰竭、死亡。
产气荚膜梭菌目前分为A、B、C、D、E共5个毒力型[1],各型产气荚膜梭菌均能引起牛产气荚膜梭菌病,尤以A、C、D型居多。国外报道的产气荚膜梭菌病以C、D型菌导致牛的坏死性肠炎或肠源性毒血症较多;我国产气荚膜梭菌则以A型菌为主,也时有C和D型菌致病的报道。
本次发病的牛场经犊牛腹泻五联检测试纸条进行检测结果表明,只有腹泻犊牛肛门拭子检测呈弱阳性结果,而其他健康牛均未检出,而分离培养时,腹泻牛和2头健康牛分离到了产气荚膜梭菌,说明健康牛粪便中带菌量较低。根据这一结果推测,引起犊牛发病与带菌量有一定关系。对3株分离菌进行毒素基因多重PCR鉴定均为A型菌。进一步对3株分离菌进行MLST菌群分析,结果却不在同一分支。这一结果说明牛场中产气荚膜梭菌基因型存在多态性。因产气荚膜梭菌并不作为引种时的检疫项目,这一现象需引起更多的关注。
因产气荚膜梭菌可引起人的食源性疾病,本试验同步检测了该场大罐奶,但未分离到产气荚膜梭菌,说明大罐奶中产气荚膜梭菌污染风险较低。尽管如此,仍然不能忽视产气荚膜梭菌对乳制品的污染风险。
目前牛的产气荚膜梭菌病主要靠药物治疗,还没有专门用于牛的产气荚膜梭菌疫苗,因此采取综合预防措施非常重要。一方面提高动物的抵抗力和改善饲养环境,同时还要加强采奶环节的卫生管理、屠宰场的卫生管理,尽可能降低终产品中产气荚膜梭菌的污染风险。

致谢:本文MLST分析由Bionumetrics金云台公司崔箐坡博士协助完成。
