海藻酸钠磁球制备及对亚甲基蓝的吸附研究
2021-10-23舒世立赵红丽
和 芹,陈 伟,舒世立,赵红丽
(唐山师范学院 化学系,唐山市绿色专用化学品实验室,河北 唐山 063000)
染料普遍具有颜色深、毒性高和降解难等特点,并且易致癌、致畸变、致基因突变.如果染料废水不加处理直接排放,将会对人类健康和生态环境造成极大威胁.目前染料废水处理方法主要有: 催化降解法[1-2]、化学氧化法[3]、生物法[4-5]和吸附法[6-8]等.其中,吸附法因为低成本、易操作的特点而成为最常用的处理方法之一,然而吸附法普遍存在吸附后分离困难,易造成二次污染的缺点,因此发展新型高效、易分离吸附的材料是极为必要.将磁性铁氧化物与石墨烯[9]、碳纳米管[10-12]、有机高分子材料[13-20]结合后所得的磁性材料兼具高吸附性能和易分离的特点,其中,高分子类磁性吸附材料因为普遍具有较高吸附量、吸附完成后能快速分离而成为研究热点之一.例如: 2018年,Ma等[21]以氧化石墨烯为载体,FeSO4·7H2O和FeCl3·6H2O为铁源,β-环糊精为改性剂制备β-环糊精改性磁性氧化石墨烯复合材料(β-CD / MGO),在298 K下对亚甲基蓝的最大吸附量为93.97 mg /g.但目前氧化石墨烯材料成本较高,这在一定程度上限制了其进一步的广泛应用.Mahmoud等[22]制备了Fe3O4/ 邻苯二胺/醋酸纤维(Fe3O4/PDA /CA)纳米粒子,发现当吸附剂用量为30 mg时,随着溶液pH增加(1~7),对质量浓度为10 mg/L的亚甲基蓝废水的去除率由55.8%增加至88.54%,对质量浓度为50 mg/L和100 mg/L的亚甲基蓝废水也存在类似趋势,分别由45.5%增至84.8%和由42.56%增至76.45%.虽然该纳米材料可以有效去除水中的亚甲基蓝,但材料制备过程需要用到甲醛、二甲基甲酰胺和甲苯等对环境污染较大的有机溶剂,不利于环境保护.因此,发展原料价廉易得、绿色环保、制备过程简单易行的材料具有重要意义.
海藻酸钠是存在于褐藻中的一种线性多羟基天然高分子多糖,来源广泛、成本低廉、环境友好,可以与二价及以上金属离子、戊二醛、环氧氯丙烷等交联,得到海藻酸钠水凝胶,该水凝胶可应用于废水处理方面[23-26].
但单一海藻酸钠的吸附能力有限,为此对其进行相关改性研究是很必要的.十二烷基苯磺酸钠(LAS)是一种阴离子表面活性剂[27],在酸性条件下会电离出十二烷基苯磺酸根,能够通过静电作用吸附溶液中的阳离子,起到增强吸附的作用.本研究首先制备磁流体Fe3O4,再通过海藻酸钠、LAS混合液与Fe3O4磁流体在搅拌的条件下均匀混合,并以CaCl2交联制得海藻酸钠磁球吸附剂.以持久性有机偶氮类染料亚甲基蓝为研究对象,通过静态吸附的方法,吸附溶液中的亚甲基蓝,考察吸附时间、溶液质量浓度、pH值和磁球加入量等因素对吸附效果的影响,探索吸附亚甲基蓝的最佳吸附条件;并对其吸附进行探讨,旨在为该类型合成材料的后续应用提供参考依据.
1 实验部分
1.1 材料和仪器
FeCl2·3H2O(天津市光复精细化工研究所);聚乙二醇,聚氧乙烯辛基苯酚醚-10(OP-10),FeCl3·6H2O和十二烷基苯磺酸钠(LAS)购于天津市大茂化学试剂有限公司;无水CaCl2和海藻酸钠购于天津市致远化学试剂有限公司,以上试剂均为分析纯;实验用水均为去离子水.
AR124CN电子天平(奥豪斯仪器有限公司);JJ-1精密定时电动搅拌器(江苏省金坛市荣华仪器制造有限公司);SHA-C水浴恒温振荡器(金坛市荣华仪器制造有限公司);SCIENTZ-18N冷冻干燥剂机(宁波新芝生物科技股份有限公司),首先预冷30 min,然后将磁球置于干燥盘中干燥24 h;PHS-25雷磁数显pH计(上海精密科学仪器有限公司);TENSOR37傅里叶红外光谱仪(德国布鲁克光谱仪器公司);JAM-6610扫描电子显微镜(日本东京电子);UV2600紫外可见分光光度计(上海天美科学仪器有限公司);Squid-VSM磁性测量系统(美国量子公司),测试条件5T,常温.
1.2 磁球的制备与静态吸附
将摩尔比为2∶1的Fe3+与Fe2+溶于适量水中,加入1 mL OP-10和0.1 g聚乙二醇,搅拌20 min,以2 s一滴左右的滴速将50 mL浓度为0.16 g/mL的NaOH溶液逐滴滴加至铁盐混合液中,30 min内滴完,继续搅拌30 min后磁分离后,用去离子水洗至中性得到Fe3O4磁流体.取1.0 g海藻酸钠与0.15 g十二烷基苯磺酸钠,加去离子水溶解,加入3.4 g Fe3O4磁流体,机械搅拌30 min后将其用针管滴加到质量分数为3%的CaCl2交联剂中,陈化12 h,冷冻干燥后得到海藻酸钠磁球.
实验采用静态吸附法,在250 mL的碘量瓶中加入一定量的磁球和100 mL亚甲基蓝水溶液,用0.1 mol/L NaOH或盐酸调节溶液pH,一定温度下振荡至指定时间,分离,取上清液用紫外—可见分光光度计测量溶液中亚甲基蓝的质量浓度,吸附量、平衡吸附量和去除率.计算公式如下:
(1)
(2)
(3)
式中:Qt为t时刻吸附量,Qe为达到吸附平衡时吸附量,E为去除率;ρ0为溶液的初始质量浓度;ρt为t时刻溶液的质量浓度;ρe为平衡后溶液的质量浓度,mg/L;V为溶液体积;m为吸附剂质量.
为了保证问卷的有效信和可靠性,运用SPSS19.0对原始数据进行克朗巴哈α信度分析,重要性因子和绩效表现因子的α系数分别为0.918和0.957,表明相关感知特征项的内在一致性较好,问卷具有良好的测量信度,符合社会科学研究中的α系数的标准,适用于IPA分析.
1.3 表征方法
采用日本JAM-6610型扫描电子显微镜(SEM)观察样品表面形貌,采用德国TENSOR37型傅里叶红外光谱仪(FTIR)进行红外谱图分析.采用美国量子公司Squid-VSM磁性测量系统进行磁性分析.
2 结果与讨论
2.1 材料表征
2.1.1 红外光谱图分析

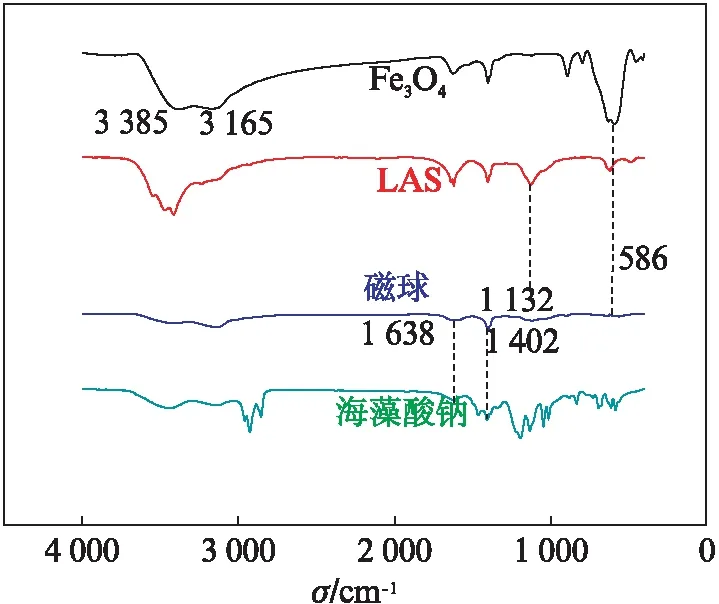
图1 Fe3O4,LAS,磁球与海藻酸钠的红外光谱Fig.1 FT-IR spectra of Fe3O4, LAS, magnetic balls and sodium alginate
2.1.2 磁性分析
磁性分析如图2所示: 磁滞回线呈“S”型,没有明显的滞后环,具有软磁特性,Fe3O4和磁球比饱和磁化强度分别为63.6、22.6 A·m2·kg-1,由于Fe3O4外层被包裹上一层非磁性的海藻酸钠聚合物,在一定程度上降低了Fe3O4的磁性.将磁球置于玻璃小瓶,加水,右置磁铁,2 s内磁球迅速聚集到磁铁一侧,体现出良好的磁响应特性,该磁球应用于水处理领域有利于磁球回收从而避免二次污染.
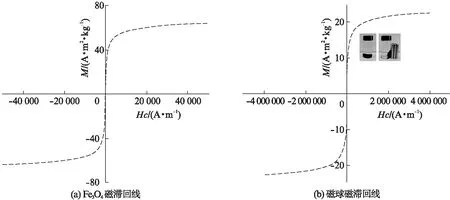
图2 磁性分析曲线(M为磁化强度,Hc为磁场强度)Fig.2 Magnetic analysis curve of Fe3O4(a) and magnetic balls (b), M is the magnetization and Hc is the magnetic field
2.1.3 SEM分析
图3为此磁球吸附亚甲基蓝前放大30倍和1 000倍及吸附后放大1 000倍的电镜图,吸附前磁球表面粗糙,凹凸不平,比表面积大,有利于表面对亚甲基蓝的物理吸附;吸附后的磁球外包裹了一层很厚的亚甲基蓝,表面粗糙程度明显降低,说明磁球对亚甲基蓝有较高的表面吸附量.

图3 海藻酸钠磁球的SEM图Fig.3 SEM image of magnetic balls
2.2 各因素对吸附量的影响
2.2.1 吸附时间
磁球对亚甲基蓝吸附速率的快慢,是评估一种新型吸附剂能否成功应用于实际废水处理的重要参数之一,往100 mL 100 mg/L(pH=6)的亚甲基蓝水溶液中,加入10 mg磁球,在25 ℃水浴振荡条件下考察吸附时间对吸附量的影响,如图4所示.随着吸附时间增加磁球对亚甲基蓝的吸附量逐渐增大.在前60 min 磁球对亚甲基蓝的吸附速率较快,在60 min时吸附量为367.1 mg/g,已达到平衡吸附量的53.8%.这主要是因为在吸附初期,磁球表面与溶液中的亚甲基蓝存在较大浓度梯度,且磁球表面活性吸附位点较多,所以在初始阶段吸附速率较快.随着吸附作用进行,溶液浓度梯度减小,传质驱动力减弱,并且亚甲基蓝逐步占据有限的结合区域,使吸附活性位减少,导致60~240 min吸附速率减缓.吸附时间大于240 min后,有限的区域全部被结合,吸附量不再增大,吸附达到平衡,之后再增加吸附时间,吸附量也基本保持不变,因此最佳吸附时间为240 min.

图4 吸附时间对吸附量的影响Fig.4 Effect of the contact time on the adsorption capacity
2.2.2 初始质量浓度
往100 mL pH=6的亚甲基蓝水溶液中加入10 mg磁球,25 ℃水浴振荡至吸附平衡,考察亚甲基蓝溶液初始质量浓度对吸附过程的影响,结果如图5所示.随着亚甲基蓝溶液的初始质量浓度变大,吸附量也随之增加,这是因为随着吸附液质量浓度增加,一方面质量传输驱动力相应增大,所以促进了磁球对目标污染物的吸附;另一方面,固定磁球用量,则其表面活性位点数目确定,当吸附液质量浓度较低时,磁球表面存在较多未被占据的活性位点,所以吸附量较小;随着吸附液质量浓度增加,未被占据的活性位点减少,吸附量增大;当吸附液质量浓度大于140 mg/L时,活性位点全部被占满,吸附量达到最大,为992.9 mg/g;此后再增加质量浓度,吸附量保持不变,故最佳初始质量浓度为140 mg/L.从总体上看,磁球对亚甲基蓝具有很好的吸附性能.

图5 亚甲基蓝溶液初始质量浓度对吸附量的影响Fig.5 Effect of the initial concentration of MB on the adsorption capacity
2.2.3 温度
在100 mL 140 mg/L(pH=6)的亚甲基蓝溶液中加入10 mg磁球,水浴振荡至吸附平衡,考察温度对吸附性能影响.如图6(见第536页)所示,随着温度升高吸附量降低,因此吸附过程为放热过程,常温下更有利于亚甲基蓝的吸附.尽管温度上升对吸附产生不利影响,但即使温度升高到40 ℃,吸附量仍高达737.0 mg/g,说明该磁球对亚甲基蓝有着极佳的吸附性能.
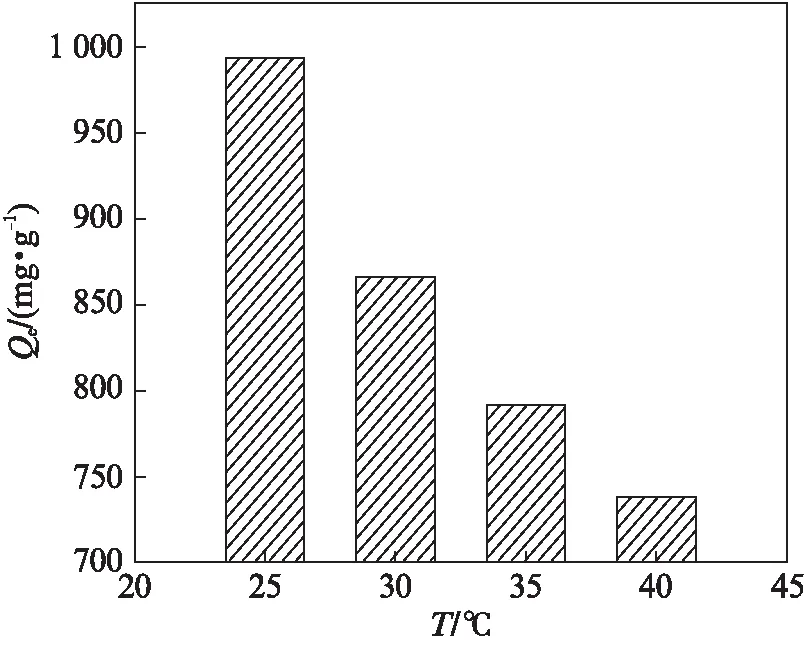
图6 温度对吸附量的影响Fig.6 Effect of the temperature on the adsorption capacity
2.2.4 pH
往100 mL浓度为140 mg/L的亚甲基蓝溶液中加入10 mg磁球,25 ℃水浴振荡至吸附平衡,考察溶液pH对吸附过程的影响(图7,见第536页).pH介于4~6之间,磁球的吸附量随pH的增加而略有增加,考虑主要是因为在酸性介质中,H+浓度较大,与阳离子型染料亚甲基蓝争夺吸附位点,导致吸附量降低.pH=3时,吸附量急剧下降,考虑除了竞争吸附之外,强酸性介质条件造成磁球发生一定程度的降解,导致吸附量迅速下降.pH介于6~9之间,吸附量基本保持不变,说明该磁球对亚甲基蓝有较宽的pH适用范围,有利于复杂pH环境下的废水处理,增加了该磁球在实际废水处理中应用的可行性.

图7 pH对吸附量的影响Fig.7 Effect of the pH on the adsorption capacity
2.2.5 磁球用量
25 ℃,在100 mL 140 mg/L(pH=6)的亚甲基蓝水溶液中分别加入10、20、30、40、50、55、60、65、70 mg的磁球,25 ℃下水浴振荡至吸附平衡,考察磁球加入量对吸附效果的影响,如图8(见第536页)所示.随着磁球加入量的增加,吸附量逐渐减小,由992.9 mg/g降低至187.1 mg/g.另一方面,对亚甲基蓝的去除率先快速增大,后趋于平缓上升.当磁球用量较小时,固液两相之间的传质推动力不足,实验中磁球加入量为10 mg时,去除率仅为71.6%;增大磁球加入量,可提供更多的吸附位点,因此去除率增加,当磁球加入量增至55 mg时,去除率达到92.2%,高于文献[22]的去除率(20 mL质量浓度100 mg/L,磁球用量(100.0±1.0) mg,去除率为89.9%);之后继续增大磁球加入量至70 mg,去除率仅增长1.4个百分点.因此从处理效果和经济角度出发,磁球使用量应选择55 mg.
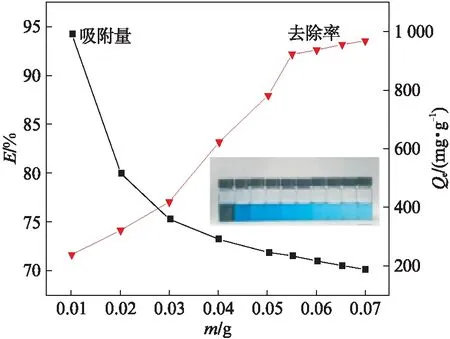
图8 磁球加入量对去除率的影响Fig.8 Effect of the mass on the magnetic balls adsorption capacity
2.2.6 磁球的重复利用
以0.05 mol/L的盐酸作为洗脱液,在25 ℃下对磁球脱附再生(图9).25 ℃下对100 mL 140 mg/L(pH=6)亚甲基蓝溶液(磁球10 mg)吸附量随着再生次数的增加而减弱,4次再生吸附量分别为971.3、850.0、811.5和740.6 mg /g.可见,磁球经过4次再生后仍具有较高的吸附量,可多次循环使用.
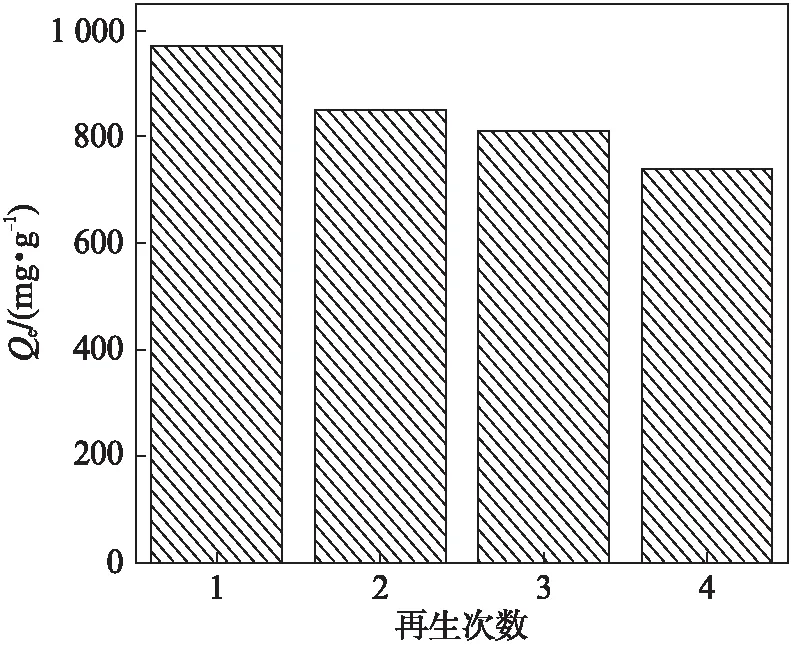
图9 不同再生次数下磁球的吸附量Fig.9 Adsorption capacities of magnetic balls at different regeneration cycles
2.3 吸附动力学的研究
为了探究吸附速率与吸附时间的关系,本实验对2.2.1中时间吸附量数据进行了吸附动力学模拟,Lagergren准一级动力学和准二级动力学以及韦伯-莫里斯粒子内扩散模型表达式分别为[27]:
ln(Qe-Qt)=lnQe-k1t,
(4)
(5)
Qt=kpt1/2+c,
(6)
式中:t为吸附时间,单位为min;c表示颗粒内扩散方程参数,单位为mg/g.
分别以ln(Qe-Qt)对t、t/Qt对t作准一级、准二级反应曲线,内扩散模型以Qt对t1/2作图,结果如图10所示.由图10可知,Lagergren准一级动力学相关系数为0.995,准二级动力学为0.986,但准一级动力学拟合平衡吸附量622.0 mg /g更接近于实验值682.6 mg /g,因此磁球吸附亚甲基蓝过程比较符合准一级动力学模型,主要属于物理吸附.
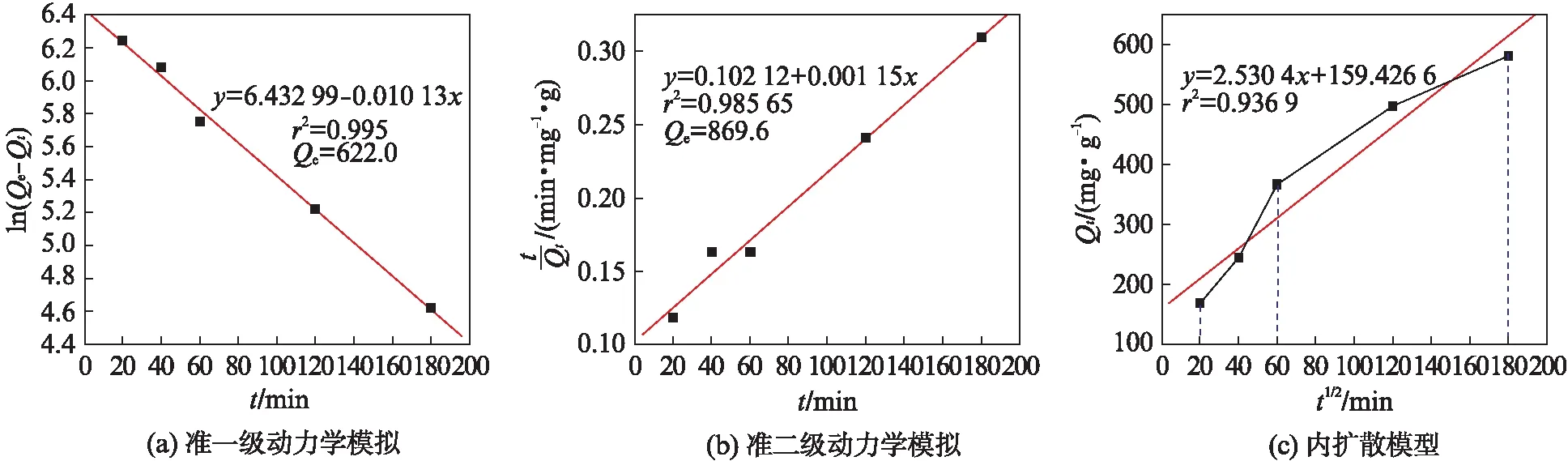
图10 吸附动力学模拟Fig.10 Adsorption kinetics simulation
图10(c)为粒子内扩散图,拟合直线分为2个阶段,分别是起始的快速吸附阶段和之后的逐渐吸附阶段.起始阶段与溶液中亚甲基蓝快速的外部扩散和表面吸附有关;而第二阶段则表示逐渐吸附阶段,亚甲基蓝会沿着磁球孔壁、孔道进一步向内部扩散,逐渐被吸附.对所有点进行拟合,拟合直线不过原点,说明内扩散不是唯一的限速步;截距c较高(159.426 6 mg/g),说明表面吸附对整个吸附过程的贡献很大.以上拟合结果显示磁球对亚甲基蓝的吸附是一个复杂的过程,涉及到表面吸附、内扩散和物理吸附;另外,磁球表面带有负电的磺酸基与带正电的亚甲基蓝阳离子间还存在静电吸引,所以还应存在一定的静电作用.
采用Langmuir和Freundlich吸附等温模型分别对数据进行线性拟合,通过拟合数据结果进一步了解该实验的吸附原理.Langmuir和Freundlich吸附等温式如下所示[28]:
(7)
(8)
式中:Qm为饱和吸附量,单位为mg/g;KL为Langmuir吸附平衡常数,单位为L/mg;KF为Freundlich常数,与磁球吸附能力有关,单位为L/g;n为磁球对亚甲基蓝的亲和力系数,与磁球对亚甲基蓝的吸附强度有关.
Langmuir与Freundlich等温吸附模型分别以ρe/Qe和ρe、lnQe和lnρe为坐标,对2.2.2中初始质量浓度数据进行线性拟合,拟合结果如图11所示.
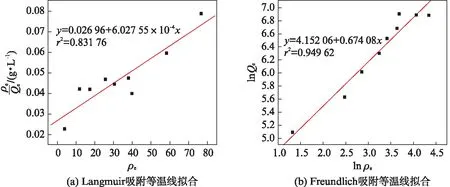
图11 吸附等温线拟合Fig.11 Adsorption isotherm fitting
Langmuir等温吸附模型的相关系数r2=0.831 76,而Freundlich等温吸附模型的r2=0.949 62,因此Freundlich等温吸附模型能更准确地描述吸附过程.磁球对亚甲基蓝的吸附不是单层的化学吸附,磁球异质性表面存在着复杂的吸附过程,n大于1,说明这是一个有利吸附的过程,磁球吸附性能良好.
3 结 论
以海藻酸钠为主要原料、CaCl2为交联剂、Fe3O4磁流体为磁性载体制备的海藻酸钠磁球在25 ℃,磁球用量为10 mg,100 mL浓度为140 mg/L的亚甲基蓝溶液,吸附240 min达到平衡,吸附量为992.9 mg/g;在pH=6.0~9.0的范围内,磁球有良好的pH适应范围,对亚甲基蓝具有较高的吸附性能;并且海藻酸钠磁球吸附亚甲基蓝为放热反应,室温条件下有利于吸附.当磁球加入量提高至55 mg,对亚甲基蓝的去除率可达到92.2%;4次洗脱再生后,磁球对亚甲基蓝的吸附量仍高达740.6 mg/g,有较好的可重复利用性,有望成为水环境中去除亚甲基蓝的高效、绿色吸附剂.磁球对亚甲基蓝的吸附动力学符合准一级动力学模型,主要是物理吸附;另外,等温吸附模拟结果显示Freundlich等温吸附模型更符合该吸附过程,属于非理想条件下的表面非均匀吸附,n=1.483 5,说明这是一个有利吸附的过程.
