高效氯氟氰菊酯聚多巴胺微胶囊悬浮剂对中华绒螯蟹非特异性免疫相关基因表达及肠道菌群的影响
2021-10-23黄银盈黄樱樱邹爱华赵云龙
焦 阳,李 娜,黄银盈,黄樱樱,邹爱华,赵云龙
(1. 华东师范大学 生命科学学院 上海 200241; 2. 国家蛋白质科学中心(上海),上海 201204;3. 华东理工大学 化学与分子工程学院,上海 200237)
农药在控制害虫、提高作物产量方面发挥至关重要的作用,然而过度使用农药给人类和环境带来了很大威胁[1-2].每年有数百万吨农药投入使用,约有90%的农药会流入环境,部分还会残留在农产品中[3-4].农药的低效使用导致了一系列问题,如土壤退化、生物多样性丧失等[5].因此有必要开发新型农药来缓解传统农药的不足.近些年来纳米科技发展迅速,利用纳米技术合成的纳米农药有广阔的应用前景[6].
纳米农药中,常用的农药缓释载体类型多样,以聚合物为基质的纳米材料,例如纳米微胶囊、纳米颗粒、胶体、凝胶;以脂质为基质的纳米材料,例如脂质体、固体纳米颗粒等[7-8].以上纳米缓释载体中,微胶囊(Microcapsule)作为缓释载体具有良好的效果,可以减少对环境的污染,载药量相对较高,因此微胶囊常用作纳米农药的缓释载体[9].
微胶囊由核-壳构成,其壳成分大多为聚合物或涂层[10].聚多巴胺(Polydopamine, PDA)是一种黑色素材料,因其良好的分散性、黏附性及相容性而在各领域具有很大的应用潜力[11],聚多巴胺作为药物缓释载体负载的紫杉醇和姜黄素体系在解决化疗产生的细胞耐药性上具有一定的应用前景[12].高效氯氟氰菊酯(Lambda Cyhalothrin, LC)以传统剂型为主,具有粉尘飘逸、分散性差等不足[13],制备高效氯氟氰菊酯缓释制剂已成为人们的关注点.本文所用农药是在已有研究基础上,以聚多巴胺作为缓释载体负载高效氯氟氰菊酯制备得到的高效氯氟氰菊酯聚多巴胺微胶囊悬浮剂(Lambda Cyhalothrin/Polydopamine-Microcapsule Suspension, LC/PDA-MS).
中华绒螯蟹是我国重要的淡水甲壳动物养殖物种,稻蟹种养模式是我国重要的水生经济动物养殖模式之一[14].商业推荐高效氯氟氰菊酯在稻田中的使用剂量为22.5 g/ha[15],纳米农药利用喷洒方式应用于稻田,是否会影响共养体系中水生生物的产量和安全是其中比较关键的问题.LC/PDA-MS对斑马鱼的毒性实验中,LC/PDA-MS较未使用缓释载体的高效氯氟氰菊酯(LC)毒性小,缓释载体起到了一定的降低毒性的作用[16].因此本文以水生经济养殖生物中华绒螯蟹为研究对象,选用LC/PDA-MS为纳米农药,研究不同浓度悬浮剂及空白悬浮剂对中华绒螯蟹非特异性免疫和肠道微生物丰度以及多样性的影响,以期为纳米农药在绿色生态农业生产养殖用量方面提供生物学依据.
1 材料和方法
1.1 实验材料
实验所用中华绒螯蟹于2019年3月购置于上海海洋大学崇明养殖基地,为避免性别造成的影响,只选用雌蟹进行实验.在正式实验前,选取600只健康有活力的雌性中华绒螯蟹(10.0±2.0) g放置于水族箱(48 cm×34 cm×26 cm)中暂养一周,密度为20只每箱,每个水箱放置15 L水,在水族箱底部放置PVC管作为遮蔽物,实验用水为充分曝气的自来水,水温为(19±1) ℃,pH为(7.6±0.5),24 h连续曝气,保持溶解氧在(6.2±0.6) mg/L范围内.在此期间,每天早上和晚上喂食一次,每48 h换一次水,及时清理蟹的排泄物,在正式实验前不喂食.
实验所用高效氯氟氰菊酯聚多巴胺微胶囊悬浮剂由华东理工大学提供.空白聚多巴胺微胶囊采用逐层组装法(LBL)合成,将空白干燥的空白聚多巴胺微胶囊放入N,N-二甲基甲酰胺(DMF)中用高效氯氟氰菊酯分散,磁力搅拌24 h获得高效氯氟氰菊酯聚多巴胺微胶囊[17],然后将分散剂、黄原胶、消泡水溶液混合,制备了2.5%的高效氯氟氰菊酯聚多巴胺微胶囊悬浮剂[16].
1.2 慢性毒性实验
选取18个水族箱(48 cm×34 cm×26 cm),加入高效氯氟氰聚多巴胺微胶囊悬浮剂和水配制成的不同浓度的溶液,每个水族箱中放入15 L水,20只中华绒螯蟹,根据半致死浓度(LC50=6.4 mg/L)以及文献中慢性毒性实验浓度设置比例,按照半致死浓度的1/500、1/100、1/50、1/10设置4个浓度组,另外设置对照组以及空白悬浮剂组(即不载有高效氯氟氰菊酯的聚多巴胺微胶囊悬浮剂),其浓度设置为半致死浓度的1/10,具体结果另文发表.实验期间养殖管理同暂养期间的环境保持一致,每48 h更换一次水溶液.定期记录中华绒螯蟹的生长、健康状况,分别于7 d、14 d、21 d取样分析.
1.3 样品制备
取样前,先饥饿处理24 h,每个水族箱中随机取2只中华绒螯蟹,解剖前用去离子水冲洗表面以去除残余农药,随后将中华绒螯蟹置于冰上麻醉,用一次性注射器于中华绒螯蟹幼蟹足基部抽取血淋巴,按1∶1的比例加入抗凝剂(柠檬酸8.42 g,柠檬酸钠3.52 g,NaCl 8.96 g,EDTA-Na20.74 g,双蒸水200 mL,pH 7.3~7.4),以3 500 r/min离心15 min,将血清和血细胞分离.随后用镊子和剪刀取肝胰腺、肠等组织放入2 mL离心管中,迅速放入液氮中,随后放入-80 ℃冰箱中保存备用.
1.4 Real-time qPCR检测
运用实时荧光定量PCR法(RT-qPCR)检测肝表达量,相关基因的引物序列如表1(见第464页)所示.剪取约30 mg肝胰腺组织和离心后的血细胞放置于无酶离心管中,加入RT plus裂解液,用试剂盒提取RNA(北京,艾德莱),其纯度和质量通过A260/A280检测,逆转录合成cDNA,其操作步骤按照试剂盒说明书进行(南京,诺唯赞).qPCR试剂盒使用TransStart®Top Green qPCR SuperMix (北京,全式金),20 μL的反应体系包括1 μL cDNA、上下游引物各0.4 μL、10 μL SYBR、8.2 μL ddH2O, 每一组设置3个重复,此反应体系置于96孔板中,使用qPCR仪(Bio-Rad, USA)检测,将程序设置为95 ℃ 30 s,40个循环95 ℃ 15 s,58 ℃ 30 s.

表1 用于RT-qPCR的引物序列
1.5 DNA提取
根据E.Z.N.A.®soil试剂盒(Omega Bio-tek, Norcross, GA, US)说明书对中华绒螯蟹对照组、0.60 mg/L和空白悬浮剂组的肠道进行DNA抽提,其纯度和浓度用NanoDrop2000(Thermo Fisher Scientific, Wilmington, DE, USA)进行检测.
1.6 PCR扩增及高通量测序
将提取到的DNA扩增利用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHV-GGGTWTCTAAT-3’)对V3~V4区域进行PCR扩增,扩增程序为: 95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共27个循环;最后72 ℃延伸10 min.将扩增产物回收利用Axyprep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 纯化,所得片段用QuantiFluorTM-ST (Promega, USA)进行定量检测,利用Illumina Miseq平台进行测序.
1.7 Illumina数据处理
获得的原始序列使用Trimmomatic软件质控,用Flash软件进行拼接.使用UPARSE软件,根据97%的相似度对序列进行OTU聚类,在聚类过程中去除单序列和嵌合体.
1.8 数据分析
荧光定量PCR数据采用2-ΔΔCt法计算免疫相关基因的表达量,所得数据采用Microsoft Excel 2007、SPSS 23和Graph pad 7分析,结果用平均值(Mean)±标准误(SEM)表示,若方差齐性,用单因素方差(One-way ANOVA)进行分析,运用Turkey对不同组间的均值进行差异性检验,显著水平设置为P<0.05;若方差不齐性,则运用Kruskal-Wallis进行检验,同时采用双因素方差分析各免疫基因在7 d、14 d、21 d之间的差异,显著水平设置为P<0.05.
2 结 果
经过21天慢性毒性实验,对中华绒螯蟹生长指标进行分析,发现对照组0.012 mg/L,0.06 mg/L,0.12 mg/L,0.60 mg/L及空白悬浮剂组对中华绒螯蟹的存活率分别为93.3%,92%,87%,87%,83%,95%.具体结果另文发表.
2.1 血细胞中免疫相关基因的表达量
LC/PDA-MS及空白悬浮剂对中华绒螯蟹血细胞中免疫相关基因的影响如图1(见第466页)所示.图1(a)显示,Propo基因在第7天,0.012 mg/L、0.06 mg/L组呈上升趋势且较对照组有显著性差异(P<0.05),其他组与对照组无显著差异;在第14天,0.012 mg/L、0.06 mg/L、0.12 mg/L组呈上升趋势(P<0.05);在第21天,0.06 mg/L组和空白悬浮剂组显著升高(P<0.05).图1(b)显示Caspase基因在7、14 d的表达量较对照组呈现上升趋势,在21天时,除0.06 mg/L组其他组与对照组均无显著性差异(P>0.05).图1(c)显示myD88基因在第7天随着浓度的增加,呈现上升趋势;随着时间的增加(14 d),myD88基因表达水平在0.012 mg/L、0.60 mg/L组较对照组呈下降趋势,其他组较对照组呈上升趋势且有显著性差异(P<0.05);在21 d,myD88基因呈现下降趋势,空白悬浮剂组与对照组无显著差异.图1(d)显示PPAF基因在第7天除0.60 mg/L组较对照组呈现上升趋势;在14 d,0.060 mg/L组显著低于对照组(P<0.05),其他组与对照组无显著差异;在21 d,空白悬浮剂组PPAF基因表达水平显著高于对照组(P<0.05),0.06 mg/L组较对照组呈现上升趋势但无显著性差异(P>0.05).图1(e)显示Crustin基因在7 d、14 d时0.06 mg/L组较对照组有显著性差异(P<0.05),在21 d时,Crustin基因呈现下降趋势,然而空白悬浮剂组较对照组呈上升趋势(P<0.05).溶菌酶基因LZM呈现先上升后下降的趋势,其中在7 d、14 d空白悬浮剂组与对照组相比均有显著性差异(P<0.05),如图1(f)所示.

图1 LC/PDA-MS处理后血细胞中免疫相关基因的表达量Fig.1 Effects of LC/PDA-MS exposure on the expression of immune genes in the haemocytes条形图上方的不同字母代表着处理组间存在着显著差异(P<0.05).
2.2 肝胰腺中免疫相关基因的表达量
LC/PDA-MS及空白悬浮剂对肝胰腺中免疫相关基因的表达量影响如图2(见第466页)所示.Propo和PPAF基因表达呈现相似的趋势,在7 d、14 d,各浓度处理组基因表达量与对照组相比呈现上升的趋势;在21 d,Propo基因在0.012 mg/L、0.06 mg/L、空白悬浮经济组较对照组表达量高且有显著性差异(P<0.05),PPAF基因表达量与对照组相比呈上升趋势,结果如图2(a)、(d)所示.Caspase基因表达量随着浓度的增加呈现上升趋势,且空白悬浮剂组在第7天有显著性差异(P<0.05),随着时间的延长(14 d、21 d),空白悬浮剂组与对照组无显著性差异,结果如图2(b)所示.在第7天,myD88基因在各浓度组较对照组均有显著性差异(P<0.05),在第14天、21天,随着浓度的增加,除空白悬浮剂组,其他各浓度组与对照组相比有显著性差异(P<0.05),结果如图2(c) 所示.Crustin基因在7 d时随浓度的增加基因表达水平升高,在14 d,除空白对照组外,其余各组较对照组有显著性差异(P<0.05),且在0.12 mg/L组达到峰值;在21 d,除0.6 mg/L组,其余各组较对照组呈上升趋势,结果如图2(e)所示.LZM基因表达量在7 d、14 d随浓度的增加而升高;在21 d,LZM基因表达量先升高后下降,且在0.12 mg/L、0.60 mg/L组与对照组相比显著下降(P<0.05),结果如图2(f)所示.
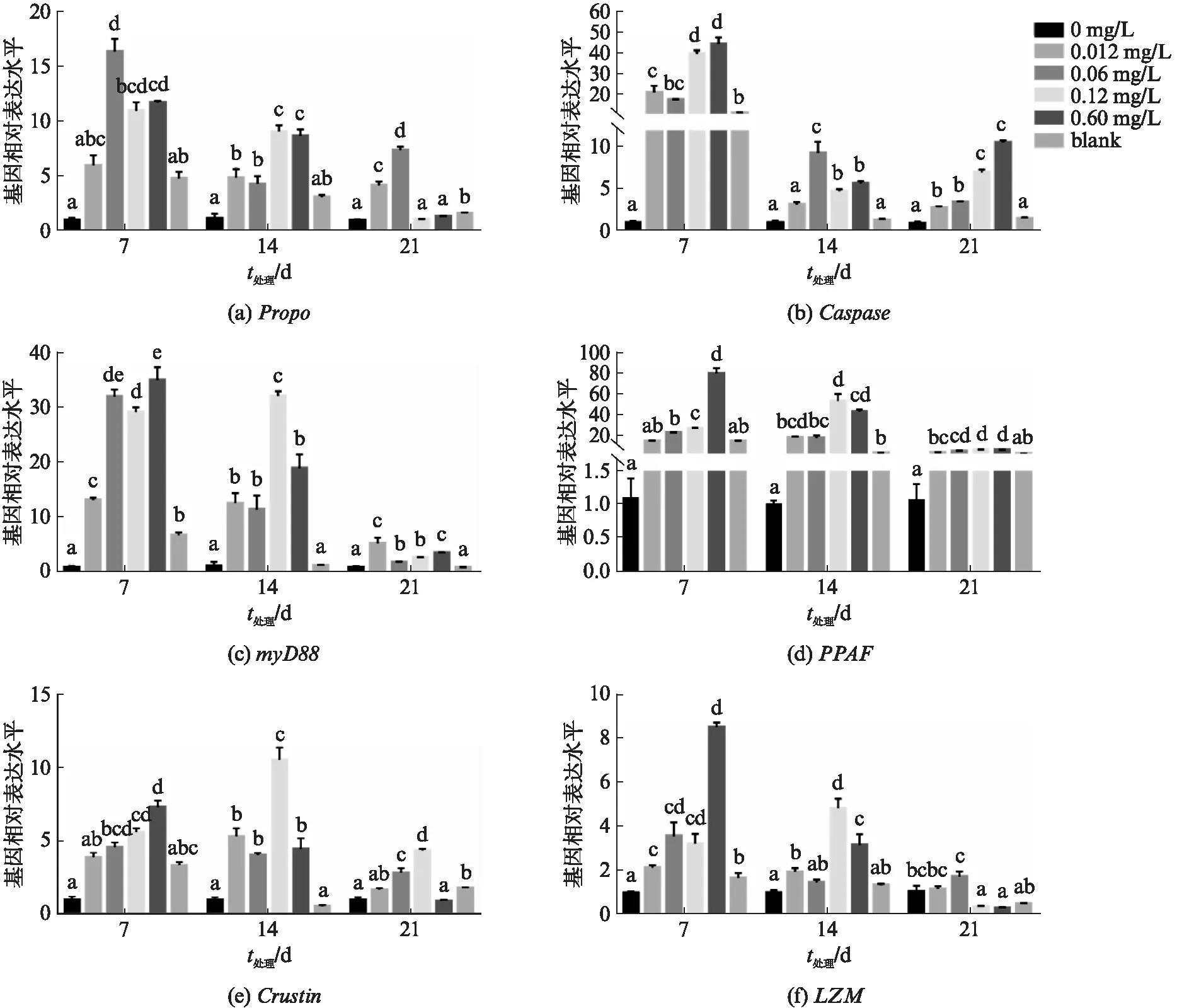
图2 不同浓度悬浮剂组处理后肝胰腺中免疫相关基因的表达量Fig.2 Effects of LC/PDA-MS exposure on the expression of immune genes in the hepatopancreas条形图上方的不同字母代表组间具有显著差异性(P<0.05).
2.3 肠道菌群丰度和多样性分析
通过分析得出每组中华绒螯蟹中平均约45 349个(38 635~50 685个)序列.空白悬浮剂组Chao1指数显著高于对照组(P<0.05),0.60 mg/L组Chao1指数最低,从而导致菌群多样性降低,结果如表2(见第466页)所示.Ace指数与Chao1呈现相同的趋势,0.60 mg/L组低于对照组但无显著性差异(P>0.05).Simpson指数(Simpson index)和Shannon指数(Shannon index)分别是0.11至0.19和2.49至2.84,这两个指标之间没有显著性差异(P>0.05).
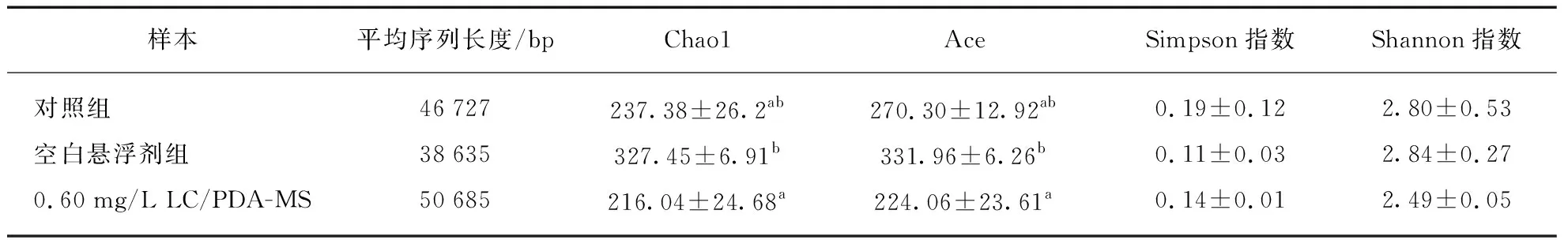
表2 LC/PDA-MS暴露后基于OUT分析中华绒螯蟹肠道菌群的丰度
利用Venn图计算了多个样本中OTU个数,从而揭示不同样本中OTU数目的相似性和重叠性.其中有166个OTUs单元一致(图3(a)).独有的OTUs方面,对照组有69个,空白组有86个,0.60 mg/L LC/PDA-MS组仅有38个.

图3 不同处理组中OTUs相对丰度的维恩图Fig.3 Venn diagram showing the unique and shared OTUs in LC PDA exposure.(a) 显示了各组独有和共有的OTU;(b) 各组总OTU个数;“C”: 对照组;“S”: 0.60 mg/L LC/PDA-MS组;Blank: 空白悬浮剂组.
2.4 肠道菌群组成和比较
如图4(a)所示,基于中华绒螯蟹肠道微生物在门水平上的分析得出优势菌群为变形菌门(Proteobacteria)、拟杆菌门(Bacterodidetes)、软壁菌门(Tenericutes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),以上优势菌门在对照组所占比例为48.16%,5.95%,29.62%,4.92%,10.11%,在0.60 mg/L LC/PDA-MS组所占比例为70.32%,14.79%,13.06%,1.307%,0.27%,在空白悬浮剂组所占比例为35.18%,22.49%,33.77%,6.71%,0.97%,其中拟杆菌门在各对照组之间有显著性差异(P<0.05),结果如图4(b)所示.暴露21 d后不同处理组中华绒螯蟹肠道菌群在属水平上的分析,结果如图5(见第468页)所示.共得到33个属.其中有10个属的丰度相对较高,占整个中华绒螯蟹肠道菌群的70%以上,分别是Candidatus_Bacilloplasma、希瓦氏菌属(Shewanella)、鲍曼不动杆菌属(Acinetobacter)、黄杆菌属(Flavobacterium)、假单胞菌属(Pseudomonas)、气单胞菌属(Aeromonas)、柠檬酸杆菌属(Citrobacter)、norank_f_Mycoplasmataceae、Roseimarinus、副球菌属(Paracoccus).相比于对照组,空白悬浮剂组中希瓦氏菌含量相对较低,黄杆菌在处理组的含量有所上升,但与对照组无显著性差异.空白悬浮剂组气单胞菌含量较对照组含量较少,但与对照组无显著性差异,结果如图5(b)所示.

图4 (a) 不同浓度处理组暴露后基于门水平上中华绒螯蟹肠道菌群的丰度热力图; (b) 不同处理后最丰富的6个门的Kruskal-Wallis分析检验Fig.4 (a) Heatmap of the abundance of Eriocheir sinensis intestinal bacteria at the phylum level at different LC/PDA-MS concentrations;(b) Kruskal-Wallis test of the most abundant six phylums in different treatment groups

图5 (a) 暴露21 d后不同浓度处理组在属水平上肠道菌群的组成变化(不同颜色代表不同的菌属);(b) 不同处理后最丰富的6个属的Kruskal-Wallis分析检验Fig.5 (a) Changes in the gut microbiota composition at the genus level after LC/PDA-MS exposure for 21 days (each colour represents one bacterial genus);(b) Kruskal-Wallis test of the most abundant six genus in different treatment groups
3 讨 论
免疫系统是保护机体免受外界刺激的主要机制之一[18].中华绒螯蟹作为甲壳动物,与其他无脊椎动物一样缺乏完善的免疫系统,而是依赖于先天性免疫系统来应对各种外界刺激[19],先天性免疫系统主要包括酚氧化酶系统、抗菌肽、溶菌酶等,许多研究从基因角度探究机体应对外界刺激的免疫情况.
抗菌肽是甲壳动物先天性免疫重要的组成部分,是抵御病原体的第一道防线,Crustin是重要的效应分子之一[20].在本研究中,Crustin基因在肝胰腺和血细胞中呈现逐渐上升的趋势,表明低浓度LC/PDA-MS会刺激机体对外界环境胁迫做出反应,然而随着浓度的增加,血细胞中Crustin基因表达量逐渐降低.有研究表明,中华绒螯蟹在氨氮胁迫之后会抑制Crustin基因表达[21];缺氧会抑制斑节对虾甲壳素基因的表达[22],可能高浓度的LC/PDA-MS会抑制Crustin表达进而对机体产生负面影响.
溶菌酶是一种作用于细胞壁的特殊水解酶,也是重要的先天免疫因子,甲壳动物可通过调节溶菌酶基因的表达来提高抗病能力[23].结果表明,在血细胞中,溶菌酶的表达先增加后减少,说明溶菌酶在抵御外界刺激方面起着重要作用,随着LC/PDA-MS浓度的升高,LZM的表达呈下降趋势,这可能是由于高浓度悬浮液抑制了溶菌酶的转录.无论在血细胞还是肝胰腺中,空白悬浮液组的溶菌酶表达均高于对照组,推测空白悬浮液处理组能刺激溶菌酶基因表达,提高机体应对环境变化的能力.以往的研究表明,溶菌酶是反映环境污染的指标.肝脏中溶菌酶基因表达量高于血细胞,而0.60 mg/L LC/PDA-MS处理组血细胞的表达低于对照组,可能是由于血细胞首先接触到纳米农药,最先受到影响.
Propo是无脊椎动物的主要免疫反应蛋白之一,它需要通过丝氨酸蛋白酶级联激活,由PPAF介导[24-25].在本研究中,PPAF的表达水平随着肝胰腺中浓度的增加而增加,这表现在Propo表达水平的增加.实验结果和中华绒螯蟹对全氟辛烷磺酸钠的暴露结果一致[26].肝胰腺对LC/PDA-MS更敏感,可能与肝胰腺解毒功能有关.本研究发现,第14天血细胞中PPAF基因表达水平明显低于对照组,而Propo表达水平不受限制,推测血细胞释放Propo不受PPAF影响,有研究证明细菌感染可以刺激细胞中酚氧化酶的释放[27].
细胞凋亡是应对机体炎症的重要反应,机体可通过细胞凋亡减少外界对细胞的损伤,Caspase是促进细胞凋亡的重要基因[28].在本研究中,Caspase基因在血细胞中7 d、14 d时上调,说明机体可通过调节基因来维持机体稳态.然而,在21天Caspase基因表达下调,可能是机体产生了炎症反应.myD88是Toll通路中重要的蛋白,有研究指出,机体可通过加快Toll通路中信号转导来提高免疫力[29].在7天时,血细胞中myD88基因上调,机体可通过提高基因表达提高其传递信号的能力,然而高浓度的农药会降低其表达,进而会影响信号转导,然后降低了机体的抵抗力.以上血细胞和肝胰腺免疫相关基因的表达随着浓度的升高呈现先上升后降低的趋势,存在“毒性兴奋效应”.
动物肠道是重要的消化、食物储存、养分吸收的重要器官,稳定的肠道菌群对于宿主的健康起到非常重要的作用[30-31].已有研究表明,生物在应对环境胁迫时会对群落结构造成一定影响,例如南美白对虾在暴露于硫化物之后肠道群落会发生变化[32],然而,生物在暴露于纳米农药后对肠道菌群的研究却很少.本研究对中华绒螯蟹V3~V4可变区域进行扩增,进行高通量测序.研究发现,在3个处理组中,有166个OTUs相同,从Simpson指数,Chao1指数得出处理组与对照组在肠道菌群丰度和多样性指数无显著差异,这说明肠道菌群在生物体内有一定的稳定性.在本研究中,其肠道主要的菌群为变形菌门、拟杆菌门、软壁菌门、厚壁菌门和放线菌门,这与中华绒螯蟹暴露于草甘膦、微塑料后的菌群一致[28,33].各处理组在群落组成上有一定的相似性,但也存在一定的差异,处理组增加了拟杆菌门的丰度,拟杆菌门寄生于胃肠道,可以分解多糖等大分子物质,因此对于机体的消化功能有重要的作用[34].通过对中华绒螯蟹肠道菌群门水平的分析,在纳米农药处理后可能对肠道菌群的平衡有一定影响,对中华绒螯蟹消化多糖的能力无明显影响.
基于属水平分析,空白悬浮剂组中希瓦氏菌属,气单孢菌属降低,黄杆菌属比例上升.希瓦氏菌属能产生有害的化学物质,是引起腐败的主要细菌[35];气单孢菌是常见的病原体,具有较强的致病性[36];黄杆菌属是拟杆菌门中分解多糖的好氧有机体.以上研究表明中华绒螯蟹在空白悬浮剂组处理后可改善肠道菌群结构,0.60 mg/L LC/PDA-MS处理组和空白悬浮剂组处理后对肠道平衡造成影响.目前对甲壳动物肠道菌群的研究相对较少,因此需要进一步研究确定纳米农药处理对肠道菌群的影响.
4 结 论
本研究首次系统研究了不同浓度纳米农药LC/PDA-MS及空白悬浮剂对中华绒螯蟹在7 d、14 d、21 d实验药物暴露后,肝胰腺和血细胞中免疫相关基因的表达量及肠道菌群分布的变化.研究结果表明,随着时间的延长,免疫相关基因表达水平总体呈现下降趋势;在低浓度LC/PDA-MS实验组及空白悬浮剂组,实验组对免疫相关基因具有免疫刺激作用,通过免疫因子表达量的增加,提高机体免疫能力,应对外界环境变化.另外,在针对肠道微生物富集丰度的研究中,0.60 mg/L LC/PDA-MS处理组和空白悬浮剂中拟杆菌门丰度增加,希瓦氏菌属丰度增加、气单胞菌属丰度下降,以上结果说明纳米农药可改变肠道菌群的分布,进而对机体免疫造成一定影响.空白悬浮剂对免疫基因较对照组升高或与对照组无显著性差异,说明空白悬浮剂组对中华绒螯蟹影响较小.LC/PDA-MS纳米农药对中华绒螯蟹生长与发育影响的分子机制仍需要进一步研究.
