3种不同手术方式治疗颈椎后纵韧带骨化症的疗效对比研究
2021-10-23欧光信李义强李文虎钟小兵何国雄颜琳力
欧光信 李义强 李文虎 钟小兵 何国雄 方 晔 颜琳力
(韶关市第一人民医院脊柱骨病科,广东 韶关 512000)
颈椎后纵韧带骨化症(Ossification of the posterior longitudinal ligament,OPLL)是指颈椎后纵韧带发生骨化,压迫脊髓或神经根而产生一系列临床症状,是造成脊髓型颈椎病的常见因素[1]。在我国占颈椎病患者的0.54%-0.88%[2],对于大多数中重度或造成进行性脊髓损伤的后纵韧带骨化患者,手术干预能很大程度上提高临床疗效[3]。外科手术的首要目的是解除神经的压迫,通过2种途径来实现:(1)直接切除骨化物或打薄骨化物达到漂浮减压;(2)通过椎板切除或单、双开门椎板成形术扩大椎管容积[4],达到间接减压的目的。对于处理后纵韧带骨化症,如何选择手术入路,一直都存在争议。支持前路手术的学者指出,当椎管狭窄率>60%时,前路减压融合术可获得更好的恢复率及JOA评分改善率[5]。且前路后纵韧带骨化切除术后的复发率较后路低,1项研究发现,在5年的随访中近50%后路椎板成形术的患者出现韧带骨化的进展,而在接受前路治疗的患者中只有5.0%出现疾病的进展[6]。支持后路手术的学者指出,后路手术技术上要求相当较低,可以更广泛的用于OPLL患者,尤其是病情严重或合并严重的全身疾病的患者。此外,一些作者认为,后路手术(如椎板成形术)并发症更少,能保留更大的颈椎活动度,同时可对多节段严重的后纵韧带骨化患者进行减压[7]。而后前路联合入路通常用于不可逆的后凸畸形及合并一些降低颈椎椎间融合率的代谢性紊乱性疾病,如:骨质疏松症、糖尿病、长期吸烟[8]。且不同的文献有不同的见解和方案,且很少有文献从经济学方面来考虑,故本文从3种不同手术方式联合经济学来探讨对颈椎OPLL的疗效分析,现将结果报告如下。
临床资料
1 一般资料:收集自2011年-2016年在韶关市第一人民医院脊柱科同一主刀医生行颈椎手术的颈椎后纵韧带骨化症患者资料,共67例,其中女性39例,男性28例,年龄46-78岁,平均56.4岁,病程10个月-22年,平均3.8年。根据手术方式分为3组:前路组(A组):颈椎前路减压植骨融合内固定术;后路组(B组):颈椎后路单开门椎管扩大成形术;后、前联合入路组(C组):一期后前路手术。A组31例,患者后纵韧带骨化节段≤3节,为窄基底,手术方式为ACDF或ACCF;B组29例,后纵韧带骨化节段≥3节,为宽基底型或连续型,K线为阳性。C组7例,后纵韧带骨化节段≥3节,为宽基底型或连续型,K线为阴性及颈椎不可逆的反弓畸形,具体资料见表1。排除标准:颈椎外伤、肿瘤、炎症性疾病、脱髓鞘性疾病、肌萎缩性侧索硬症(夏科氏综合征)、动静脉畸形等不纳入本组研究范围。

表1 患者的基本资料
2 治疗方法:所有手术均由同一术者完成:(1)前路手术组:气管插管全麻后取仰卧位,颈部稍后仰,胶布固定,常规颈动脉鞘与内脏鞘间隙进入,C臂定位手术节段,先将次全切椎体的上下颈椎间盘用直行咬骨钳咬出2个槽,确定开槽宽带,应略大于骨化的后纵韧带的宽度,然后用直行咬骨钳咬除椎体,必要使用磨钻将骨化组织磨薄,然后用1mm枪钳结合后纵韧带拉钩咬除骨化韧带周边的后纵韧带,将周边的后纵韧带咬除后最后来处理骨化的后纵韧带。先“从薄到厚”,用枪钳在骨化韧带最薄的地方入手,小心分块切除,最后再来处理骨化韧带最厚的地方,此时它已处于游离状态,仔细分离骨化块与硬膜粘连后可整块予以切除,避免对颈髓过多的骚扰。若术中出现硬膜破裂,可视情况予以硬膜修补或用皮下脂肪粒及生物蛋白胶予以覆盖。减压后用肽网植骨、钢板内固定重建颈椎的稳定性(见图1),术后佩戴颈托或颈部支具固定至术后3个月。(2)后路手术组:行单开门椎板成形术,颈后正中入路,经颈白线逐层切开,显露颈3-7椎体侧块、椎板、关节突后,症状较重一侧为门缝侧,对侧为门轴侧,进行开门减压,范围为颈3-7,使用微型肽板支撑固定(见图2),术后佩戴颈托或颈部支具固定至术后3个月。(3)后前入路组:在全麻下先予俯卧位,行颈椎后路单开门椎板扩大成形术,术毕改成仰卧位行颈椎前路椎体次全切除植骨融合内固定术(见图3),术后佩戴颈托或颈部支具固定至术后3个月。
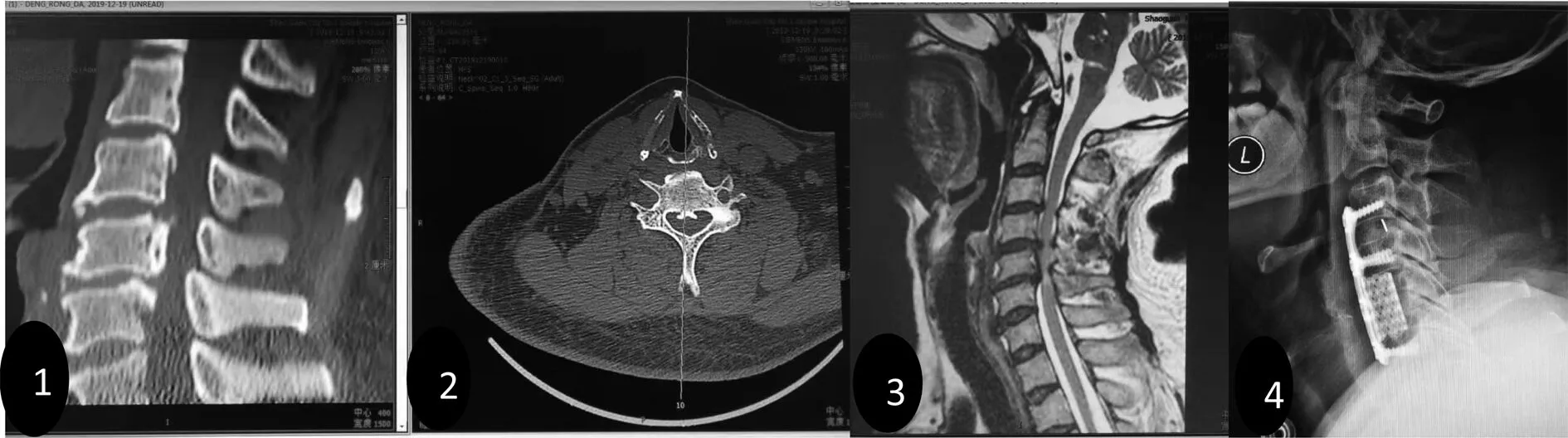
图1 1-3前路组术前CT及MRI片示:颈5椎体及颈5/6后纵韧带骨化,4颈前路ACCF结合ACDF内固定位置良好。

图2 1-3 后路组术前CT及MRI示:颈2-4后纵韧带骨化,椎管占位明显,4 颈椎后路单开门椎板成形术后

图3 1-3前路组术前CT及MRI片示:颈4-6后纵韧带骨化,椎管明显占位,4 颈前路ACCF结合后路单开门椎板成形术。

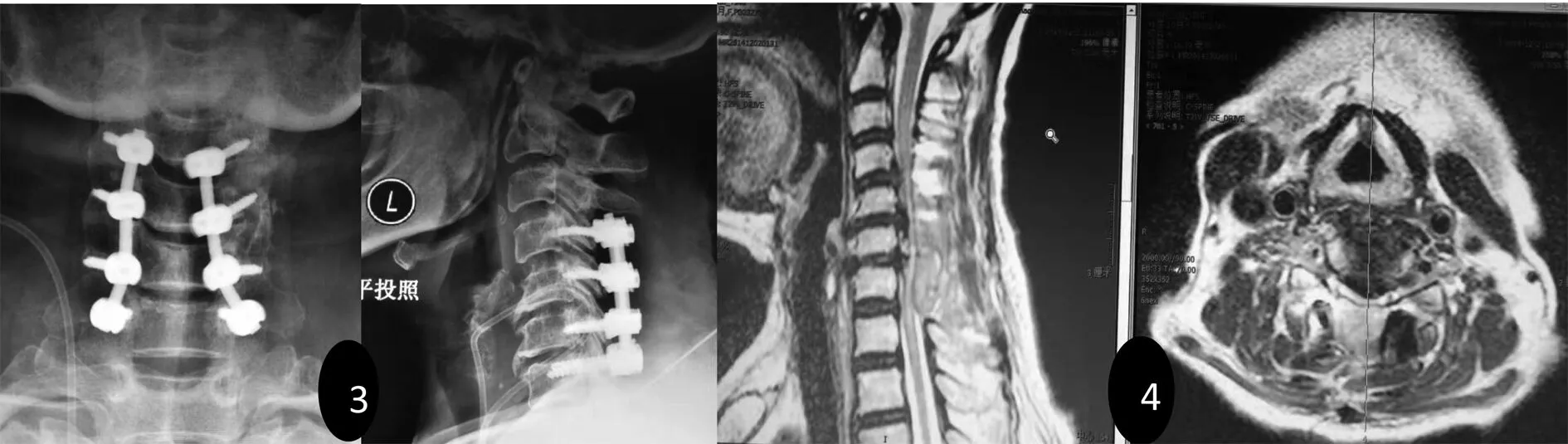
图4 1-2术前颈椎CT、MRI示:混合型后纵韧带骨化,椎管明显占位,3-4 术后颈椎X片及MRI示:颈髓受压较术前更明显
3 观察指标:统计3组患者的术前脊髓压迫率、手术时间、术中出血量、并发症、住院总费用、术前、术后JOA评分、随访时JOA评分改善率、术后脊髓膨胀程度。脊髓压迫率:在术前的颈椎MRI T2加权像的中心矢状面测量,选择脊髓受压最重的横断面,测量脊髓最小前后径和最大横径,脊髓压迫率=最小前后径/最大横径。采用日本骨科协会(Japanese Orthopaedic Association,JOA)评分[9]评估患者术前、术后病情严重程度及术后随访情况。术后 JOA 评分改善率=(术后评分-术前评 分)/(17-术前评分)×100%,其改善率分为4级,优:≥7 5%;良:50%-74%;中:2 5%-49%;差:≤ 24%。术后脊髓膨胀程度(Expansion of the spinal cord,ESC):使用AutoCAD2007软件,在术前及末次随访的颈椎MRI T2加权像的中心矢状面,以椎间隙相邻椎体后上缘与后下缘的中点为基点,测量上述该基点水平脊髓前缘到后缘的距离。得到脊髓前后径,计算末次随访与术前的差值,为ESC。

5 结果:所有患者均手术顺利,术前脊髓压迫率详见表1。组间比较差异有统计学意义(F=8.46,P=0.024),C组>A组、B组,A组与B组之间无明显差别;手术时间A组为(175.45±26.84)分钟,B组为(168.42±28.58)分钟,C组为(426.35±34.52)分钟。组间比较差异有统计学意义(F=12.36,P=0.016),C组>A组、B组,A组与B组差异无统计学意义。术中出血量A组为(125.36±28.35)ml,B组为(106.34±26.54)ml,C组为(353.38±46.59)ml,组间比较有统计学意义(F=10.56,P=0.032),C组>A组、B组,A组与B组之间无明显差别。并发症:A组3例(9.67%),1例出现钛笼塌陷,1例出现颈肩部疼痛,1例出现脑脊液漏,B组(6.89%)2例出现颈5神经根麻痹,C组(22.22%)出现2例颈部轴性症状,3组之间比较有统计学意义(F=12.68,P=0.026);住院总费用C组>B组>A组,A组为(46527.36±2103.48)元,B组为(61649.63±3526.52)元,C组为(102882.42±4226.37)元,组间比较有统计学意义(F=14.58,P=0.014)。术后及随访时JOA评分与术前比较均有统计学意义(P<0.05),术后随访时JOA评分改善率3组之间有统计学意义,C组>A组、B组(P<0.05),术后脊髓膨胀程度3 组之间有统计学意义,C组>A组、B组(P<0.05),A组与B组比较无明显差别,详见表2、表3。

表2 3组手术前后JOA评分及JOA改善率及脊髓膨胀程度比较

表3 3组手术时间、术中出血量、并发症、住院总费用的比较
讨 论
1 3种入路手术的适应证及疗效、住院费用的比较:颈椎后纵韧带骨化症最佳手术入路的选择仍然是有争议的,具体选择需考虑很多因素如:颈椎生理曲度、骨化物的形态特征、椎管容积侵占率、是否合并颈椎间盘突出及钩椎关节增生、骨化韧带的节段数目、是否合并其他严重的基础疾病、术前神经病理学表现、骨化的后纵韧带与K线的关系、硬膜是否骨化、手术费用等。前路手术的优点有:对颈椎后纵韧带骨化实现直接减压;若后纵韧带骨化侵占率>60%时与后路手术比可提高临床疗效;可降低后纵韧带骨化的几率;避免广泛的剥离肌肉组织。但它亦有相应的缺点:技术要求高、丧失了颈椎的活动度,容易出现硬膜撕裂及脑脊液漏(2.4%-31%)[10],吞咽困难、声音嘶哑(2.4%-16.8%)[10]。而后路手术的优点是:手术技术要求较前路相对低;适用于更多的病人,如合并一些严重的其他基础疾病的病人;组织破坏小;保留更多的颈椎活动度。它的缺点:OPLL进展的几率较前路更高;术后并发症的发生率更高;对OPLL是间接性减压;颈5神经根麻痹后路椎板成形术为9.6%-25%[11];轴性疼痛发生率为22.2%[12]。而后前路联合手术可用于多节段(4个或以上)且合并颈椎严重后凸畸形或椎管侵占率>60%的患者,它的优势在于先行后路椎管扩大成形术有效地扩大了椎管容积,使脊髓向后漂移,为前路切除骨化物提供了更大的操作空间,减少脊髓2次损伤的风险,且可减少前路减压融合的节段而保留更多的颈椎活动度。Ha Y[13]报道对于颈椎后纵韧带骨化症,前路手术适用于2个节段及以内的颈椎后纵韧带骨化无论椎管侵占率为多少;椎板成形术适用于侵占率>60%,但无局部后凸畸形;后前路手术适用于椎管侵占率>60%合并颈椎局部后凸畸形;后路减压融合手术适用于如果椎管侵占率≤60%合并颈椎局部后凸畸形。Iwasaki M[14]推荐有如下特征的颈椎后纵韧带骨化患者选择前路减压融合术:1、OPLL椎管侵占率>60%;2、骨化物呈山船样;3、合并颈椎后凸畸形。然而,只有少部分学者采用上述标准用于治疗那些严重的病例,因为这对脊柱外科医生的手术技术要求非常高,只有少数医生有如此娴熟的前路减压融合的技术[15]。手术医生对于更适合前路手术的患者,不能因为后路手术更简单、容易操作而选择后入路。在本次研究的病例中有1个混合型颈椎后纵韧带骨化的患者,4节,椎管侵占率>60%,且合并黄韧带骨化,无明显颈椎后凸畸形,考虑分2期行颈椎后前路手术,但由于某些原因,患者行后路全椎板切除(颈3-6椎板全切+颈2椎板下缘、颈7椎板上缘)后,拒绝行2期前路手术,术后患者症状及体征及复查影像学的参数均不太理想(见图4)。这个病例提示对于严重的后纵韧带骨化患者(椎管侵占率>60%,节段>3个,合并黄韧带骨化或硬膜骨化)需考虑行颈椎后前路联合手术。本次研究发现后前路手术的JOA改善率及脊髓膨胀程度均优于前路组及后路组,但同时它的手术时间及术中出血量、并发症发生率及住院费用均明显高于前路组及后路组,故后前路手术可用于上述描述的一些严重的患者,但不宜用于所有的患者。而前路与后路手术相比,两者的手术时间、术中出血量、JOA评分改善率及脊髓膨胀程度、并发症发生率均无明显差别,但住院费用后路组明显大于前路组,故若患者同时适用于2种入路手术治疗,优先选用前路手术治疗。
2 3种手术入路手术相关并发症的分析:(1)钛网下沉、移位。前路组中1个病例出现钛网下沉并移位,致颈椎生理曲度消失并后凸畸形,致颈5神经根麻痹,颈部疼痛及双侧肩部疼痛不适,后经过使用激素、颈部支具固定于轻度过伸位,之后症状缓解,予颈部支具固定至术后3个月,钛网下沉至颈椎螺钉位置处稳定,随访1年后达到椎体间骨性融合,未出现脊髓损害的症状及体征。钛网下沉是颈前路椎体次全切除术后较为常见的并发症,颈椎OPLL与脊髓型颈椎病的钛网下沉率无明显差别。钛网下沉的原因包括[16]:⑴椎间过度撑开:椎间高度、角度;⑵钛网直径,直径越小越容易下沉;⑶终板过度刮除;⑷钛网设计及术中裁剪的不合理;⑸钛网与钢板的距离,距离越长,越容易下沉;⑹肽网与椎体表面不贴附;⑺年龄、性别、是否合并骨质疏松。有学者[17]报道高龄、终板刮除、术后6周椎间不融合是颈前路椎体次全切除术后钛网下沉的危险因素。因此,大家可通过如下方法进行预防钛网下沉:⑴通过术前X片及CT测量,选取合适的肽网;⑵尽量选用最大直径的钛网,且尽量靠近椎体前缘贴近钢板放置;⑶术中注意保护终板;⑷术中修剪肽网时尽量保持与椎体终板一致,增大接触面,剪短面予以钝化;⑸新型肽网及3D打印个性化钛网的使用;⑹术前骨密度测定及术后抗骨质疏松治疗。(2)颈肩部疼痛/轴性疼痛。颈部轴性疼痛是颈椎后纵韧带骨化手术中也许是最常见的并发症,据报道它的发生率为16%-48%[18],后路一般较前路多见。本次研究中前路出现1例颈肩部疼痛,后前路组出现2例颈部轴性疼痛,前路出现颈肩部疼痛考虑主要为放置的椎间融合器高度过高导致颈椎过撑,颈椎的生理前屈过大,颈后肌肉痉挛所致,之后经过对症及理疗处理后缓解。后前路组手术出现2例颈部轴性疼痛,其原因与后方软组织剥离或椎小关节破坏有关;经过消炎镇痛、脱水、理疗等对症处理后缓解。田继伟等[19]报道颈肩部疼痛的原因主要有神经根栓系、操作中神经根损伤、手术区水肿肌肉痉挛等。造成神经根栓系的原因主要是椎板切除或成形后脊髓向后漂移使神经根受到牵拉所致。防治措施包括:⑴术中适当调整颈椎前凸角(25°-30°,不超过35°);⑵椎间融合器或钛笼长度合适,避免过撑;⑶术后酌情给予消炎止痛药物,理疗处理;⑷有前路手术适应证时应行前路手术。(3)脑脊液漏。前路组中有1个病例术中出现脑脊液漏,无法予以缝合,予脂肪粒及明胶海绵覆盖,放置伤口引流管,术后予抬高床头,加强补液观察3天后,伤口引流量仍>50ml,予腰大池引流,术后5天拔除引流管,术后第8天拔除腰大池引流管,之后无特殊不适,伤口愈合良好。颈椎后纵韧带骨化症前路手术脑脊液漏的原因有:⑴骨化的后纵韧带与硬膜粘连严重,在切除后纵韧带骨化块时易撕裂硬膜;⑵后纵韧带骨化伴硬膜骨化,在切除后纵韧带和硬膜骨化块后发生硬膜缺损;⑶后纵韧带骨化,硬膜在长期压迫、磨损下出现压力-磨蚀现象发生破裂;⑷医源性因素,术者经验不足,操作欠仔细或术前预估不足等原因造成硬膜损伤;(5)自发性脑脊液漏,可能与硬膜发育不良、变性有关[20]。硬膜骨化的发生率占后纵韧带骨化病人中的15.3%-29.0%,大部分可通过轴位CT上的“双层征”予以识别,它有55%的敏感度及96.9%的特异性[21]。颈椎OPLL合并硬膜骨化脑脊液漏的预防措施除了常规的预防措施外,还包括:⑴若硬膜骨化,可运用前路漂浮技术,使用高速磨钻结合显微镜技术,通过行后纵韧带骨化块漂浮术,避免完全切除硬膜组织;⑵运用ACAF技术可降低脑脊液漏的发生率,Yang H[22]等报道在28例OPLL合并硬膜骨化的处理中ACAF(3.6%)脑脊液漏的发生率明显低于ACCF(22.6%)。Mazur[24]等在大量的文献回顾中发现使用腰大池引流术在OPLL脑脊液的治疗中成功率很高,83%-100%,但该方法可能引起头痛、椎管内感染、切口感染,水电解质、酸碱平衡紊乱,使用时需要注意观察。(4)颈5神经根麻痹。本组研究中后路组出现2例颈5神经根麻痹,双侧三角肌及肱二头肌麻痹不适,但未出现脊髓受损的症状。通过卧床休息、颈围制动、营养神经及理疗,加强肩关节及肌肉强度锻炼等手段,3个月后症状逐步缓解,1年后症状基本消失。颈5神经根麻痹的定义仍没有统一的标准,为区分术后轴性痛所致的肩部疼痛不适,将出现无脊髓加重的三角肌和/或肱二头肌麻痹伴或不伴感觉异常称作颈5神经麻痹。颈5神经根麻痹通常在术后1周内发作,但是最早术后立即出现,或出现在术后4周。关于颈5神经根麻痹2个病理生理学上可能的解释包括:⑴牵拉现象:后路减压引起脊髓向后漂移导致脊髓或神经根受到牵拉;⑵在减压过程中由于自身调解机制受损而引起急性脊髓缺血再灌注损伤。据Wang[23]等报道,在OPLL的患者中,颈5神经根麻痹的发生率LAMP(5.5%)、前路减压植骨融合术(8.1%),而其它类型的脊髓型颈椎病的发生率为LAMP(4.7%)、ACDF(3.1%)。Singhatanadgige[24]等在处理OPLL的患者中发现,颈5神经根麻痹的发生几率LF(9.6%-25%)>LAMP(0-8%)。通过国内外文献的回顾,目前预防治疗措施[25]包括:⑴合适的椎板切除宽度,一般椎管减压宽度达到20ml,椎板切除宽度越宽,脊髓后移越大,颈5神经根麻痹的可能性越大;⑵开门角度越大颈5神经根麻痹的几率越大,合适的开门角度,开门后 脊髓搏动良好且脊髓背侧与掀开的椎板间距离1-2mm即可;⑶颈椎椎板成形术较椎板切除术的颈5神经根麻痹发生几率大,满足适应证的情况下,优先选择行颈椎椎板成形术;⑷术中行预防性颈4-5椎间孔减压术,可降低术后颈5神经根麻痹发生率,但亦存在相反的观点,椎间孔减压术后,可能加重脊髓漂移程度,进而增加颈5神经麻痹的风险[26]。
