斑鞘豆叶甲成虫对非寄主植物挥发物的触角电位和行为反应
2021-10-22樊瑞冬张益恺毕嘉瑞臧连生
樊瑞冬,张益恺,2,毕嘉瑞,徐 伟*,臧连生*
(1.吉林农业大学植物保护学院/生物防治研究所,长春 130118;2.吉林人参研究院,通化 134001)
斑鞘豆叶甲Colposcelis signata (Motschulsky),属鞘翅目Coleoptera,叶甲科Chrysomelidae,是大豆苗期的重要害虫之一。成虫为害大豆叶片、地下茎部、子叶及嫩芽,严重时为害每株大豆苗的成虫超过 20头,叶肉几乎被吃光,致使豆株早衰,幼苗干枯死亡,严重影响大豆产量[1]。目前对该虫主要采取化学防治[2],但是化学农药不仅会污染土壤、水体和大气,在环境中残留,而且随着化学杀虫剂的长期大量使用,斑鞘豆叶甲的抗药性会逐渐增强,防控难度不断加大。
植物能够自身产生并释放醇、醛、酮、酯和萜烯类等挥发性化合物[3],不同植物释放的挥发物组成与含量不同,这成为植食性昆虫寄主定位的信号和线索。研究发现,昆虫能够通过嗅觉感受器识别寄主植物挥发物,以不同受体神经元将气味编码传递给脑,进而调控昆虫的多种行为,诸如寄主选择、交配产卵、取食和传粉等[4]。植食性昆虫对寄主植物挥发物一般表现为趋向反应,对非寄主植物的挥发物表现为不选择性和驱避性。如芸苔属植物特异性释放的较高含量异硫氰酸酯吸引甘蓝蚜虫 Brevicoryne brassicae 定殖和取食[5]。茶尺蠖Ectropis obliqua成虫对寄主植物迷迭香、茶叶和吸毒草的气味表现为引诱反应,而对非寄主植物薰衣草的气味表现为不反应[6]。另外橘潜叶蛾Phyllocnistis citrella的寄主植物叶片混入非寄主印楝Azadirachta indica、马缨丹Lantana camara和藿香蓟Tropic ageratum的叶片后还能够干扰其雌蛾产卵,导致着卵量明显低于对照组,并产生驱避作用[7]。昆虫通过植物挥发物信号来辩别寄主和非寄主植物,保证在寄主植物上取食和获取营养,满足生长发育和繁殖的需要,避免了在非寄主植物上中毒和营养不良。但也有少数非寄主植物对昆虫具有显著的引诱作用,如菜蛾 Plutella maculipennis对欧洲山芥Barbarea vulgaris和豆荚螟Etiella zinckenella对菽麻Crotalaria jumcea有产卵选择偏好,这两种植物均含有次生有毒物质,对两种幼虫具有驱避和毒杀作用[8,9]。另外,华北大黑鳃金龟Holotrichia oblita和铜绿丽金龟Anomala corpulenta虽然对蓖麻没有产卵偏好,但蓖麻对两种昆虫的引诱作用显著超过了其寄主植物大豆,同样取食蓖麻后会导致中毒麻痹[10,11]。基于非寄主植物挥发物对昆虫嗅觉行为的干扰,影响寄主的选择,近年来已经逐渐将非寄主植物挥发物应用于害虫防控中,并取得了良好的效果[6,12-14]。
本文根据已有对大豆植株挥发物的分析检测结果[15-17],选取了醇、醛和萜烯类等斑鞘豆叶甲的非寄主16种挥发物,通过触角电位(EAG)和Y型管嗅觉仪技术,检测斑鞘豆叶甲对挥发物的EAG反应和行为反应,筛选对其具有生物活性作用的植物挥发物,为研发斑鞘豆叶甲植物行为调控剂,实现该害虫的绿色生物防控提供理论依据。
1 材料与方法
1.1 供试虫源
斑鞘豆叶甲成虫于2018、2019年5月中旬采自吉林农业大学大豆试验田,将成虫区分雌、雄后接入具有通气孔的50 mL离心管中,每个离心管接入5头成虫,以新鲜大豆叶在光温培养箱内饲养(25 ℃±1 ℃,RH 50%±5%,光周期16L:8D)。
1.2 供试非寄主植物挥发物
供试非寄主植物16种挥发物包括 6种萜烯类挥发物:(1R)-(+)-α-蒎烯、(-)-β-蒎烯、(R)-(+)-柠檬烯、1,6-二甲基-2,4,6-辛三烯、1-十二烯、β-月桂烯;5种醇醛类挥发物:反-2-己烯-1-醇、2-乙基-1-己醇、芳樟醇、2-苯乙醇、反-2-己烯醛;5种其他挥发物:异戊酸乙酯、乙酸叶醇酯、水杨酸甲酯、1,8-桉叶素、十三烷的标准品。样品购自美国Sigma公司,纯度均在95%以上。用液体石蜡(化学纯,天津市福晨化学试剂厂)配制成10-5、10-4、10-3、10-2和10-1mol/L共5种浓度梯度的挥发物溶液备用。
1.3 触角电位测定
触角电位仪(荷兰Syntech公司)由CS-55气味刺激控制装置、MP-15微动操纵器、IDAC2数据采集控制器和触角电位记录显示输出装置组成。测试前在“Z”型滤纸条(20 mm×5 mm)上均匀滴加10 μL待测溶液,溶剂挥发后放入巴斯德管中,巴斯德管末端与触角电位仪气体刺激控制装置相连。取饥饿24 h后的健康斑鞘豆叶甲雌、雄虫,在体视解剖镜下将触角自基部切下,再切除其端部少许,用导电胶固定在金属电极上,电极通过银丝与信号放大器相连。测试时,调节触角电位仪的工作状态,测试气体流量设定为0.4 L/min,待基线平稳后,开始测试。每个样品雌、雄虫各测试10根触角,重复3次。刺激时间为0.3 s,每2次刺激时间间隔不少于60 s。试验以液体石蜡的EAG反应值作为对照,以丙酮(分析纯,北京化工厂)为参照,对照与处理交替进行。EAG相对反应值=(处理反应值-对照反应值)/(参照反应值-对照反应值)[18]。
1.4 行为反应测定
试验在暗室内操作,反应测试系统包括 GQC-1型大气采样仪(北京市劳动科学保护研究所)、活性炭瓶、LZB4型玻璃转子流量计(常州双环热工仪表有限公司)、加湿瓶、味源瓶和Y型嗅觉仪构成,由聚四氟乙烯管依次连接。Y型嗅觉仪主臂长15 cm,两侧臂等长为11 cm,二者夹角为90°,内径2 cm。在嗅觉仪前上方放置1盏40 W白炽灯,并保持左右两侧臂光照强度一致,气体流速设定为300 mL/min。试验在斑鞘豆叶甲活跃15:00~18:00进行,将“Z”型滤纸条滴加10 μL挥发物溶液后放入一侧味源瓶中,在另一侧味源瓶中放入滴有相同体积石蜡的滤纸条作为对照。将单头饥饿24 h的健康斑鞘豆叶甲成虫接入主臂管口,待其爬过主臂1/3处,开始计时。以5 min内进入气味源侧臂且停留30 s以上视为选择该侧臂的味源,进入对照侧臂且停留30 s以上视为选择对照;若试虫停留在主臂5 min以上,则记为对该挥发物不选择。每种挥发物各测试45头雌、雄成虫。每测试2头成虫,更换1次滤纸条,Y型管左右调换1次方向。更换不同挥发物和不同浓度样品时用丙酮和蒸馏水先后冲洗Y型管并置于100 ℃烘箱2 h,以排除干扰。植物挥发物对斑鞘豆叶甲的驱避率=(选择对照气味源的总虫数/测试总虫数)×100%,引诱率=(选择样品气味源的总虫数/测试总虫数)×100%[18]。
1.5 数据统计与分析
利用SPSS 25以单因素方差分析法分析斑鞘豆叶甲成虫对同一浓度不同挥发物和同一挥发物不同浓度的EAG反应相对值,及成虫对同一浓度下具有引诱或驱避作用的不同挥发物的行为反应差异性,以Duncan’s新复极差法进行显著性检验。同一挥发物雌、雄虫间的EAG反应差异显著性采用Student’s t检验。以卡方检验分析雌、雄成虫对处理和对照行为选择的差异显著性。
2 结果与分析
2.1 斑鞘豆叶甲对10-1 mol/L不同挥发物的EAG反应
斑鞘豆叶甲成虫对10-1mol/L不同挥发物的EAG反应结果显示,6种萜烯类挥发物可引起较强的EAG反应,雄虫反应强于雌虫,EAG反应相对值由高到低依次为(1R)-(+)-α-蒎烯,(-)-β-蒎烯,β-月桂烯,(R)-(+)-柠檬烯,1-十二烯,1,6 -二甲基-2,4,6-辛三烯。成虫对(1R)-(+)-α-蒎烯和(-)-β-蒎烯的反应显著强于其他挥发物,雄虫 EAG相对反应值分别为 2.10和 2.04。雄虫对(1R)-(+)-α-蒎烯、(-)-β-蒎烯、(R)-(+)-柠檬烯和β-月桂烯的反应明显强于雌虫。斑鞘豆叶甲对5种醇、醛类挥发物反应较强,且不同挥发物间差异显著。雌、雄虫对反-2-己烯醛反应最强,其EAG相对反应值分别为1.96和1.82,其次是反-2-己烯-1-醇。雌虫对反-2-己烯-1-醇、2-乙基-1-己醇和反-2-己烯醛的反应明显强于雄虫,而雄虫对2-苯乙醇和芳樟醇的EAG反应则强于雌虫。斑鞘豆叶甲对异戊酸乙酯等其他5种挥发物的EAG反应相对值较低,除水杨酸甲酯外均低于1.0,雄虫反应均强于雌虫,水杨酸甲酯可引起雌、雄虫间显著的EAG反应(表1)。
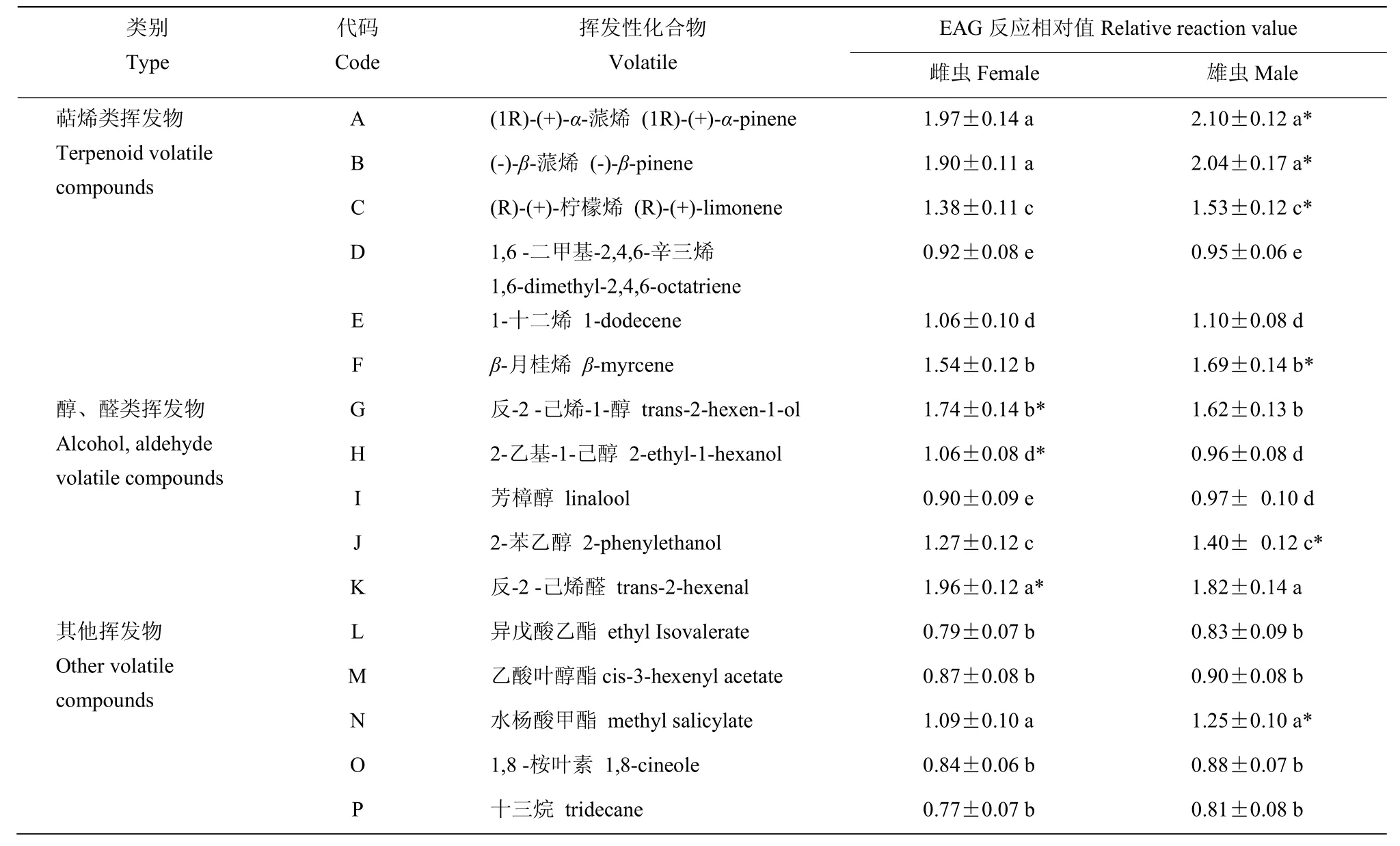
表1 斑鞘豆叶甲成虫对浓度10−1 mol/L不同挥发物的EAG反应Table 1 EAG responses of Colposcelis signata adults to 10-1 mol/L plant volatiles
2.2 斑鞘豆叶甲对不同浓度挥发物的EAG反应
随着挥发物浓度增加,斑鞘豆叶甲雌、雄虫EAG反应变化趋势相同(图1),反应值逐渐增加,雄虫对不同浓度的 4种萜烯类挥发物、2-苯乙醇和水杨酸甲酯的反应强于雌虫,对反-2-己烯-1-醇、2-乙基-1-己醇和反-2-己烯醛的反应弱于雌虫。浓度从10-5mol/L增加到10-2mol/L,成虫对(1R)-(+)-α-蒎烯和(-)-β-蒎烯 EAG反应显著增强,并且雄虫反应均明显强于雌虫,雄虫对 10-2mol/L (1R)-(+)-α-蒎烯和(-)-β-蒎烯EAG反应相对值分别为2.23和2.09,是10-5mol/L浓度下的2.51和2.49倍,浓度效应显著。当浓度增加到10-1mol/L时,成虫对两种挥发物的EAG反应相对值稍降低(表1),这表明10-1mol/L (1R)-(+)-α-蒎烯和(-)-β-蒎烯超过了斑鞘豆叶甲EAG浓度效应阈值。成虫对低浓度的(R)-(+)-柠檬烯、2-乙基-1-己醇和水杨酸甲酯反应强度增加不显著。
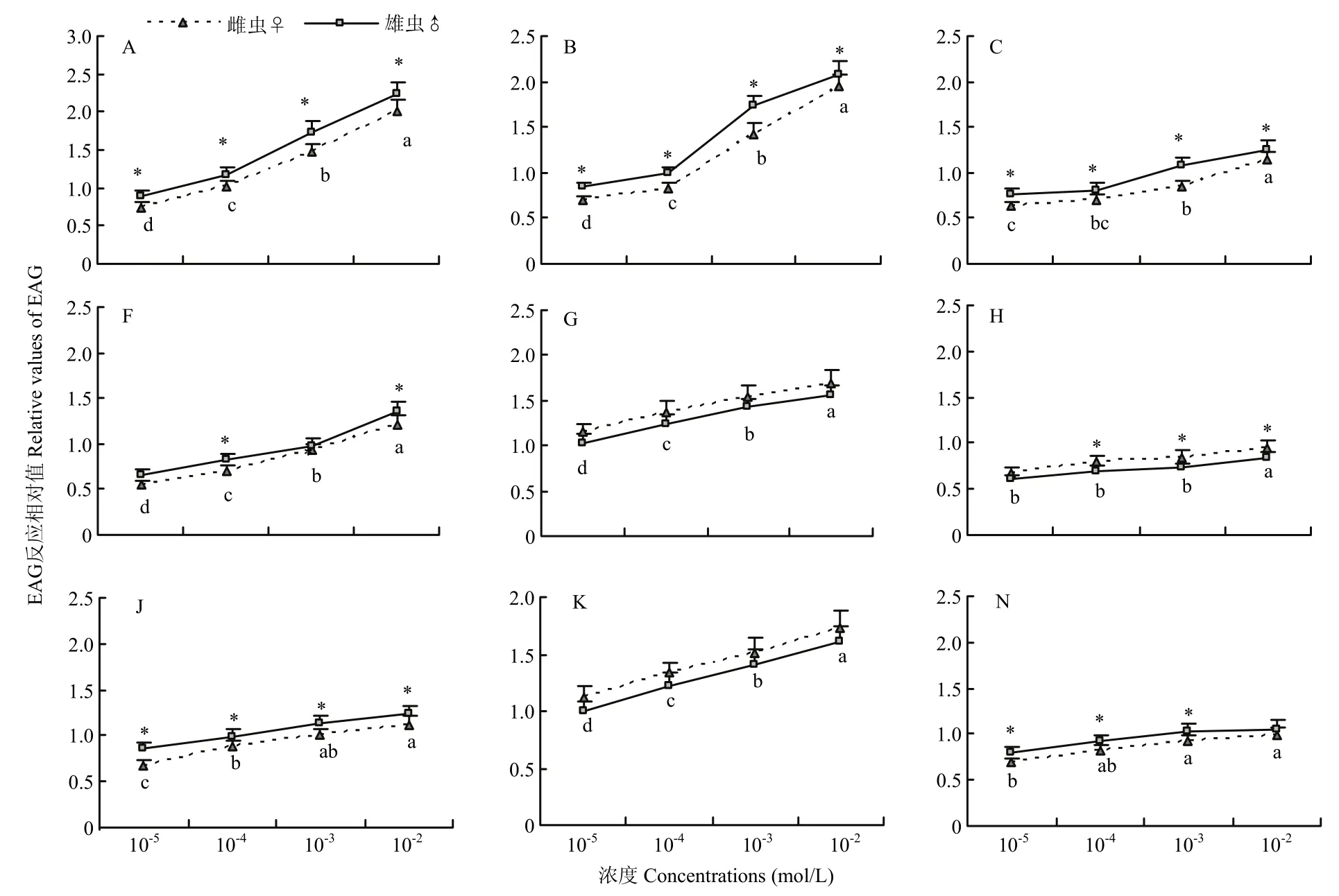
图1 斑鞘豆叶甲成虫对不同浓度挥发物的EAG反应Fig.1 EAG responses of Colposcelis signata to different plant volatiles in five concentrations
2.3 斑鞘豆叶甲对10-1 mol/L不同挥发物的行为反应
斑鞘豆叶甲对10-1mol/L浓度的6种萜烯类化合物表现为显著的驱避反应,雄虫反应强于雌虫,其中(1R)-(+)-α-蒎烯、(-)-β-蒎烯和β-月桂烯的驱避反应较强,对雄虫驱避率分别为,86.7%、81.3%和81.1%,对雌虫的驱避率均超过70%。除芳樟醇外斑鞘豆叶甲对其他醇、醛类挥发物均表现为诱引反应,其中反-2-己烯-1-醇诱引作用最强,对雌、雄虫的引诱率分别为68.9%和65.7%。反-2-己烯-1-醇、2-乙基-1-己醇和反-2-己烯醛对雌虫的引诱作用强于雄虫。芳樟醇对成虫具有显著的驱避作用,且雄虫反应强于雌虫。斑鞘豆叶甲对异戊酸乙酯等其他挥发物具有显著的诱引反应,雄虫反应强于雌虫,并且水杨酸甲酯对雌、雄虫的诱引作用超过其他4种挥发物(表2)。
2.4 斑鞘豆叶甲对不同浓度挥发物的嗅觉反应
斑鞘豆叶甲成虫对不同浓度的4种萜烯类挥发物均表现为明显的驱避反应(图2),在10-5mol/L浓度下驱避率超过48.9%。其中(1R)-(+)-α-蒎烯和(R)-(+)-柠檬烯的驱避作用随浓度增加而增强,而(-)-β-蒎烯和β-月桂烯在10-2mol/L浓度下的驱避作用最强,对雄虫的驱避率分别为87.8%和83.3%,在10-1mol/L浓度下驱避率反而降低(表2),这表明该浓度超过了斑鞘豆叶甲嗅觉反应的浓度阈值。对于5种醇、醛和其他挥发物,随浓度增加对斑鞘豆叶甲的引诱作用增强,表现出浓度效应。但2-苯乙醇在10-5和10-4mol/L浓度下对斑鞘豆叶甲的引诱作用不显著,不同浓度的反-2-己烯醛对斑鞘豆叶甲均无显著的引诱作用。在10-4~10-1mol/L浓度范围内水杨酸甲酯对斑鞘豆叶甲成虫均具有显著的引诱作用。
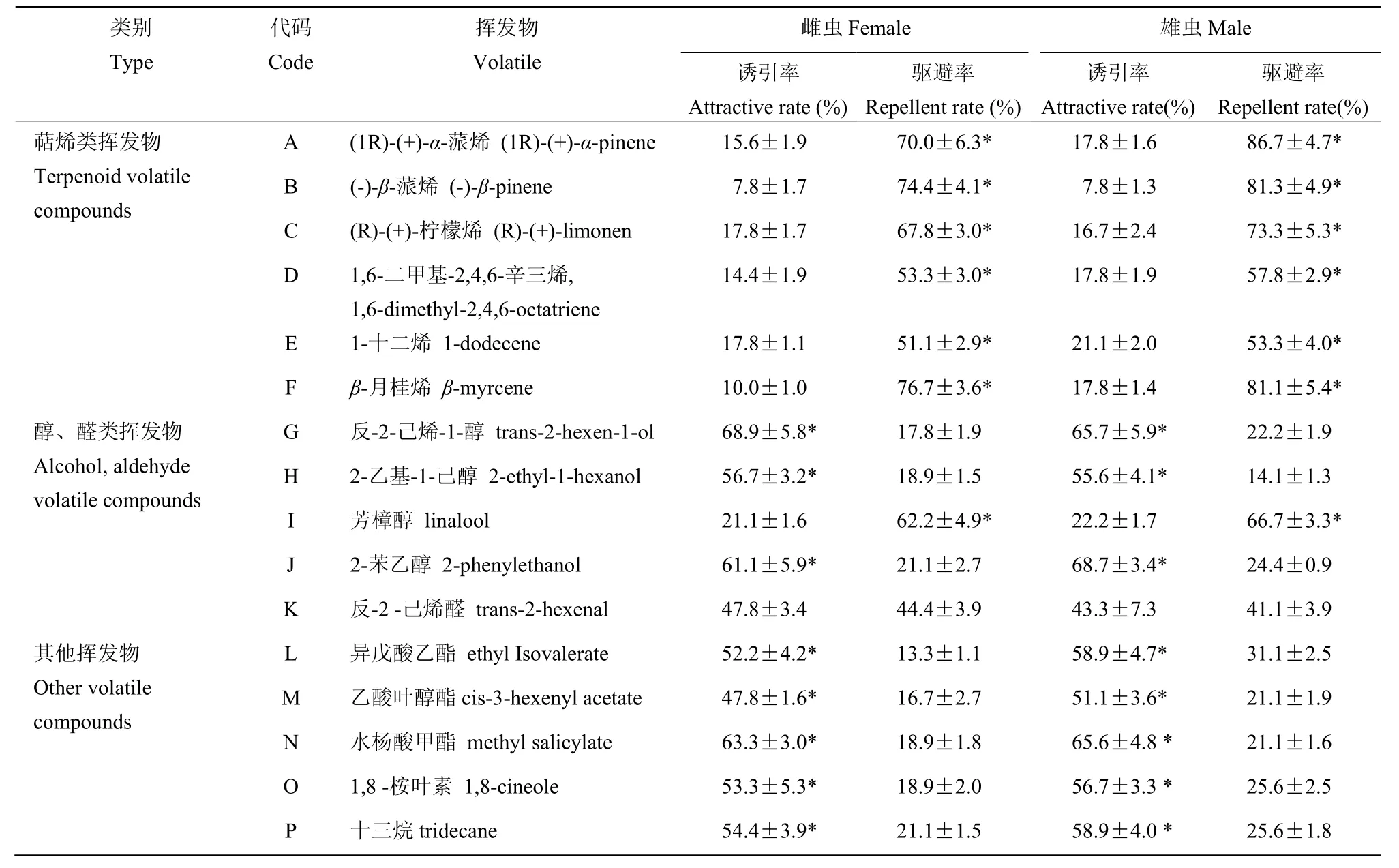
表2 斑鞘豆叶甲成虫对浓度10-1 mol/L不同挥发物的行为反应Table 2 Behavioral responses of Colposcelis signata adults to 10-1 mol/L plant volatiles
3 讨论
近年来对昆虫与植物化学互作的研究日益深入,二者协同进化的结果是植食性昆虫形成了特定的取食范围[19]。植物挥发物通过昆虫的嗅觉系统调节昆虫的取食和行为,在昆虫定殖和繁衍过程中发挥着重要的引导作用。昆虫生存环境中大多数为非寄主植物,它们也会影响昆虫的寄主选择,干扰对信息素的定向反应,在自然界中具有重要的生态功能[20,21]。
本研究选择的16种非寄主植物挥发物在10-1mol/L浓度下均能引起斑鞘豆叶甲成虫的EAG反应,并且雌、雄虫的浓度反应变化趋势一致。萜烯类挥发物为针叶树的特征气味化合物,对天牛、象甲和小蠹科的昆虫具有良好的引诱作用[22],但是对斑鞘豆叶甲表现为驱避作用,这可能由于该害虫以大豆为寄主植物,健康大豆植株挥发物中不含萜烯类化合物。同样发现棉铃虫 Helicoverpa armigera和褐飞虱 Nilaparvata lugens分别对非寄主植物的柠檬烯和崁烯具有明显的驱避反应[23,24],可见这类化合物的结构和功能团与寄主植物挥发物差异较大,可被昆虫嗅觉神经系统中专门的感器神经元所感受,做出响应,被鉴定为不适寄主,从而产生躲避反应[25]。这在嗅觉神经生理的研究中得到进一步证实,试验发现云杉八齿小蠹 Ips typographus中有25%的嗅觉感受神经元对非寄主挥发物有反应,使小蠹避开不适宜寄主[20]。在6种萜烯类化合物中,斑鞘豆叶甲对(1R)-(+)-α-蒎烯、(-)-β-蒎烯、(R)-(+)-柠檬烯和 β-月桂烯 EAG反应较强,且具有显著的驱避反应,在低浓度下也具有较强的驱避作用,可作为驱避剂组分应用于斑鞘豆叶甲的生物防控。另外,试验发现从10-2mol/L增加到10-1mol/L,(1R)-(+)-α-蒎烯和(-)-β-蒎烯对斑鞘豆叶甲EAG反应强度反而降低,(-)-β-蒎烯和β-月桂烯的驱避作用减弱。这种随着挥发物浓度增加昆虫嗅觉反应受到抑制的现象在其他昆虫的研究中也有发现。如褐飞虱对低浓度芳樟醇表现为引诱,高浓度下为驱避[26];华北大黑鳃金龟对高浓度肉桂醛、芳樟醇、苯甲醇无趋向反应,降低浓度时,对三种挥发物的选择反应率超过60%[13,14]。可见昆虫嗅觉感受神经元对挥发物具有一定的浓度反应阈值,在阈值范围内,表现为浓度行为效应,当超过一定浓度则反应受到抑制[27]。因此在驱避剂田间应用时也要考虑挥发物的浓度问题。
斑鞘豆叶甲对醇类和醛类挥发物的 EAG反应较强,行为试验结果表明这些挥发物对斑鞘豆叶甲均有引诱作用,它们为多数植物所释放,具有广谱性,并且在结构上与斑鞘豆叶甲寄主大豆挥发物中的几种醇、醛类化合物相似,这种相似的化合物功能团可能有利于斑鞘豆叶甲触角气味结合蛋白的结合从而引起神经冲动,做出反应[28,29]。因此释放这类化合物的非寄主植物也会吸引它们取食,并且未来在食物缺乏时可能在这些非寄主上定殖危害。比较斑鞘豆叶甲雌、雄虫对该类挥发物的反应发现,雌虫对反-2-己烯醛、反-2-己烯-1-醇和2-乙基-1-己醇三种绿叶气味挥发物的EAG反应相对值均显著高于雄虫,引诱作用也强于雄虫,这表明雌虫触角对绿叶气味挥发物的响应强于雄虫。斑鞘豆叶甲的触角扫描电镜研究结果也发现雌虫指形感器数量明显多于雄虫,该感器在寄主植物检测和选择产卵场所中起着重要的作用[30],由此可以推断绿叶气味化合物可能在斑鞘豆叶甲雌虫产卵定位中起信号作用。
异戊酸乙酯等5种其他挥发物是多数植物的花和果实的气味化合物[31,32],斑鞘豆叶甲对这些挥发物均具有引诱反应,且雄虫反应强于雌虫。研究发现许多昆虫对这类化合物都表现为引诱反应。如异戊酸乙酯对李象鼻虫Conotrachelus nenuphar具有吸引作用[33],乙酸叶醇酯吸引小绿叶蝉Empoasca flavescens取食[34],桉叶素能够显著引诱马铃薯块茎蛾Phthorimaea operculella成虫产卵[35]。这类挥发物的引诱作用可能源于具有的芬芳气味,暗示花的存在,引导昆虫取食花蜜,补充糖分[36,37]。而且在昆虫触角感器上有特定的气味结合蛋白与这些化合物相互作用,实现寄主定位,满足昆虫获取糖原的需求[38]。水杨酸甲酯既是植物挥发物,同时作为植物防御信号分子可诱导植物产生次生代谢化合物[39],研究发现大豆蚜Aphis glycines和二点叶螨Tetranychus urticae等危害后诱导植株释放大量的水杨酸甲酯,对瓢虫、草蛉和食蚜蝇等具有明显的吸引作用,显著增加田间天敌昆虫的种群数量[40-42]。但水杨酸甲酯对斑鞘豆叶甲产生了明显的诱引作用,铜绿丽金龟和玉米根叶甲Diabrotica virgiferea等昆虫也对水杨酸甲酯表现出引诱反应[43,44]。这表明蚜虫等刺吸类害虫危害后释放的水杨酸甲酯可能是对后续其他昆虫定殖提供了寄主植物适合度增强的信号,从而招引大量咀嚼式口器昆虫取食和产卵,但是对一些蚜虫、蓟马和叶蝉等昆虫则产生了排斥作用[45-47]。
由于昆虫在自然环境中,面临着丰富而复杂的嗅觉信息,它们的嗅觉神经系统进化的更加复杂和精细,可以通过探测非寄主特定化合物或者化合物组分比例与正常寄主的差异来调整行为反应[19]。因此,利用非寄主挥发物进行斑鞘豆叶甲的生物防控,还需要进行多组分挥发物综合作用的检测和田间效果评估。
