自组装形成的透明质酸-铜-槲皮素配位聚合物纳米粒子对乳腺癌的协同治疗作用
2021-10-22岳瀚勋余娴赵轩雍琴
岳瀚勋,余娴,赵轩,雍琴
(1.重庆医科大学附属第二医院I期临床试验研究室,重庆 400010;2.中国平煤神马医疗集团总医院,河南 平顶山 467000)
目前,乳腺癌已取代肺癌成为女性发病率最高的恶性肿瘤[1]。随着对乳腺癌研究的深入,越来越多的治疗手段被应用于临床,如化疗、免疫治疗、靶向治疗等[2]。但三阴性乳腺癌(triple-negative breast cancer,TNBC)作为乳腺癌中一种特殊类型,其治疗仍主要为含铂两药联合化疗[3]。尽管联合化疗已明显提高疗效和降低不良反应,但由于药物本身毒性大和治疗缺乏靶向性,导致其不良反应仍较多且难以耐受[4-6]。克服这些问题的有效方法之一就是选择毒性低的药物并将其封装于具有靶向作用的纳米载体中形成纳米药物。槲皮素是一种黄酮类天然化合物,广泛存在于日常饮食中,具有显著抗肿瘤作用和良好的安全性[7]。但槲皮素有口服生物利用度低、水溶性差、代谢迅速及易被酶降解等缺点,限制了其临床应用。对槲皮素进行改性是解决上述问题的有效方法,包括形成金属配合物[8]。铜离子是一种能与槲皮素发生配位作用的副族金属,研究[9]表明,槲皮素-铜配合物具有明确的抗肿瘤作用。此外,铜离子也可通过触发类芬顿反应将肿瘤微环境中过量产生的低毒性过氧化氢(H2O2)转化成更具细胞毒性的羟基自由基(·OH)来达到协同抗肿瘤作用[10]。低分子量透明质酸作为一种高效的肿瘤靶向递送载体,其优越性主要体现在具有良好的生物相容性、生物可降解性和特殊的CD44受体结合能力[11]。在生理条件或适当pH环境下通过透明质酸分子中糖醛酸的羧基充分解离,然后与铜离子形成离子对,可使槲皮素-铜配合物靶向高表达CD44受体的肿瘤细胞。本研究拟将槲皮素作为化学治疗剂和自载材料,铜离子作为连接点和类芬顿反应试剂,透明质酸作为靶向递送载体,利用上述材料自组装形成配位聚合物纳米粒的方法开发一种具有多功能的透明质酸-铜-槲皮素配位聚合物纳米粒(hyaluronic acid-cu-quercetin coordination polymer nanoparticles,HCQ NP)并阐明其体外抗三阴人乳腺癌的作用。
1 材料与方法
1.1 实验材料
槲皮素(Sigma-Aldrich公司),氯化铜(梯希爱(上海)化成工业发展有限公司),透明质酸(Lifecore Co.(Chaska,MN)),Tris-Hcl 8.8(上海碧云天生物技术有限公司),二甲基亚砜(DMSO,重庆塞米克),亚甲蓝(上海碧云天生物技术有限公司),CCK-8细胞计数试剂(MCE公司),RPMI-1640培养基、胎牛血清、胰酶细胞消化液(重庆塞米克),三阴人乳腺癌细胞株MDA-MB-231来自于重庆市生物化学与分子药理学重点实验室。人正常肝组织细胞LO2细胞来自于厦门大学。
1.2 方法
1.2.1 HCQ NP的合成及表征 HCQ NP的合成采用自组装方法,具体如下:吸取1 mL透明质酸溶液(10 mg/mL)和150 μL氯化铜溶液(5 mg/mL)于反应瓶中,并将其置于磁力搅拌器上以500 rpm搅拌反应4 min;然后吸取150 μL Tris-Hcl 8.8溶液加入反应瓶中反应4 min,以促进透明质酸与铜离子充分反应;吸取125 μL 槲皮素溶液(20 mg/mL)逐滴加入到反应瓶中反应4 h;最后将上述反应液透析24 h并于室温下保存备用。将HCQ NP样品和经过硝化和干燥处理的样品分别进行透射电镜、动态光散射、电感耦合等离子体质谱(inductively coupled plasma massspectrometry,ICP-MS)和红外光谱(fourier transform infrared spectrometer,FT-IR)检测,测定HCQ NP的形态、粒径、样品中铜离子的含量及纳米粒的结构。
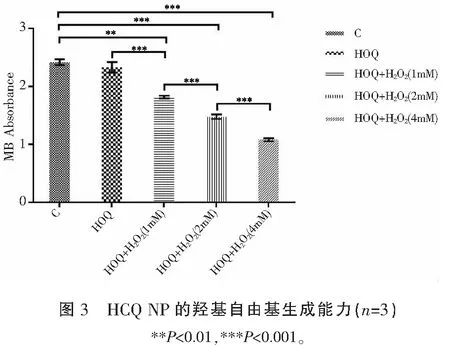
1.2.2 HCQ NP生成羟基自由基能力的检测 采用亚甲蓝光度法。设置HCQ NP组(HCQ);HCQ NP+1nM H2O2组[HCQ+H2O2(1nM)];HCQ NP+2nM H2O2组[HCQ+H2O2(2nM)];HCQ NP+4nM H2O2组[HCQ+H2O2(4nM)],亚甲蓝溶液组(methylene blue,MB)为空白对照。将上述各组与亚甲蓝溶液放置于37 ℃避光条件下孵育30 min;使用紫外可见分光光度计依次测量各组亚甲蓝在波长666 nm处的吸光度。
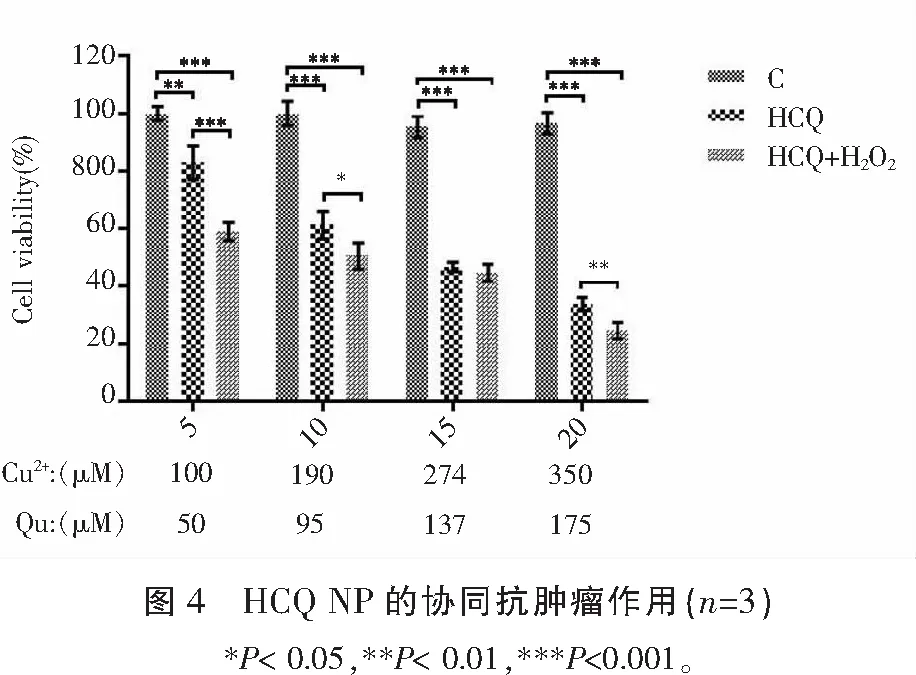
1.2.3 HCQ NP的抗乳腺癌作用检测 采用CCK-8法。设置5 μL HCQ NPs组(HCQ)和5 μL HCQ NP +50μM H2O2组(HCQ+H2O2);10 μL HCQ NPs组(HCQ)和10 μL HCQ NP +50 μM H2O2组(HCQ+H2O2);15 μL HCQ NPs组(HCQ)和15 μL HCQ NP +50 μM H2O2组(HCQ+H2O2);20 μL HCQ NPs组(HCQ)和20 μL HCQ NP +50μM H2O2组(HCQ+H2O2),PBS组为空白对照组;MDA-MB-231细胞接种于96孔板(3×103/孔)中,加入正常培养基贴壁24 h后,吸出原有培养基,各组分别加入正常培养基(含89%RPMI-1640,10%胎牛血清,1%双抗)及各组相应处理因素;置于5% CO2、37 ℃条件下的孵箱中培养48 h;将各组培养基弃去,加入含有10% CCK-8试剂的培养基,培养3 h后用酶标仪在450 nm下检测各组吸光度。
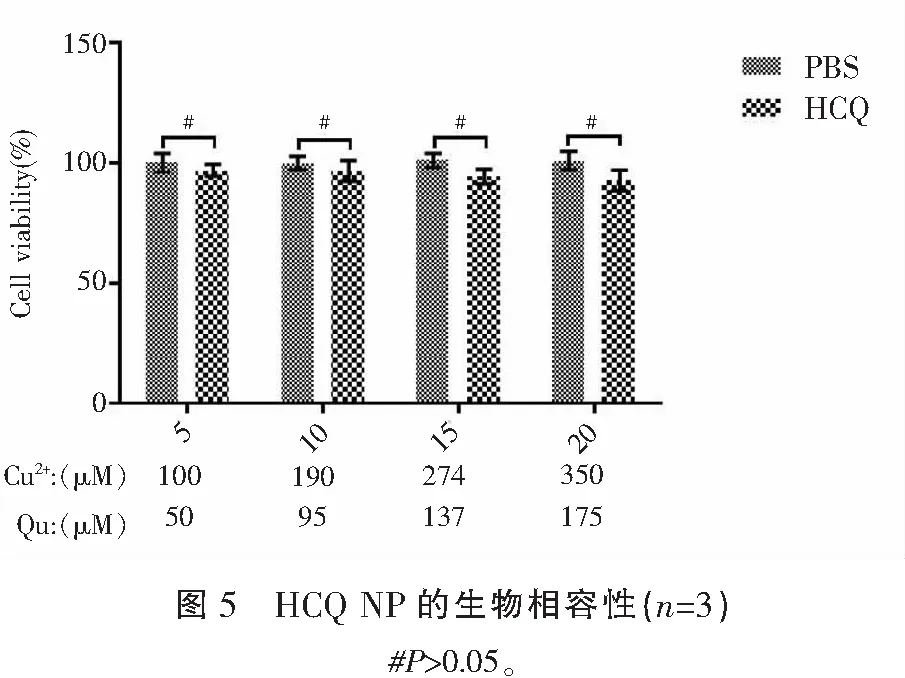
1.2.4 HCQ NP的生物相容性检测 采用CCK-8法。设置5 μL HCQ NPs组(HCQ);10 μL HCQ NPs组(HCQ);15 μL HCQ NPs组(HCQ);20 μL HCQ NPs组(HCQ),PBS组为空白对照组;LO2细胞接种于96孔板(3×103/孔)中,加入正常培养基贴壁24 h后,吸出原有培养基,各组分别加入正常培养基(含89% RPMI-1640,10%胎牛血清,1%双抗)及各组相应处理因素;置于5% CO2、37 ℃条件下的孵箱中培养48 h;将各组培养基弃去,加入含有10%CCK-8试剂的培养基,培养3 h后用酶标仪在450 nm下检测各组吸光度。
1.3 统计学分析
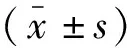
2 结果
2.1 HCQ NP的表征
透射电镜观察显示,HCQ NP的形状类似球形,大小均一。通过动态光散射检测的粒径结果比透射电镜的大的主要原因是动态光散射检测的是纳米粒的水合粒径。HCQ NP经硝化处理后通过ICP-MS测得铜离子浓度为6.663 mg/L,根据硝化处理时的稀释比例计算得合成的HCQ NP 样品中铜离子浓度为133.262 mg/L。将经干燥处理后得到的 HCQ NP粉末进行红外检测,通过对比发现HCQ NP的红外吸收光谱上存在槲皮素及透明质酸的特征吸收峰,但有部分偏移,槲皮素中羰基(C=O)的振动频率位于1 661 cm-1,制备成纳米粒后C=O向低波数方向发生位移,表明槲皮素羰基参与了配位作用。相比于槲皮素振动频率位于1 308 cm-1的C-OH(C-3位),纳米粒中消失,表明该结构也参与了与铜离子的配位[12]。见图1、图2及表1。
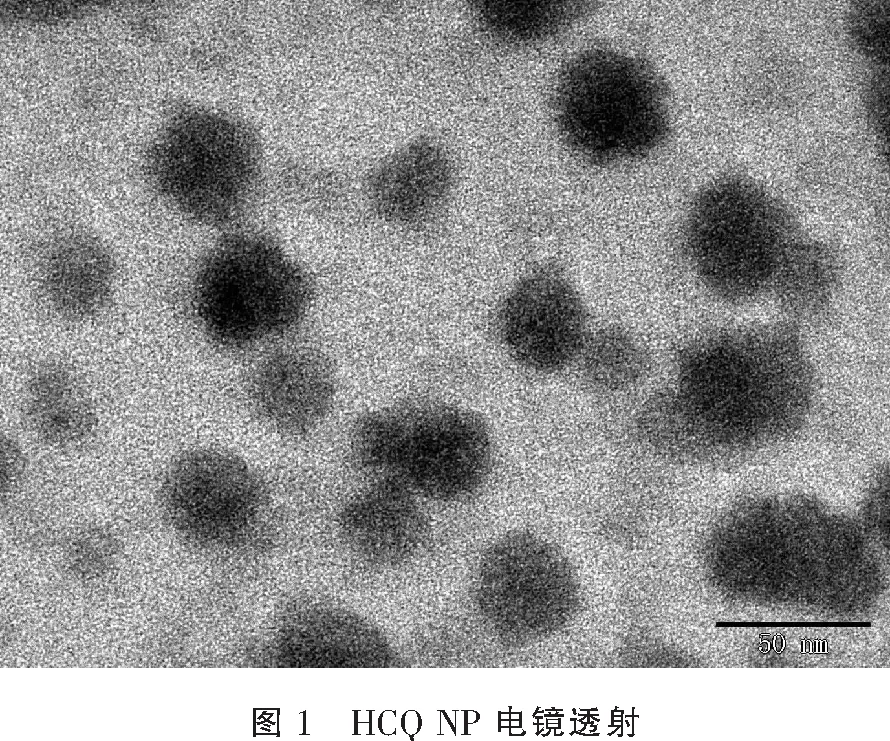
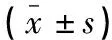
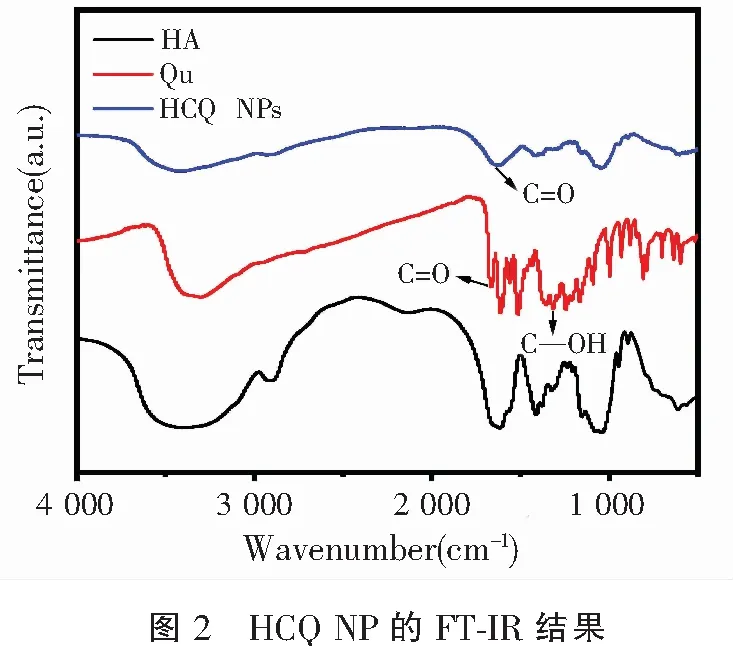
表1 HCQ NP的粒径和zeta电位径
2.2 HCQ NP生成羟基自由基的能力
检测HCQ NP生成羟基自由基能力,结果显示相对于对照组和HCQ NP组,HCQ NP+ H2O2组更能生成羟基自由基,导致MB吸光度下降,且随着H2O2浓度的提高,MB的吸光度也降低(P<0.05)。见图3。
2.3 HCQ NP的协同抗肿瘤作用
HCQ组和HCQ+H2O2组对MDA-MB-231细胞增殖的抑制作用强于对照组(P<0.05),HCQ+H2O2组强于HCQ组(P<0.05),且随着剂量的增大,抑制作用也随之加强。见图4。
2.4 HCQ NP的生物相容性
相对于对照组,HCQ组在不同剂量下均未对LO2细胞产生明显的影响(P>0.05)。见图5。
3 讨论
TNBC作为乳腺癌中一种特殊类型,具有高侵袭和高转移的特性,是目前乳腺癌中预后最差的一种亚型。由于内分泌治疗和针对HER-2的靶向治疗对TNBC无效,至今对TNBC仍缺乏令人满意的综合治疗方案[13]。槲皮素作为天然化合物的代表,具有良好的安全性和广泛的抗癌谱,能够通过改变细胞周期进程、抑制细胞增殖、促进细胞凋亡、抑制血管生成等多种途径发挥抗肿瘤作用[7]。研究[14]表明,槲皮素对TNBC包括其代表细胞MDA-MB-231有良好的抑制作用。化学动力学疗法是一种新兴的抗肿瘤疗法,具有无创、高效等特点,通过芬顿或类芬顿反应,将肿瘤微环境中过量产生的H2O2转化为更具细胞毒性的羟基自由基,从而达到抗肿瘤作用[15-18]。但由于槲皮素存在水溶性差、酶降解等问题影响临床应用,所以需要对其进行改性。形成金属配合物是改性方法之一[8],不仅克服了临床应用限制问题,还引入了铜离子,从而引入了化学动力学疗法,使其具有协同抗乳腺癌作用。
本实验成功制备了HCQ NP(图1、表1及图2)。随后亚甲蓝吸光度实验表明,只有在H2O2存在的情况下,HCQ NP才能产生羟基自由基,从而使亚甲蓝的吸光度降低,而且H2O2浓度越高,产生羟基自由基的能力越强(图3),提示在肿瘤微环境下(与正常组织相比,具有高浓度H2O2的特点),可望通过化学动力学疗法发挥抗肿瘤作用。TNBC具有易复发的特点,所以需要联合疗法以求最大程度的杀灭癌细胞。肿瘤微环境相比于正常组织具有高浓度H2O2[19],本实验证实(图4)在模拟肿瘤微环境下,即HCQ+H2O2组具有更显著的抗肿瘤作用。出现这种结果的原因是在没有H2O2存在的情况下,HCQ NP发挥抗乳腺癌作用依靠的是槲皮素的作用;而在模拟肿瘤微环境下,即H2O2存在的情况下,HCQ NP除了具有槲皮素的抗乳腺癌作用外,还具有铜离子通过触发类芬顿反应而发挥的化学动力学抗乳腺癌作用。此外由于纳米粒通常会在肝脾等血流丰富的器官蓄积造成严重的不良反应[20],所以在研究中我们选择了人正常肝组织细胞LO2来验证HCQ NP的生物相容性,而实验表明HCQ NP未对正常细胞产生明显的影响(图5),说明HCQ NP生物相容性良好。
综上,本研究中槲皮素作为化学治疗剂和自载材料、铜离子作为连接点和类芬顿反应试剂、透明质酸作为靶向递送载体自组装形成的HCQ NP,具有明确的化学治疗与化学动力学治疗协同的抗三阴乳腺癌作用,且具有良好的生物相容性。
