miR-182-5p和自噬在外周血单个核细胞和THP-1细胞痛风性关节炎模型炎症反应中的研究
2021-10-22黄玉琴谢艳李涛黄倩青玉凤郑建雄张全波
黄玉琴,谢艳,李涛,黄倩,青玉凤,郑建雄,4,张全波
(川北医学院附属医院,1.高尿酸血症与痛风研究所;2.老年科;3.风湿免疫科;4.川北医学院临床医学系;5.仪陇县人民医院,四川 南充 637000)
痛风是机体持续高尿酸水平和尿酸盐(monosodium urate,MSU)晶体析出并沉积于关节、肌腱和/或其他组织器官中而引起组织损伤的一组临床综合征。急性痛风性关节炎(acute gout,AG)是MSU晶体沉积在骨关节、皮下及软组织中引起的急性和极度疼痛的一种严重表型炎症反应。研究证实,痛风的急性炎症反应与Toll样受体(Toll like receptor,TLR)4-核因子(nuclear fator,NF)-κB信号通路被激活,促进白细胞介素(IL)-1β等炎症因子释放密切相关[1]。自噬是一个进化保守的,通过包绕隔离细胞质成分,包括受损的或功能减退的细胞器及错误折叠的蛋白质及大分子物质,并与溶酶体融合水解膜内成分的现象[2]。研究[3]发现原发性急性痛风性关节炎患者自噬通量增加、自噬被激活,提示自噬在调控痛风患者炎症反应过程中具有重要意义。
MiRNAs是一个短的、小的、非编码RNAs家族。近年来研究发现,miRNA可作为一种竞争性内源性RNA(competing endogenous RNA,ceRNA)与LncRNA相互作用,参与靶基因的表达调控,并在多种疾病的发生发展中发挥重要的作用[4]。最近,miR-182在各种炎症性疾病中被发现。如miR-182-5p通过调节TLR4/NF-κB信号通路来抑制脂多糖诱导的RAW264.7细胞的炎症反应[5],通过靶向TLR4抑制氧化低密度脂蛋白诱导的氧化应激[6]。在小鼠关节炎模型中,使用miR-182拮抗剂可显著降低炎症和组织破坏的组织学评分[7]。然而,miR-182-5p在痛风中的作用仍然鲜为人知。综合数据库和芯片分析的结果,本研究通过对急性期痛风患者、间歇期痛风患者及健康对照者(各5例)的PBMCs全基因组表达芯片分析挑选出差异最显著的miR-182-5p,再挑选出具有miR-182-5p识别序列的linc00173和linc00963,拟通过模拟体内痛风发作过程,探讨miR-182-5p与自噬及痛风关节炎可能存在的关联。
1 材料与方法
1.1 材料
1.1.1 主要仪器及试剂 LightCycler®96 PCR仪(Roche公司,瑞士),人淋巴细胞分离液(天津灏洋生物公司),反转录试剂盒(Takara公司,日本),实时荧光定量PCR试剂盒(Takara公司,日本),Trizol提取总RNA试剂盒(Invitrogen公司,美国),低温高速离心机5417R(Eppendrof公司,美国),紫外分光光度仪(Thermo fisher公司,美国),RPMI培养基(Thermo公司,美国),胎牛血清(浙江天杭生物,中国),人白介素1β检测试剂盒(USCN公司,中国),GAPDH rabbit mAb(美国Cell Signaling公司),LC3-2 rabbit mAb(美国Cell Signaling公司),IL-1β rabbit mAb(美国Cell Signaling公司),miR-182-5p primer(美国GeneCopoeia公司),U6内参(美国GeneCopoeia公司),All-in-one TM miRNA qRT-PCR Detection Kit(美国GeneCopoeia公司),GAPDH内参及自噬相关基因引物(上海生工生物工程有限公司,中国)。
1.1.2 引物设计及合成 根据相关基因的CDS序列,基因引物由上海生工生物工程公司设计及合成,基因序列。见表1。
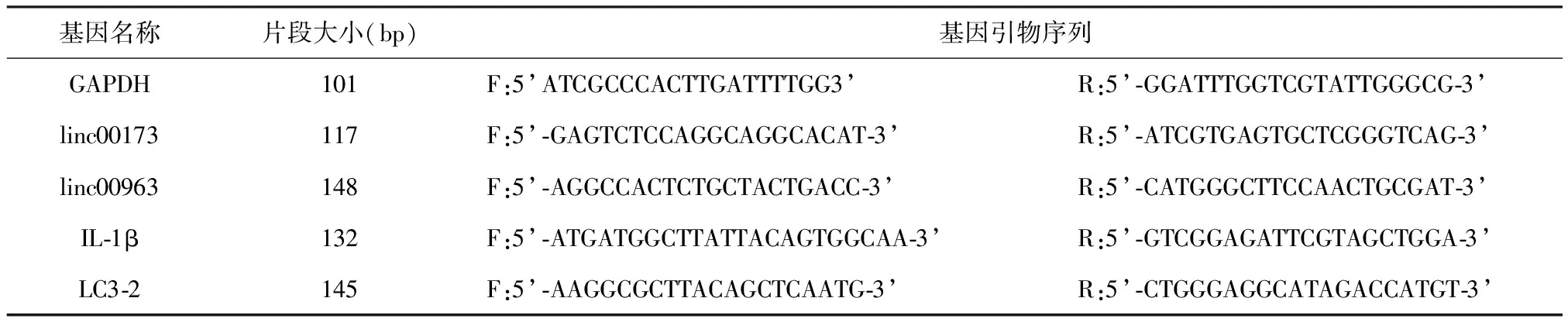
表1 引物序列
1.2 方法
1.2.1 MSU刺激健康男性外周静脉血 抽取5例健康男性外周静脉血24 mL(4 mL/管),肝素钠抗凝,使用浓度为100 μg/mL MSU刺激后置于含5 % CO2的37℃细胞培养箱中孵育,按照0、1、2、4、6、8 h不同时间点分离血浆及提取外周血单个核细胞(peripheral lood mononuclear cells,PBMCs)进行下一步实验。
1.2.2 细胞培养 人髓系白血病单核细胞(THP-1)购自于American Type Culture Collection,用含10 %胎牛血清的RPMI培养基培养,置于37℃ 5 % CO2培养箱中培养,视细胞生长情况24~48 h更换培养基,当细胞生长于培养皿中密度达到70~80 %时,1 200 rpm离心5 min后弃去上清液,将重悬细胞按1∶3的体积比传代。
1.2.3 THP-1细胞痛风炎症造模 将THP-1细胞接种于6 cm培养皿内(细胞约3.6×106个/皿),待细胞融合至70~80 %时,用100 ng/mL佛波脂(37℃、5 % CO2培养48 h)诱导THP-1细胞成为贴壁的巨噬细胞。待细胞贴壁后弃培养基,加入新的含有100 μg/mL MSU的培养基并置于含5 % CO2的37℃细胞培养箱中孵育0、3、6、9、12 h后,收集细胞培养上清液500 μL,3 000 rpm离心10 min,留上清,弃沉淀。培养皿细胞用PBS液清洗3次,3 min/次,清除MSU后得巨噬细胞进行下一步实验。
1.2.4 RNA的提取及检测 采用Trizol法提取PBMC/THP-1细胞中总RNA,紫外分光光度仪测定RNA浓度,选取吸光度为1.8~2.0用于反转录合成cDNA。RT-qPCR总体积为20 μL。反应体系:10 μL Power SYBR Green PCR Master Mix,7.4 μL去离子水,正向及反向引物各0.3 μL,2 μL cDNA。反应条件为:第一步:95℃ 30 s 1个循环→95℃ 5 s→60℃ 34 s 40个循环。第二步:95℃ 5 s→60℃ 60 s→95℃ 15 s 1个循环。每份标本均设2个复孔,反应结束后作溶解曲线。以目的基因的Ct值减去内参的Ct值为△Ct,2-△△Ct值表示目的基因mRNA表达的高低。采用All-in-one试剂盒进行反转录miR-182-5p为cDNA,以U6为内参。PCR反应体系:2×All-in-one qPCR Mix 10 μL,All-in-one TM qPCR Primer(2 μM)2 μL,Universal Adaptor PCR Primer 2 μL,RNase free water 4.0 μL,First-stand cDNA 2.0 μL,将上述20 μL反应体系加入96孔PCR板中。在LightCycler®96 PCR仪上按照95℃预变性10 min 1个循环;变性95℃10 min,退火60℃ 20 min,延伸72℃ 1 min,共45个循环。U6作为内参照,△Ct=(目的基因-内参对照U6)的Ct值。目的基因序列相对表达量用2-△△Ct表示。
1.2.5 酶联免疫吸附法(ELISA法)检测THP-1培养基中及人上清液IL-1β蛋白浓度 按照USCN公司生产的人IL-1β酶ELISA试剂盒说明书使用,A值用SPSS软件绘出标准曲线,计算各样本的值。
1.2.6 蛋白免疫印记法(Western Blot)MSU刺激THP-1和PBMC细胞后的LC3、IL-1β蛋白水平的表达 向THP-1和PBMC细胞中加入含有1 % PMSF的RIPA(强效)裂解液,取上清液,用BCA法进行蛋白定量。严格按照Western Blot方法操作,ELC显色。用Image J软件对图片中条带的灰度值进行分化计算目的基因蛋白条带与GAPDH蛋白条带灰度值的相对比值,各组实验重复5次。
1.3 统计学分析
2 结果
2.1 MSU刺激健康男性外周血PBMCs
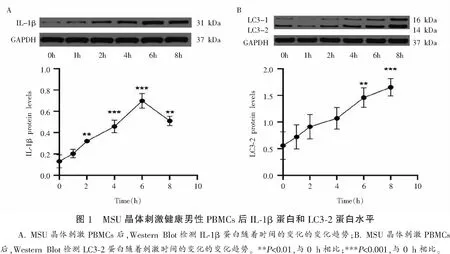
2.1.1 MSU刺激后不同时间点IL-1β表达水平比较 经MSU刺激0、1、2、4、6、8 h后,6组IL-1β mRNA表达水平、IL-1β蛋白浓度及IL-1β蛋白表达水平比较,差异均有统计学意义(F=88.559、351.325、51.086,P<0.001),且1、2、4、6、8 h IL-1β mRNA水平均高于0 h(P<0.05),1、2、4、6 h IL-1Β蛋白浓度均高于0 h(P<0.01),2、4、6、8 h IL-1β蛋白表达水平均高于0 h(P<0.05)。见表2。
表2 MSU刺激后不同时间点IL-1β表达水平比较
2.1.2 MSU刺激后不同时间点linc00173、linc00963、miR-182-5p及LC3-2 mRNA表达水平比较 经MSU刺激0、1、2、4、6、8 h后,6组linc00173、linc00963、miR-182-5p及LC3-2 mRNA表达水平比较,差异有统计学意义(F=16.985、40.858、3.676、12.547,P<0.05),且1、2、4 h linc00173水平高于0 h(P<0.05),1、2 h linc00963水平高于0 h(P<0.01),8 h miR-182-5p水平高于0 h(P<0.05),4、6、8 h LC3-2 mRNA表达水平高于0 h(P<0.05)。见表3。
表3 MSU刺激后不同时间点linc00173、linc00963、miR-182-5p及LC3-2表达水平比较
2.1.3 MSU刺激后不同时间LC3-2蛋白表达水平比较 经MSU刺激0、1、2、4、6、8 h后,6组LC3-2蛋白表达水平比较,差异有统计学意义(F=6.643,P<0.05),且6、8 h表达水平高于0 h(P<0.01)。见表4及图1。
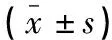
表4 MSU刺激后不同时间点LC3-2蛋白表达水平比较
2.2 MSU刺激THP-1细胞
2.2.1 MSU刺激后不同时间IL-1β表达水平比较 经MSU刺激0、3、6、9、12 h后,5组IL-1β mRNA表达水平、IL-1β蛋白浓度及IL-1β蛋白表达水平比较,差异有统计学意义(F=14.792、54.072、7.806,P<0.01),且3、6、9、12 h IL-1β mRNA水平及IL-1β蛋白浓度高于0 h(P<0.05),9、12 h IL-1β蛋白水平高于0 h(P<0.01)。见表5。
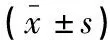
表5 MSU刺激后不同时间点IL-1β表达水平的比较
2.2.2 MSU刺激后不同时间linc00173、linc00963、miR-182-5p及LC3-2 mRNA表达水平比较 经MSU刺激0、3、6、9、12 h后,5组linc00173、miR-182-5p及LC3-2表达水平比较,差异有统计学意义(F=4.084、2.885、21.173,P<0.05,),且9、12 h linc00173水平高于0 h(P<0.05),6 h miR-182-5p低于0 h(P<0.05),6、9、12 h LC3-2 mRNA水平高于0 h(P<0.01);5组linc00963表达水平比较,差异无统计学意义(F=0.904,P=0.477)。见表6。
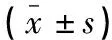
表6 MSU刺激后不同时间点linc00173、linc00963、miR-182-5p及LC3-2表达水平比较
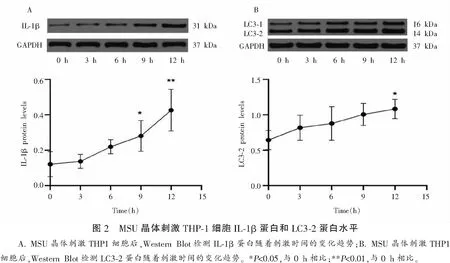
2.2.3 MSU刺激后不同时间LC3-2蛋白表达水平 经MSU刺激0、3、6、9、12 h后,5组LC3-2蛋白表达水平比较,差异有统计学意义(F=4.157,P<0.05)。见表7及图2。
表7 MSU刺激后不同时间点LC3-2蛋白表达水平比较
3 讨论
痛风是由于体内嘌呤代谢异常和/或尿酸排泄异常导致的,当尿酸超过血液饱和浓度并沉积在关节滑液中形成MSU时,会诱发急性关节炎发作。急性痛风性关节炎是由免疫细胞和MSU之间的相互作用引起的炎性反应[8]。痛风发作的机制尚未完全了解,但普遍认为中性粒细胞和巨噬细胞在其中起着至关重要的作用。MSU刺激巨噬细胞表面的TLR激活NF-κB信号通路产生炎症小体,然后,MSU通过促进细胞内K+外排激活NLRP3炎性体从而诱导IL-1β的产生[9]。然而,自噬可降低NLRP3的蛋白表达减慢炎症反应[10],自噬的丧失激活炎症小体介导的IL-1β分泌[11],表明自噬具有抑制炎症的能力。近年来,随着对非编码RNA的深入研究发现占转录组98%的非编码RNA的突变可能是导致疾病发生的“罪魁祸首”,甚至可能是某些疾病临床预后的标记分子。研究[12]表明,miR-182-5p与自噬相关基因相互作用参与疾病发展。中性粒细胞和巨噬细胞在痛风的发生中起重要作用,可能通过miR-182-5p介导痛风的炎症过程。
本研究发现,MSU刺激健康男性PBMCs后,经RT-qRCR、Elisa、Western blot检测发现,IL-1β在不同时间点都有所升高,且随着刺激时间的延长有下降趋势,提示MSU已经诱导出炎症,且可能存在负反馈调节。miR-182-5p在8 h明显升高,linc00173和linc00963均在2 h达到最大值,随后下降,表明miR-182-5p可能参与了痛风炎症的调节,在痛风模型中下调IL-1β mRNA水平的同时还下调了linc00173和linc00963的表达,但具体调控机制不详。miR-182是miR-183簇的一员,在多种疾病中发挥重要作用和影响,如miR-182间皮瘤通过靶向叉头盒O1(Forkhead box O1,FOXO1)增殖和侵袭[13]。miR-182通过调节FOXO3增加非小细胞肺癌细胞的抗辐射性[14]。miR-182-5p是酒精性肝炎中表达最高的miRNA,miR-182-5p的过度表达导致胆汁细胞中炎症介质的上调[15]。
先天免疫途径在痛风的发病机制中起着关键作用,尤其是NLRP3型炎症小体的激活,导致IL-1β和其他促炎细胞因子的释放。然而,自噬参与了NLRP3的降解。自噬通过抑制NLRP3炎症小体减轻线粒体潮湿所致的急性肺损伤[16]。紫甘薯色素通过增强细胞自噬减弱了NLRP3炎症小体的活性,最终延缓了内皮细胞的衰老,从而改善了心血管并发症[17]。研究发现,miR-182-5p过表达增加了促炎基因诱导,启动了巨噬细胞增加自噬[18]。本研究观察到,LC3-2 mRNA和蛋白随着刺激时间的延长有所增加,提示自噬可能参与抑制MSU诱导的致炎因子的释放,并可能受miR-182-5p的调节,可能是痛风患者自发缓解的机制。
Hu等[19]发现,lncRNA ANRIL通过ceRNA机制与miRNA-122-5p结合从而激活NLRP3炎性体并加速尿酸诱导的炎症的发展。本研究首先确定了linc00173、linc00963、miR-122-5p和自噬与痛风相关。尽管没有清楚地证明它们在痛风中存在ceRNA机制,但大量研究表明miRNA可以与lnRNA或mRNA相互作用。因此,可以合理假设ceRNA的机制可能在痛风中发生。首先,综合数据库和芯片分析的结果,挑选出了痛风患者中差异最显著的miR-182-5p,在挑选出具有miR-182-5p识别序列的linc00173和linc00963。其次,通过功能学细胞实验进一步证实了它们在痛风中确实存在差异表达。这也是本小组未来要重点研究的内容。
此外,通过比较THP-1细胞经MSU刺激后上述指标的变化,结果发现,miR-182-5p、linc00173、linc00963和LC3-2 mRNA都出现了不同的改变。虽然和健康男性MSU刺激结果变化趋势不完全一致,但更进一步说明痛风患者ncRNA和自噬存在异常,其在痛风炎症反应过程中发挥了重要的作用。而变化趋势不一致可能为THP-1为悬浮单核细胞,诱导为巨噬细胞需要佛波酯的干预,佛波酯对细胞存在一定毒性作用;THP-1长期体外培养可能改变细胞活力。
综上,miR-182-5p及自噬在痛风中起着重要作用,可能作为痛风关键病理过程的中央调节剂,用于痛风的诊断、治疗及预测临床结局,但目前尚不清楚其在痛风的发生及自发缓解中的具体机制,miR-182-5p和自噬的特定作用仍然需要大量挖掘。
