基于质谱技术的药物代谢产物鉴定策略进展
2021-10-22周惠
周惠
(泰州市第三人民医院,江苏 泰州,225300)
目前对于MDPV 药物的检测,主要集中在气相色谱-质谱联用法、液相色谱法等。液相色谱-质谱(LC-MS)技术属于较为先进技术,目前被广泛用于食品、医药等方面。1 次进样后可以获取二级以及三级子离子的全扫描质谱图,定性分析时,获取的化合物结构信息比四级杆质谱多,由此液相色谱-电喷雾离子阱质谱联用技术已成为代谢物结构分析的常用方法。本次研究主要探讨采用液相色谱-电喷雾离子阱质谱联用技术,构建MDPV 药物代谢产物的鉴定方法,对于代谢动力学、病毒学等方面均具有一定指导意义。
1 资料与方法
1.1 样品来源检测样品为亚甲基二氧吡咯戊酮(MDPV),来源于安徽省公安厅合肥市公安局提供;SD 大鼠,均为雄性。
1.2 试验条件色谱条件:色谱柱(150mm×2.1mm,5μm),流动相为醋酸铵-甲酸缓冲溶液,甲醇为B 为洗脱液,0-1min,10%B,1-6min,10%B-90%B,6-14min,90%B,0.2ml/min,10 μL。质谱条件为电喷雾离子化源、正离子检测,全离子扫描,选择反应监测扫描模式,毛细血管350℃,雾化气30.00L/min,加热辅助气8.00L/min,吹扫气2.00L/min。
1.3 体外代谢与样品处理过程配置MDPV 样品浓度,加入蒸馏水溶液调整样品浓度为50.0μg/ml,制成标准品溶液,获取适量标准品溶液于试管,再加2.0mg/ml 蛋白质溶液的SD 大鼠肝微粒体S9组分KCl-PBS 缓冲溶液,剂量为200μL,混匀,再试管置于水浴锅内进行孵育处理,再予以适量的NADPH KCl-PBS溶液,获取MDPV 孵育体系,MDPV(5.0 μ g/ml)、NADPH(1.0mmol/L)、肝微粒体蛋白质(1.0mmol/L)。将其置于水浴锅孵育,加乙腈,混匀,冰浴,离心,14000r/min,过有机滤膜,采用LC-MS 检测。
2 结果
2.1 构建MDPV 及代谢物的LC-MS 方法优化实验条件下MDPV分析的LC-MS 图谱,见图1。
2.2 MDPV 以及其代谢物的LC-MS 分析色谱图MDPV 以及其代谢物的LC-MS 分析色谱图。见图2。
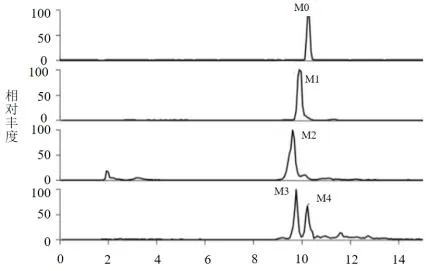
图2 MDPV 以及其代谢物的LC-MS 分析色谱图
2.3 大鼠肝微粒体S9 组分中MDPV 浓度孵育时间变化趋势随着大鼠孵育时间的增加,MDPV 浓度逐渐下降,孵育时间至120min时,MDPV 浓度无明显变化,由此,最终确定孵育最佳时间为120min。见图3。

图3 大鼠肝微粒体S9 组分中MDPV 浓度孵育时间变化趋势
2.3 MDPV 代谢物的MSn图谱化合物M2色谱保留时间9.64min,m/z 为264.3,经过二级串联质谱分析,m/z 为193.0,经过三级串联质谱分析,m/z 为175.0。见图4。

图4 MDPV 代谢物的MSn图谱
3 讨论
本次研究采用多级串联质谱法,确定MDPV 及其代谢物,与MDPV 样品色谱保留时间以及各级色谱行为,最终鉴定为MDPV。二级串联质谱m/z 为207.0,对于MDPV 在一致条件下获取的准分子离子以及二级串联质谱,三级串联质谱基峰离子具有一致性,表明二者存在相似骨架结构,因为MDPV 的化学结构与MDMA相似,MDMA 在体外代谢产物主要为HMMA,而HMMA 与MDMA 质谱基峰离子相差2Da,由此,进一步推测该化合物为MDPA 的代谢物去亚甲基-甲基化产物1-(4-羟基-3-甲氧基)苯基-2-吡咯戊酮。化合物M2m/z 为264.3,对于MDPV 基峰降低12Da,经过二级串联质谱分析,得到m/z193.0,经过三级串联质谱分析,获取碎片离子m/z175.0,推测M2 化合物为MDPV 的去亚甲基产物1-(3,4-二羟基)苯基-2-吡咯戊酮。本次研究鉴定结果与肖惠贞等人研究具有一致性[3]。化合物M3 和M4m/z 相同,对于MDPV 增加了16Da,三级质谱碎片分别为191.1、258.2,色谱保留的时间也存在差异,进一步推测M3 和M4 为同分异构体[4]。
本次研究所构建的体系成本小,设备要求低,另外可以在较短时间检测代谢产物,便于提取、分离、纯化等,本研究采用LC-MS 分析药物代谢产物,一定程度为代谢动力学、病毒学等提供参考。
