超声波辅助乳酸菌发酵制备核桃多肽工艺
2021-10-20贺莹冯谈林冯彩平
贺莹,冯谈林,冯彩平
吕梁学院生命科学系(吕梁 033000)
核桃属于胡桃科植物,又称羌桃,是世界著名“四大干果”之一[1]。核桃是山西吕梁的特色产品,且栽培历史悠久。核桃果仁含有丰富的蛋白质、维生素、脂肪、钙、磷、铁等成分,对人体有益,营养价值一般较高。核桃仁不仅具有有效防止人体细胞快速老化、增强人体记忆力、健脑、延缓衰老的功效,同时还具有减少胃肠道对胆固醇消化吸收的作用以及顺气健脾补血、止咳清热化痰、润肺补肾等保健功能[2-3]。
以核桃粕为原料,采用超声波辅助乳酸菌发酵酶解提取核桃里面的多肽,利用超声波辅助发酵可提高发酵周期,所以试验引进超声波技术[4-5],以核桃多肽质量浓度为指标,选择超声功率、料液比、发酵温度和发酵时间为单因素指标,研究这些因素对核桃多肽工艺的影响,通过响应面寻找更优的制备方法,确定最适制备工艺条件,为核桃多肽的工业化生产提供参考技术[6]。
1 材料与方法
1.1 材料与设备
核桃粕(市售);还原性谷胱甘肽(贵州迪大生物科技有限责任公司);三氯乙酸(天津市光复精细化工研究所);CuSO4(福州飞净生物科技有限公司);氢氧化钠(无锡市亚太联合化工有限公司);MRS培养基(青岛海博生物技术有限公司);乳酸菌发酵剂(北京川秀国际贸易有限公司)。
KQ-100KDB数控超声波清洗机(昆山市超声仪器有限公司);YXQ-LS-100SII立式压力蒸汽灭菌器(上海博讯实业有限公司);XM-2500粉碎机(永康市铂欧五金制品有限公司);TG16-W冷冻离心机(湖南湘仪);N2S分光光度计(上海精科有限公司);WT-1002电子天平(赛多利斯科学仪器有限公司);RZ0021标准筛(锦航仪器厂);1250B生化培养箱(国华企业)。
1.2 试验方法
1.2.1 原料处理[7-8]
将原料核桃粕粉碎后,过0.250 mm(60目)孔径筛网,按单因素料液比加入相应的蒸馏水,用高压灭菌锅在121 ℃下灭菌20 min,进行冷却处理。
1.2.2 核桃多肽的提取工艺
超声波处理↘
核桃粕→粉碎后过筛→加蒸馏水→灭菌冷却→接种乳酸菌→发酵→离心分离→测定核桃多肽质量浓度
操作要点:将冷却处理后的料液接种乳酸菌,玻璃棒搅拌混匀,纱布封口,放在生化培养箱中恒温发酵[9],在恒温发酵过程中加入超声波技术辅助发酵制备核桃多肽,发酵完毕后,按照核桃多肽的测定方法进行一系列处理,以3 000 r/min离心分离,在540 nm处测定吸光度,根据标准曲线计算核桃多肽质量浓度。
1.2.3 乳酸菌的菌种活化
将乳酸菌接种到已配好的固体生化培养基上,放于生化培养箱中在37 ℃下静态放置,活化48 h,在超净无菌工作台上用接种环循环挑取少量菌体接入已灭菌消毒后的液体培养基中培养,在温度37 ℃、摇床应在转速180 r/min的培养条件下培养24 h,进行二次扩大培养,将无菌的液体培养基1 mL菌体接入100 mL液体培养基中,温度37 ℃,摇床在转速180 r/min的培养条件下培养24 h,得到种子液备用[10]。
1.2.4 核桃多肽质量浓度测定
标准曲线的测定:用体积分数5%的TCA溶液将还原型谷胱甘肽配制成0.2,0.4,0.6,0.8,1.0,1.2和1.4 mg/mL的四肽标准溶液于10 mL容量瓶中充分定容,取6.0 mL上述四肽标准溶液,加入4.0 mL双缩脲试剂,充分搅拌混匀静置10 min后,以3 000 r/min离心5 min,在540 nm波长处测定其吸光度,以6 mL的5%三氯乙酸溶液与4 mL双缩脲试剂反应后的标准溶液作为空白对照,绘制标准曲线,其线性回归方程为y=0.377 5x+0.026 3,相关系数R2=0.998 2,说明多肽质量浓度在0.2~1.4 mg/mL的范围内与其吸光度呈现良好的线性回归关系。
样品中多肽的测定:准确量取4 mL样品溶液,同时加入4 mL 10%的TCA溶液,充分混匀静置10 min,在3 000 r/min下离心10 min,将离心后的上清液转移到50 mL容量瓶中,用5%的TCA溶液定容,充分振荡摇匀,同样取6.0 mL样液,加入4.0 mL双缩脲试剂,充分混匀后,以3 000 r/min离心10 min,取上清液在540 nm波长处测定吸光度[11]。
1.2.5 单因素试验
以核桃多肽质量浓度为指标,研究超声功率、发酵温度和发酵时间3个因素对核桃多肽提取量的影响[12-13]。
1.2.5.1 超声功率对核桃多肽质量浓度的影响
在料液比1∶1 g/mL、发酵温度37 ℃、发酵时间8 h条件下,探索不同超声功率(50,100,150,200和250 W)对核桃多肽质量浓度的影响。
1.2.5.2 发酵温度对核桃多肽质量浓度的影响
在超声功率100 W、料液比1∶1 g/mL、发酵时间8 h条件下,探索不同发酵温度(35,37,40,43和45℃)对核桃多肽质量浓度的影响[14]。
1.2.5.3 发酵时间对核桃多肽质量浓度的影响
在超声功率100 W,料液比1∶1 g/mL,发酵温度37 ℃条件下,研究不同提取时间(6,8,10,12和14 h)对核桃多肽质量浓度的影响。
1.2.6 响应面试验
结合单因素试验,选择超声功率(A),发酵温度(B)和发酵时间(C)3个因素进行三因素三水平的响应面试验,以核桃多肽质量浓度(Y)为指标,探索研究提取核桃多肽的最佳工艺参数[15]。
1.2.7 数据处理
运用Origin绘图软件绘制各个单因素水平对核桃多肽浓度的影响趋势图,利用Design-Expert 8.0软件对响应面试验结果进行分析与处理。
2 结果与分析
2.1 单因素试验
2.1.1 超声功率对核桃多肽质量浓度的影响
由图1可以看出,在料液比1∶1 g/mL、发酵温度37 ℃、发酵时间8.0 h条件下,核桃多肽质量浓度随着超声功率升高呈先增加后减少趋势,发酵功率达到100 W时核桃多肽质量浓度最高。随着超声功率继续升高,核桃多肽的质量浓度开始逐渐下降,所以试验选取100 W为最适超声功率。

图1 超声功率对核桃多肽质量浓度的影响
2.1.2 发酵温度对核桃多肽质量浓度的影响
由图2可以得出,在超声功率100 W、料液比1∶1 g/mL和发酵时间8.0 h条件下,随着发酵温度升高,核桃多肽质量浓度也随之增加,发酵温度40 ℃时,核桃多肽的质量浓度达到最大,说明乳酸菌在该温度下能够较好地繁殖,发酵温度达到40 ℃后,核桃多肽质量浓度随着发酵温度升高而降低,说明温度偏高不利于乳酸菌发酵,使核桃多肽的质量浓度有所下降。因此,发酵温度选择40 ℃比较合适。
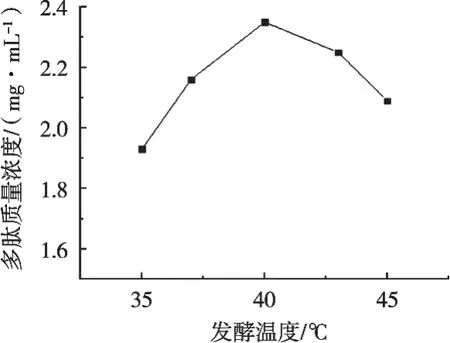
图2 发酵温度对核桃多肽质量浓度的影响
2.1.3 发酵时间对核桃多肽质量浓度的影响
由图3可以得出,在超声功率100 W、料液比1∶1 g/mL和发酵温度37 ℃条件下,随着发酵时间的延长,核桃多肽质量浓度明显升高,提取时间10.0 h时,核桃多肽质量浓度达到最高。提取时间超过10.0 h时,核桃多肽质量浓度开始下降,可能因为发酵时乳酸菌的生长繁殖需要大量营养物质,随着发酵时间延长,多肽和营养物质被乳酸菌利用,导致多肽质量浓度有所下降。故试验选择10.0 h为提取核桃多肽的最适发酵时间。

图3 发酵时间对核桃多肽质量浓度的影响
2.2 响应面优化试验
2.2.1 响应面试验结果
依据单因素试验的结果,选取超声功率、发酵温度及发酵时间为主要考察因素,以核桃多肽质量浓度为指标,进行三因素三水平的响应面试验,试验设计和结果见表1和表2。

表1 响应面试验因素及水平

表2 响应面试验设计及结果
2.2.2 回归模型分析
将响应面试验结果运用Design Expert 8.0进行回归分析,得到超声功率(A)、发酵温度(B)、发酵时间(C)与核桃多肽质量浓度(Y)的二次回归模型:Y=2.86+0.073A-0.036B-0.021C+0.12AB+7.500E-003AC+0.075BC-0.25A2-0.20B2-0.28C2。各项系数绝对值的大小及正负分别表示各因素对核桃多肽质量浓度影响程度的大小和各因素影响的方向,各因素对核桃多肽浓度的影响由大到小依次为A>B>C。
根据表3对回归模型进行方差分析,可以看出模型p=0.000 5<0.01,该模型具有极显著性;失拟项p=0.102 2>0.05,说明在各因素水平范围内,此模型可用于进行试验结果分析和预测。同时由表3可知,在所选的各因素水平范围内,一次项A以交互项AB对多肽浓度的影响达到显著水平,一次项B、C对核桃多肽质量浓度的影响不显著,二次项A2,B2及C2对该模型的影响极为显著。

表3 回归模型分析
2.2.3 因素间的交互作用分析
为研究超声功率、发酵温度、发酵时间两两之间的交互作用对多肽提取量影响程度的大小,由响应面分析软件得到图4~图6,反映各交互项对核桃多肽质量浓度的影响。其中,等高线图的形状能够判断出各因素间交互作用的显著性,等高线呈椭圆表明因素间交互作用显著,而呈圆形表明因素间交互作用不显著。
由图4可以得出,核桃多肽的质量浓度等高线图呈近似椭圆形,故超声功率与发酵温度的交互作用对提取核桃多肽的影响显著,随着制备过程中超声功率增大、发酵温度逐渐升高,核桃多肽质量浓度呈现先逐渐升高后降低趋势。由图5可知,等高线图呈现近似圆形,说明超声功率与发酵时间的交互作用对核桃多肽质量浓度的影响不显著,随着超声功率增大、发酵时间延长,核桃多肽质量浓度呈现先逐渐升高然后降低趋势。由图6可知,随着发酵温度不断升高,核桃多肽质量浓度先增加后减小;随着发酵时间延长,核桃多肽的质量浓度也呈现逐渐升高后下降趋势。由此可知,各因素间交互作用与单因素对核桃多肽质量浓度的影响不一致,超声功率与发酵温度的交互作用对核桃多肽的质量浓度影响显著,其余2项交互项对核桃多肽质量浓度的影响不显著。
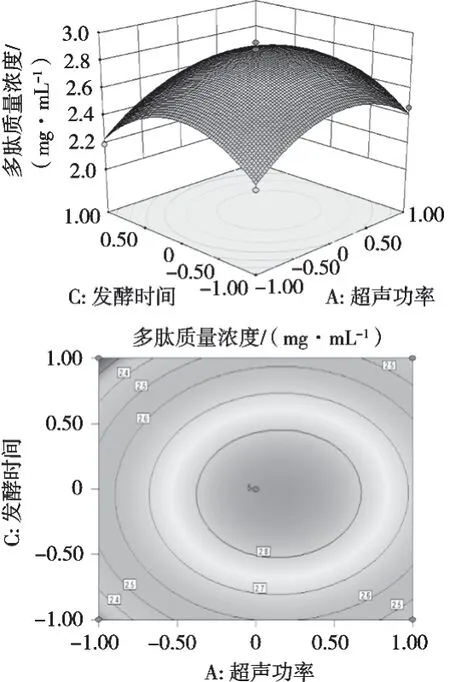
图5 超声功率与发酵时间交互作用的响应面与等高线
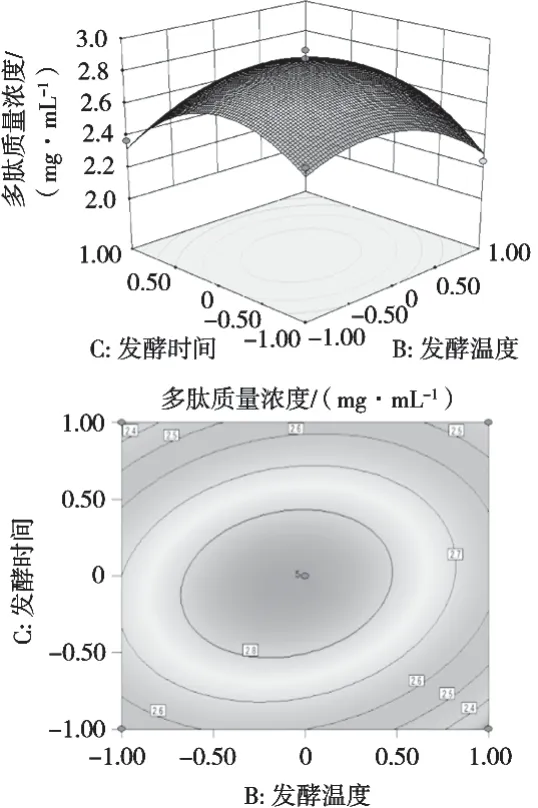
图6 发酵温度与发酵时间交互作用的响应面与等高线
2.2.4 最佳提取条件验证
运用Design-Expert 8.0软件进行提取核桃多肽的工艺条件优化,可得核桃多肽优化提取的最佳试验理论条件:超声功率156.59 W,发酵温度42.35 ℃,发酵时间9.91 h。此时提取的核桃多肽质量浓度为2.868 mg/mL。依据响应面优化试验结果,为方便操作,将核桃多肽的提取工艺条件调整为超声功率156 W,发酵温度42.3 ℃,发酵时间9.9 h,通过3次平行试验,得出该条件下核桃多肽的质量浓度为2.88 mg/mL,与理论值差异不显著,所以得到的回归模型及最佳提取条件真实可靠。
3 结论
采用超声波技术辅助乳酸菌发酵的方法制备核桃多肽,通过单因素试验的设计,得到各因素对于核桃多肽质量浓度的影响趋势图,根据趋势图,随着超声波功率、发酵温度、发酵持续时间的升高和延长,核桃多肽的质量浓度均呈现先上升后下降趋势,确定料液比1∶1 g/mL、超声波功率100~200 W、发酵温度40~45 ℃、发酵时间8~12 h是最佳的工艺条件范围,在此基础上通过三因素三水平响应面法优化试验,全面且直观地设计和分析各因素对核桃多肽质量浓度的影响,以及各因素之间的交互作用,建立回归响应模型,经验证该回归模型合理可靠,核桃多肽的最佳提取工艺条件为超声功率156 W、发酵温度42.3 ℃,发酵时间9.9 h,试验验证,得到的核桃多肽的质量浓度为2.88 mg/mL。
