原发性肝癌术后复发患者再次手术切除与射频消融治疗的临床疗效比较
2021-10-20陈先恒王书领李晓梅由法平潘国政郭宗英袁庆忠
陈先恒,王书领,李晓梅,由法平,潘国政,郭宗英,袁庆忠
1 滨州医学院附属胜利油田中心医院肝胆外科,山东东营 257097;2 潍坊医学院外科学教研室;3 东营市人民医院病案科;4 东营市第二人民医院科教科
原发性肝癌是肝脏最常见的恶性肿瘤,其发病率和病死率在我国恶性肿瘤中分别高居第4 位和第3 位[1-2]。原发性肝癌治疗首选手术,但切除术后易出现复发和转移,术后5年复发率为60%~80%。有研究表明,原发性肝癌行外科切除术后复发患者的再发肿瘤86% 局限于肝脏[3],二次手术切除用于治疗复发性肝癌可以显著延长患者的生存期[4-5]。但是,由于首次切除术后复发性肝癌患者剩余肝脏的体积较小,肝脏储备、代偿能力明显下降,加之复发病灶可能较多、位置不利于手术处理、远处转移等高危因素,复发性肝癌行再次手术切除的机会仅为7%~30%[6]。目前,射频消融术已成为肝癌的根治性手段之一,尤其对于原发性小肝癌,首次采用射频消融术可达到与外科手术切除相似的根治效果[7-9],其治疗复发性肝癌的5年生存率可达40%~80%,且比二次外科手术切除安全性更好,术后并发症更少[10-13]。本研究选取首次接受外科根治切除后复发的原发性肝癌患者58例,分别行再次手术与射频消融术治疗,比较二者的治疗效果,以便为复发性肝癌治疗方式的选择提供临床依据。
1 资料与方法
1.1 临床资料 选择2014年4月—2018年2月在胜利油田中心医院肝胆外科接受诊治的术后复发肝癌患者共58例,男46例、女12例,年龄55~73 岁。纳入标准:所有患者初次根治切除后病理证实为肝细胞癌,术后复发肿瘤仅局限于肝脏内;术前肝功能Child-Pugh 分级为A、B级;无严重心肺疾病,可以耐受手术。排除标准:术前肝功能Child-Pugh 分级为C 级;术前心、肺等重要脏器存在器质性病变,无法接受麻醉或手术;曾经患有其他恶性疾病;临床病理资料缺失,随访资料不全。58例患者依据治疗方式分成两组,其中行手术治疗24例为再次手术组,行射频消融术治疗34例为射频消融组。本研究经医院伦理委员会批准同意,患者或其家属签署知情同意书。
1.2 治疗方法 两组患者术前常规行血常规、肝功、凝血、生化等检测以及肝脏CT 或MRI 等相关影像学检查,进行三维重建评估剩余肝脏体积,行吲哚氰绿实验评估肝功能状况,评估肝功能Child分级为A、B 级。术前与患者及其家属沟通,解释术中可能出现的风险和术后可能出现的并发症以及应对措施,患者治疗均选择在气管插管全麻下进行。①手术治疗:结合术前影像及术中情况决定切除方式,局部肝切除需要切除距肿瘤边缘>1 cm 的肝组织,切除后创面常规电凝确切止血。切除时结合肿瘤位置、大小及术中出血情况决定是否阻断肝门,若行肝门阻断,每次阻断15 min,开放5 min。术中常规放置引流管,术后给予保肝对症处理。②射频消融治疗:结合术前影像学检查肿瘤位置、大小、数目等结果决定是腹腔镜联合超声肝癌消融还是超声引导下经皮肝癌消融。超声引导下经皮肝癌消融采用美国的Valleylab Tyco Coll-Tip 射频消融系统,根据肿瘤的大小及位置选择消融方式;对直径<2 cm 的肿瘤选用单点单次消融,对于肿瘤体积较大者行多位点分层消融;消融时间每次为12 min。术中用超声对肿瘤进行实时监测,待肿瘤区在超声图像下完全被高回声覆盖后停止消融。复温95 ℃后,将电极缓慢拔出肝脏,防止癌细胞针道转移。对于靠近膈肌、肝脏表面的肿瘤,多在膈面注入生理盐水,防治灼伤腹壁或膈肌,消融的操作过程基本同上。
1.3 随访及疗效判定 两组治疗后均定期复查,术后1年内每2个月1次,2~3年每3个月1次,3年后每半年1次;常规复查项目包括血生化、甲胎蛋白、腹部超声、肝脏增强CT 或MRI,根据检查结果判断肿瘤有无复发及转移。分别记录患者以下指标:无瘤生存期(复发性肝癌患者行二次手术或射频消融治疗后至复查时确诊为复发或转移的时间)、中位生存期(复发性肝癌患者再次手术切除或射频消融治疗后生存率为50% 时对应的生存时间)、生存率(复发性肝癌患者接受再次手术或射频消融治疗后活过某些特定的时间后仍存活的患者占患者总人数的比例)、早期复发(肝癌患者手术或射频消融后至发现肝内新发肿物或肝外转移的时间≤12个月)、晚期复发(肝癌患者手术或射频消融后至发现肝内新发肿物或肝外转移的时间>12个月)。
1.4 统计学方法 采用SPSS23. 0 统计软件。符合正态分布的计量资料用±s表示,组间比较采用两独立样本t检验;计数资料用例数或百分比表示,组间比较采用χ2检验或Fisher确切概率法。P<0. 05为差异有统计学意义。
2 结果
2.1 两组再次治疗前临床资料比较 再次手术组男19例、女5例,年龄(63. 3 ± 8. 4)岁,初次切除至复发时间(26. 0 ± 12. 7)个月;射频消融组男27例、女7例,年龄(64. 0 ± 8. 9)岁,初次切除至复发时间(25. 2 ± 12. 3)个月。两组性别、年龄、初次切除至复发时间比较差异均无统计学意义(P均>0. 05)。两组肝功能分级、复发肿瘤数目、位置、大小、血清检测项目均无统计学差异(P均>0. 05)。见表1。
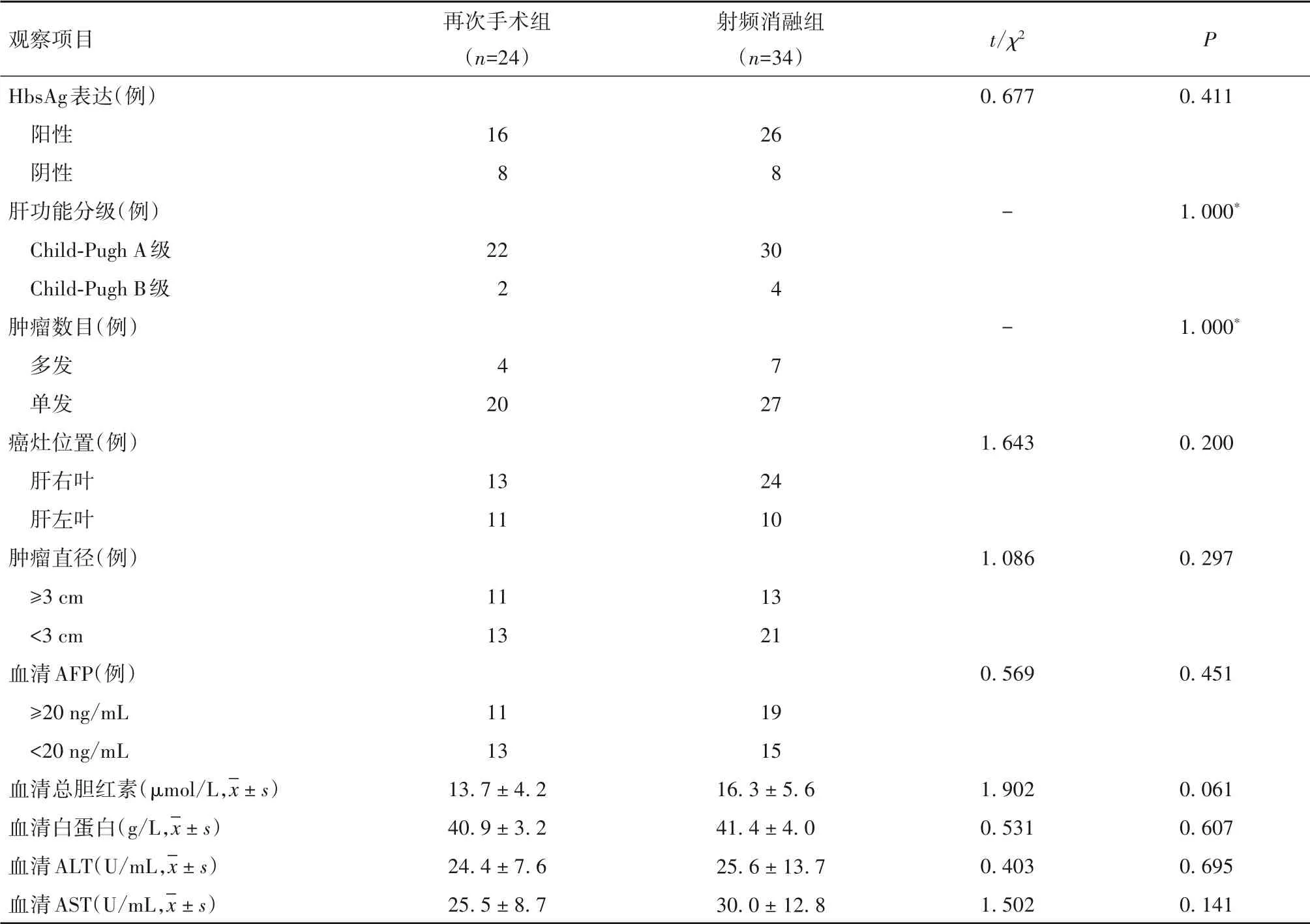
表1 两组肝功能、肿瘤特点及血清学指标比较
2.2 两组治疗情况 再次手术组24例均成功进行了手术,共切除29枚肿瘤;其中9例行腹腔镜肝癌切除术,15例行开腹肝癌切除术;行解剖性肝切除者3例,行局部肝癌病损切除患者21例;术中失血量50~500(156. 7 ± 93. 2)mL,患者术中均未输血;手术时间68~256(160. 0 ± 46. 7)min,术后住院4~13(8. 1 ± 2. 3)d。射频消融组34例共消融43 枚肿物;其中行腹腔镜联合超声肝癌射频消融者8例,行超声引导下经皮肝癌射频消融者26例;手术时间22~142(61. 3 ± 32. 0)min,术后住院3~9(4. 6 ± 1. 6)d。射频消融组治疗术后第1个月门诊复查行增强CT发现肿瘤区未被强回声完全覆盖者4例,肿瘤完全消融率为88. 2%(30/34)。4例未完全消融患者均再次住院行射频消融,术后1个月再次复查肝脏增强CT发现肝脏复发肿瘤均被完全消融,治疗成功率为100%(34/34)。与再次手术组比较,射频消融组手术时间和术后住院时间缩短(P均<0. 05)。
2.3 两组术后并发症 两组共10例患者出现术后并发症;再次手术组8例,并发症的发生率为33. 3%(8/24);射频消融组2例,术后并发症发生率为5. 9%(2/34);两组术后并发症发生率比较差异有统计学意义(P<0. 05)。再次手术组8例患者中,4例术后第3天复查腹部超声时诊断为腹腔积液,1例术后第3 天、1例术后第4 天发现皮肤巩膜黄染复查生化后判断出现了肝细胞性黄疸,1例术后第3天出现发热伴咳嗽复查CT提示肺部感染伴胸腔积液、少量腹水,1例术后第2次(术后第6 天)换药时发现切口化脓感染。射频消融组2例患者中,1例患者术后第4 天出现咳嗽伴发热行CT 检查提示右肺部感染伴胸腔积液,1例患者术后第2天复查腹部超声发现腹腔积液。两组患者术后并发症经抗炎、穿刺抽液、保肝、换药等对症支持治疗后均好转,顺利出院。
2.4 两组生存及复发情况 两组进行了10~58个月随访,截至随访结束,再次手术组14例肿瘤复发,其中早期复发8例,晚期复发6例,10例死亡;射频治疗组18例肿瘤复发,其中早期复发10例,晚期复发8例,15例死亡。术后1、3、5年累积生存率再次手术组分别为95. 8%、62. 9%、31. 4%,射频消融组分别为91. 2%、57. 1%、33. 9%。再次手术组、射频消融组中位生存期分别为35. 5、40. 4个月,无瘤中位生存期分别为27. 6、34. 1个月,术后1年无瘤生存率分别为87. 5%、88. 0%,术后3年无瘤生存率分别为35. 40%、54. 00%。两组以上生存及复发情况比较差异无统计学意义(P均>0. 05)。
3 讨论
原发性肝癌是我国第三大恶性肿瘤,其发病率逐年上升,切除术后的复发和转移是影响患者长期生存的主要因素。影响复发性肝癌患者预后和复发的潜在危险因素有很多,有患者年龄、性别、有无乙肝和肝硬化病史、肝硬化程度等本身的因素,也有手术方式选择、术中出血情况、围术期有无输血、肝切除的范围及手术切缘的情况等手术因素;肿瘤自身的因素如癌灶的数目、大小、包膜是否完整、脉管有无受侵犯和淋巴结有无转移癌等,甚至患者机体的自身免疫能力、手术者的经验都有可能影响患者的长期预后。CHEN等[14]的研究中纳入了肝切除术后复发时间超过24个月的286例肝癌患者,对27项可能影响患者长期预后的临床病理因素进行分析后发现,原发肿瘤、复发肿瘤为多发,肝外复发,复发肿瘤的大小,肝切除术后复发的时间小于1年和复发肿瘤非切除治疗是影响复发性肝癌患者长期预后的危险因素。
目前,根治性手段(二次手术、补救性肝移植、射频消融)和姑息性治疗(肝动脉栓塞化疗术、经皮穿刺乙醇注射术等)及其联合应用已广泛应用于治疗复发性肝癌,患者预后明显改善,生存期得以延长。补救性肝移植不仅可以彻底清除复发癌灶,而且消除了肝功能衰竭给患者造成的生命威胁,理论上是复发性肝癌理想的治疗方式,但供体的严重缺乏限制了补救性肝移植的临床推广和应用。1986年,NAGASUE 等首先尝试了对切除术后复发肝癌患者再次进行手术切除,取得了较好的效果,也证明了再次手术切除用于治疗复发性肝癌有效、可行。对于肝脏储备功能良好、切除后剩余肝体积充足、复发癌灶单一且较年轻的患者可首选再次手术切除。然而,我国原发性肝癌患者多合并乙肝、肝硬化病史,致使切除术后剩余肝脏体积小,储备、代偿能力下降,加之复发肿瘤多发、位置高危等,仅有少数的复发性肝癌患者有机会再次行手术切除。由于切除术后复发性肝癌行再次切除的限制条件众多,射频消融逐渐被广泛接受与应用。国内外已有很多研究把射频消融用于治疗早期肝癌(单个癌灶直径≤5 cm,或肿瘤数目≤3个且肿瘤直径均≤3 cm)[15-16],发现患者的预后与复发情况和手术相当,证明了射频消融可以作为早期肝癌的根治手段。PENG 等[17]研究甚至提示肿瘤直径≤3 cm 的早期肝癌应首选射频消融,对于肿瘤位于肝实质中央的老年患者,射频消融术有绝对优势。黄韬等[18]研究显示,射频消融术用于治疗原发性肝癌和复发性肝癌术后1、3、5年的总体生存率分别为85%、75%、61% 和93%、73%、61%;射频消融用于治疗原发性肝癌和术后复发肝癌可使患者获得相似的生存时间,用于治疗术后复发性原发性肝癌同样安全有效,可以延长患者的生存期。有研究者甚至提出,对于切除术后复发性小肝癌可优先考虑射频消融[19]。CHEN 等[13]回顾性分析对比了TACE 和射频消融分别用于早期复发性肝癌的疗效,发现对于巴塞罗那分期为A 期的肝癌患者两者总体生存率无明显差异,对于巴塞罗那分期为0 期的患者,射频消融的疗效优于肝动脉栓塞化疗术。目前,肝动脉栓塞化疗术多用于治疗无法行根治手术的晚期肝癌患者,并且常与其他治疗方法联合应用。有研究表明,肝动脉栓塞化疗术联合射频消融用于治疗中晚期肝癌患者,可以显著减少肿瘤复发,改善患者的预后[20]。肝动脉栓塞化疗术联合射频消融治疗复发性肝癌同样可以延长患者的生存期,其疗效要优于单纯行射频消融治疗[21]。许多研究提示,与射频消融相比,再次手术切除患者的无瘤生存期更长,说明二次手术切除的长期疗效优于射频消融[22-23]。但张代忠等[24]研究表明,射频消融用于治疗复发性肝癌患者的术后1年复发转移率为9. 1%,3年无瘤生存率为84. 8%,而再次手术切除组患者术后1年复发转移率却高达28. 0%,术后3年的无瘤生存率却降至56. 0%,认为射频消融用于术后复发性复发性肝癌远期疗效更好。目前,对于切除术后复发性肝癌的治疗方法很多,但具体哪一种方式更有效尚无定论。
本文回顾性分析58例肝癌根治切除术后复发的患者,比较再手术和射频消融治疗患者的临床疗效。结果显示,与再次手术组比较,射频消融组治疗时间和术后住院时间缩短,术后并发症发生率低,但两组患者有相似的预后及无瘤生存期。此结果与国内外多数学者的研究结果一致。因此我们认为,再次手术切除和射频消融用于治疗复发性肝癌均是安全有效的,可以结合复发肿瘤的情况及患者本身的意愿选择手术方式,但总体倾向于选择射频消融治疗。但本文为小样本单中心回顾性分析,研究结果难免存在局限;复发肝癌患者的再次治疗究竟选择何种治疗方式更佳,仍需前瞻性、大样本、多中心的研究进一步证实。
