结肠癌患者血清lncRNA ZFAS1 水平变化及临床意义
2021-10-20高杨康荣基曹宇
高杨,康荣基,曹宇
辽阳市中心医院普外科,辽宁辽阳 111000
结肠癌是高发病率和高病死率的消化道恶性肿瘤,随着生活方式和饮食习惯的改变以及肿瘤诊断技术的提高,我国结肠癌发病率呈上升趋势[1]。多数患者早期无典型症状,确诊时大都处于中晚期,术后易复发转移,预后差。长链非编码RNA(lncRNA)是一类长度超过200 nt,自主转录的非编码RNA,在表观遗传、调控转录及转录后基因表达中有重要作用,异常表达可能对细胞增殖、肿瘤进展或转移产生影响[2-3]。锌指蛋白反义链1(ZFAS1)是一种与肿瘤相关的lncRNA,在不同恶性肿瘤中发挥不同作用机制,在乳腺癌中表达下调,低表达可促使乳腺癌细胞增殖[4],但在食管鳞状细胞癌中表达上调,过表达可促进癌细胞增殖、迁移和侵袭[5]。lncRNA ZFAS1 在结肠癌中的报道较少,因此本研究观察了结肠癌患者血清lncRNA ZFAS1 水平变化,初步探讨其临床意义,现将结果报告如下。
1 资料与方法
1.1 临床资料 选择2015年2月—2017年7月我院收治的102例结肠癌患者(结肠癌组)。其中男63例,女39例;年龄45~79(62. 41 ± 6. 21)岁(<60 岁44例、≥60岁58例);病理类型:腺癌72例,腺鳞癌21例,其他9例;肿瘤直径:>5 cm 59例,≤5 cm 43例;分化程度:低分化47例,中分化37例,高分化18例;T分期:T1~T2期41例,T3~T4期61例;N 分期:N0期79例,N1~N2期23例。纳入标准:①入院后均行以手术为主的综合治疗,术后组织病理学证实为结肠癌;②采集血标本前未进行手术、放化疗以及中医药等抗肿瘤治疗;③病理资料完整,同意并配合随访。排除标准:①合并其他部位恶性肿瘤;②发生远处转移丧失手术治疗时机,未获得大体病理组织标本,病理资料缺失;③合并心血管疾病。另选择同期于我院门诊体检的54例健康志愿者为对照组,均经系统检查(肿瘤标志物、影像学检查等)排除恶性肿瘤。其中男37例、女17例,年龄60~80(67. 25 ± 6. 25)岁。两组年龄、性别比较差异无统计学意义。本研究已经获得我院伦理委员会批准,所有受试者签署知情同意书。
1.2 血清lncRNA ZFAS1 检测 结肠癌组入院后第2天(手术前)清晨(对照组体检当日)采集外周静脉血3 mL 注入干燥试管,待血液凝固后取上清液,离心(3 000 r/min,离心半径10 cm,离心时间5 min)后取血清上机检测,当日未检测样本-20 ℃保存,48 h内检测完毕。采用实时荧光定量PCR技术检测血清lncRNA ZFAS1。 取血清样本100 μL,加入TRIzol RNA提取试剂(美国Thermo Fisher公司)参照说明书分步提取组织RNA。通过琼脂糖凝胶电泳鉴定,选取OD260/OD280为1. 9~2. 1的RNA,M-MLV 逆转录酶(Epicentre 公司)将RNA 逆转录为cDNA。取2 μL cDNA样品加入实时荧光定量PCR体系,引物合成及序列测定由上海基康公司完成。lncRNA ZFAS1 上游引物序列:5'⁃ACGTGCAGACATCTACAACCT⁃3',下游引物序列:5'⁃TACTTCCAACACCCGCAT⁃3';βactin 上游引物序列:5'⁃TGCGTGACATTAAGGAGAA⁃3',下游引物序列:5'⁃AAGGAAGGCTGGAAGAGT⁃3'。反应条件:95 ℃预变性10 min,95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸10 s 共40个循环。反应体系:SYBR®Premix Ex Taq ™Ⅱ(2×)12. 5 μL,dNTP 1. 6 μL,Taq DNA 聚合酶1 μL,10 μmol/L 上下游引物各1 μL,加反应缓冲液至25 μL。75 ℃读取荧光,构建熔解曲线。以β-actin 为内参,采用2-ΔΔCt法计算lncRNA ZFAS1 相对表达量,共做3次平行试验,取平均值。
1.3 随访 采用门诊复查或电话随访形式进行随访3年,统计随访期间无进展生存(PFS)和总生存(OS)情况。PFS定义为自病理确诊日期至肿瘤复发转移、任何原因引起的死亡或随访结束时间,OS 定义为自病理确诊日期到因任何原因引起的死亡或随访结束时间。
1.4 统计学方法 采用SPSS25. 0 统计软件。采用Kolmogorov-Smirnov 法对计量资料进行拟合优度检验,符合正态分布以±s表示,多组间比较采用单因素方差分析(两两比较采用LSD-t检验),两组比较采用独立样本t检验;Kaplan-Meier 法绘制血清不同lncRNA ZFAS1 水平结肠癌患者生存曲线,Log-Rank 检验生存率的差异;Cox 比例风险模型分析影响结肠癌患者预后的危险因素。P<0. 05 为差异有统计学意义。
2 结果
2.1 两组血清lncRNA ZFAS1 水平比较 结肠癌组、对照组血清lncRNA ZFAS1 水平分别为3. 41 ±0. 81、1. 05 ± 0. 27,结肠癌组高于对照组(t=20. 780,P<0. 01)。
2.2 不同临床病理特征结肠癌患者血清lncRNA ZFAS1水平比较 见表1。
表1 不同临床病理特征结肠癌患者血清lncRNA ZFAS1水平比较(± s)
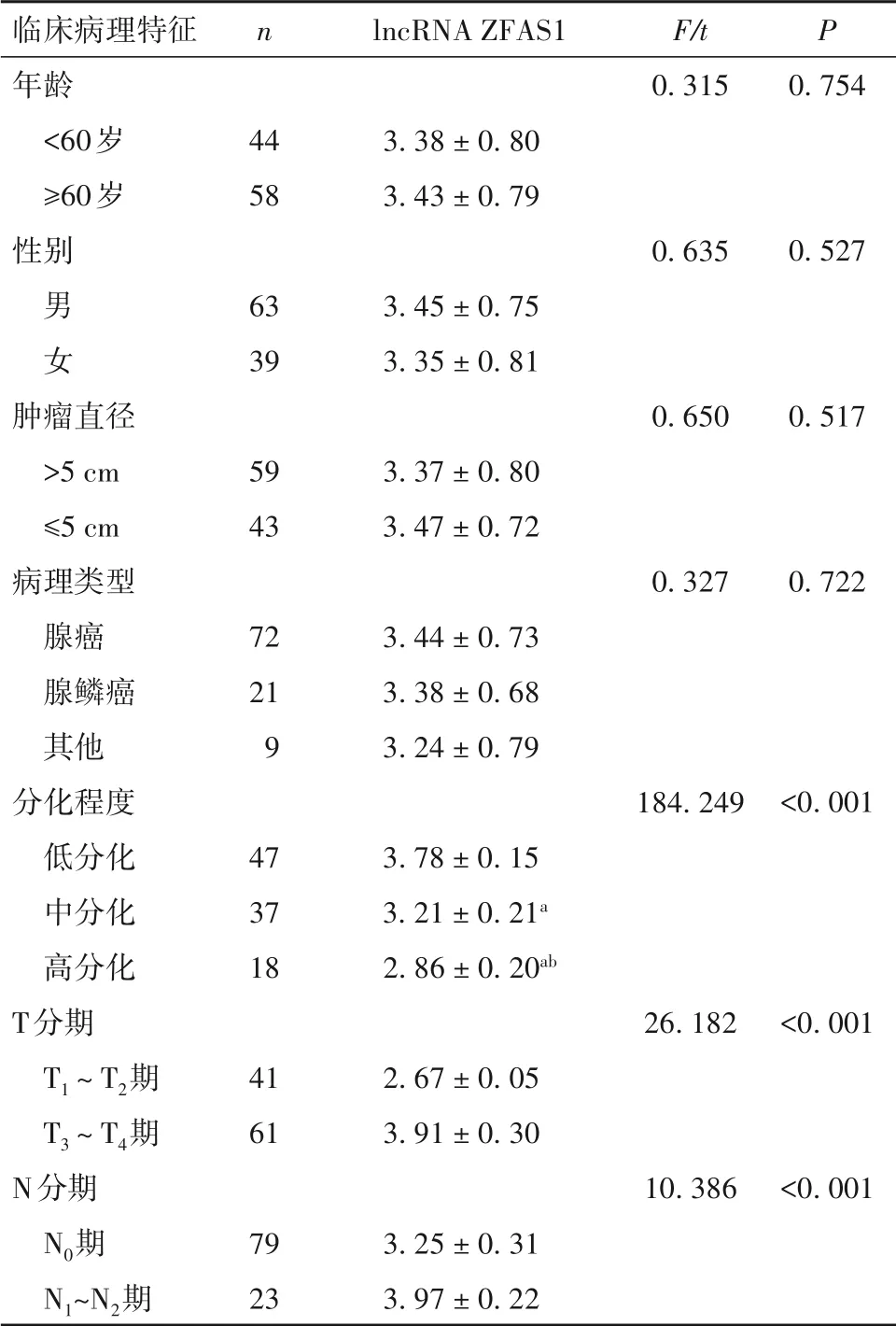
表1 不同临床病理特征结肠癌患者血清lncRNA ZFAS1水平比较(± s)
注:与低分化比较,aP<0. 05;与中分化比较,bP<0. 05。
临床病理特征年龄<60岁≥60岁性别男 女肿瘤直径>5 cm≤5 cm病理类型腺癌腺鳞癌其他分化程度低分化中分化高分化T分期T1~T2期T3~T4期N分期N0期N1~N2期n 44 58 63 39 59 43 72 21 9 47 37 18 41 61 79 23 lncRNA ZFAS1 3. 38 ± 0. 80 3. 43 ± 0. 79 3. 45 ± 0. 75 3. 35 ± 0. 81 3. 37 ± 0. 80 3. 47 ± 0. 72 3. 44 ± 0. 73 3. 38 ± 0. 68 3. 24 ± 0. 79 3. 78 ± 0. 15 3. 21 ± 0. 21a 2. 86 ± 0. 20ab 2. 67 ± 0. 05 3. 91 ± 0. 30 3. 25 ± 0. 31 3. 97 ± 0. 22 F/t 0. 315 0. 635 0. 650 0. 327 184. 249 26. 182 10. 386 P 0. 754 0. 527 0. 517 0. 722<0. 001<0. 001<0. 001
2.3 不同lncRNA ZFAS1 水平结肠癌患者生存比较 随访期间死亡33例,复发15例,远处转移10例,绘制Kaplan-Meier 生存曲线分析发现,lncRNA ZFAS1 高水平者(lncRNA ZFAS1≥3. 41,53例)3年PFS 率为32. 08%(17/53),3年OS 率为56. 60%(30/53),低于lncRNA ZFAS1 低水平者(lncRNA ZFAS1<3. 41,49例)的55. 10%(27/49)、79. 59%(39/49)(Log-Rankχ2=5. 489、6. 043,P=0. 019、0. 014)。
2.4 结肠癌患者生存的影响因素分析结果 以结肠癌患者生存情况为因变量(存活=0,死亡=1),纳入年龄(赋值:<60 岁=0,≥60 岁=1)、性别(赋值:男=0,女=1)、肿瘤直径(赋值:≤5 cm=0,>5 cm=1)、病理类型(赋值:腺癌=1、腺鳞癌及其他=0)、分化程度(赋值:高分化=0,低中分化=1)、T分期(赋值:T1~T2期=0,T3~T4期=1)、N 分期(赋值:N0=0,N1~N2=1)、lncRNA ZFAS1(赋值:低水平lncRNA ZFAS1=0,高水平lncRNA ZFAS1=1)为自变量。单因素Cox 比例风险回归分析(Enter 法筛选变量)结果显示分化程度、T 分期、N 分期、lncRNA ZFAS1 水平与结肠癌患者预后有关(P均<0. 01),见表2。将单因素分析中有统计学差异项目纳入多因素Cox 比例风险回归模型(Enter 法筛选变量),结果显示N1~N2期、高水平lncRNA ZFAS1 是结肠癌患者不良预后的危险因素(P均<0. 01),见表3。
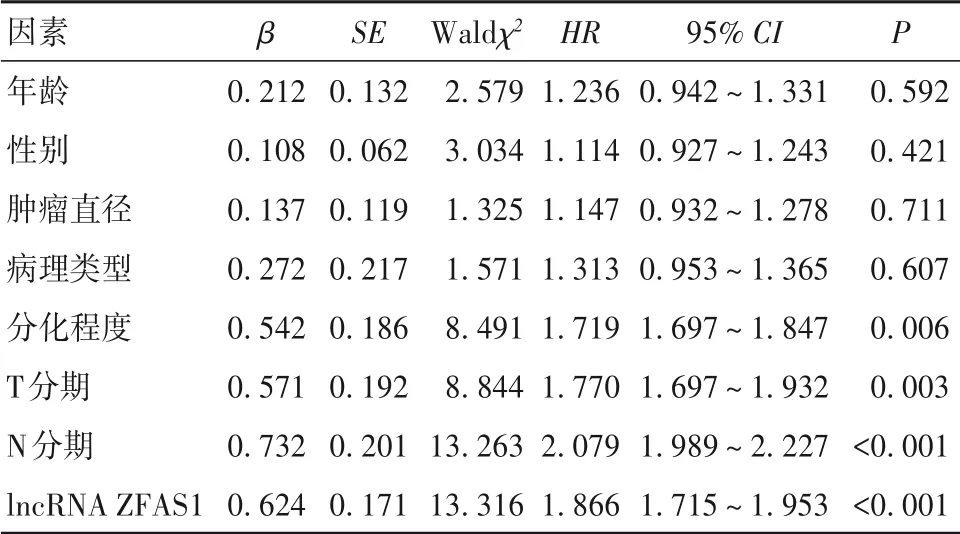
表2 影响结肠癌患者预后的单因素Cox比例风险回归分析结果
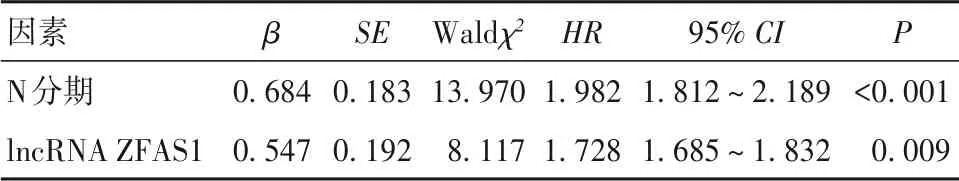
表3 影响结肠癌患者预后的多因素Cox比例风险回归分析结果
3 讨论
结肠癌是一种异质性肿瘤,具有高度侵袭性和转移性,是癌症相关死亡的主要原因,大约50% 中晚期结肠癌患者可发生远处转移,预后较差[6]。手术、放化疗是治疗结直肠癌的主要手段,近年来虽然诊断和治疗技术取得了很大进步,但是结肠癌患者远期生存率仍然较低。探讨与结肠癌相关的分子生物学标志物对临床诊断、指导治疗、预后评估均有重要意义。
lncRNA是具有高组织特异性的RNA,人类和哺乳动物多数基因组产物以lncRNA 形式存在。既往研究认为lncRNA无蛋白质编码功能,缺乏或无开放阅读编码框生物学功能,现在越来越多研究发现lncRNA 具有染色质和基因组结构重塑、组蛋白修饰、细胞周期调控、基因组印迹、转录后调节基因表达等多种生物学功能[7]。lncRNA 作为增强剂、支架或诱饵通过与其他RNA 或蛋白质相互作用,影响细胞信号级联,调节绝大多数生理病理过程,lncRNA表达异常影响蛋白或核酸功能以及稳定性,参与多种疾病包括恶性肿瘤的发生和发展,在肿瘤增殖、存活、迁移、耐药、基因组稳定性等方面发挥重要作用[8]。现有研究发现,多种lncRNA 调控失调通过信号途径参与了结肠癌的发病进展[9-10]。ZFAS1 是一种新发现的lncRNA,定位于人类染色体20q13,广泛表达于脑、肾、胰腺、心脏等组织的细胞核和细胞质中,具有翻译、mRNA 剪接和修复、细胞间黏附作用,参与细胞增殖凋亡,上皮—间质转化和细胞迁移过程,与多种恶性肿瘤发病有关[11]。lncRNA ZFAS1在正常乳腺组织中高表达,在乳腺癌组织中表达下调,ZFAS1过表达通过抑制上皮—间质转化抑制乳腺癌细胞迁移和侵袭[12],提示ZFAS1 可能是乳腺癌的肿瘤抑制因子。lncRNA ZFAS1 在头颈部鳞状细胞癌表达上调,可抑制miR-150-5p 表达,促使上皮—间质转化和癌细胞转移[13]。在胃癌中,ZFAS1 通过影响Wnt/β-链蛋白信号传导和表观遗传抑制Wnt 信号传导途径2(NKD2)的Kruppel 样因子2(KLF2)和NKD抑制剂促使癌症进展[14]。
本研究发现,结肠癌患者血清lncRNA ZFAS1水平增高,与结肠癌分化程度、T分期、N分期有关,说明lncRNA ZFAS1在结肠癌中发挥癌基因作用[15]。本研究通过随访和预后分析发现,高水平lncRNA ZFAS1与结肠癌患者低PFS 率和低OS率有关,是结肠癌患者预后不良的危险因素,说明lncRNA ZFAS1可以作为结肠癌预后判断的指标。分析lncRNA ZFAS1 参与结肠癌病情进展的机制如下:①肿瘤生长和增殖过程中需要新生血管的形成,lncRNA ZFAS1 可与miR-150-5p竞争性结合上调血管内皮生长因子A(VEGFA)表达[16],促进新生血管形成和结直肠癌进展。②lncRNA ZFAS1通过靶向miR-590-3p调控细胞周期蛋白依赖性激酶1(CDK1),抑制癌细胞凋亡,促使癌细胞增殖[17]。③lncRNA ZFASI是C/D盒SNOR⁃NAs的宿主和载体,SNORDs通过引导核糖体RNA位点特异性的甲基化参与恶性肿瘤发生和进展,ln⁃cRNA ZFAS1 通过识别SNORDs NOP58 蛋白,加速SNORD12C/78 合成,促使核糖体RNA 的2'-O-甲基化,促使 结肠癌癌细 胞增殖迁 移[18]。 ④lncRNA ZFAS1 还可通过携带特定基序(AAGA 或CAGA)直接募集DDX21蛋白,调控其下游基因POLR1B表达,促使癌细胞增殖、侵袭、迁移[19]。
综上可见,结肠癌患者血清lncRNA ZFAS1 水平升高,lncRNA ZFAS1 水平与结肠癌分化程度、T分期和N分期有关,高水平lncRNA ZFAS1是结肠癌预后不良的危险因素。lncRNA ZFAS1 有望作为结肠癌预后预测的潜在标志物。
