胎盘MSCs移植改善重症急性胰腺炎大鼠肠屏障功能研究
2021-10-20吴东叶黄启林王明义
苟 英,吴东叶,黄启林,王明义*
(1.西部战区总医院妇产科,成都 610083;2.西部战区总医院普外科,成都 610083)
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种以胰腺局部炎性损伤和全身炎症反应为特征的疾病,其病情重、并发症多、病死率高[1]。SAP发病早期常伴有肠屏障功能障碍,导致肠道内细菌和有毒物质进入血循环引起肠源性感染,加重患者病情。间充质干细胞(mesenchymal stem cells,MSCs)因具有显著的抗炎与免疫调节能力,已被广泛应用于炎症性疾病的治疗与研究。本研究主要探讨外源性P-MSCs移植能否改善SAP大鼠肠屏障功能。
1 材料与方法
1.1 实验动物及主要试剂
健康成年雄性SPF级SD大鼠,体质量200~220 g,购自成都达硕实验动物有限公司。间充质干细胞无血清培养基购自友康恒业生物科技(北京)有限公司。牛磺胆酸钠购自美国Sigma公司。CMDil细胞染料购自美国赛默飞公司。KGF、D-乳酸、内毒素、IL-1β、TNF-α与CRP检测试剂盒均购自上海江莱生物科技有限公司。CCK-8试剂盒购自东仁化学科技(上海)有限公司。兔抗大鼠ZO-1与Occludin抗体购自英国Abcam公司。
1.2 胎盘间充质干细胞培养
胎盘间充质干细胞来自我院普外科汤礼军教授课题组馈赠,采用间充质干细胞无血清培养基培养,具体培养方法详见HUANG等[2]研究。
1.3 模型制备及分组
24只SD大鼠,术前禁食12 h,自由饮水,采用随机数字表法分为SHAM组、SAP组与SAP+P-MSCs组,各8只。SHAM组:大鼠经异氟烷吸入麻醉后,开腹翻动胰腺数次然后关闭腹腔,术后6 h经尾静脉注射1 mL PBS缓冲液。SAP组:大鼠麻醉后开腹,经胰胆管采用微量输液泵输注4%牛磺胆酸钠(0.1 mL·100 g-1),术后6 h经尾静脉注射1mL PBS缓冲液。SAP+P-MSCs组:SAP建模术后6 h,经尾静脉注射P-MSCs(1×106个·100 g-1)。所有大鼠术后禁食不禁水,于P-MSCs输注24 h后麻醉开腹,经腹主动脉采血,然后离心(3 500 rpm,5 min),收集血清保存于-80℃备用。无菌条件下采集大鼠胰腺与肠系膜淋巴结组织,置于4℃ 1×PBS缓冲液中用于后续细菌培养。剪取末端回肠组织,2份置于冻存管中保存于-80℃备用,1份置于4%多聚甲醛中固定,1份置于电镜固定液用于后续电镜检测。
1.4 P-MSCs体内示踪
采用CM-Dil细胞染料标记P-MSCs,并观察CM-Dil对P-MSCs增殖的影响。10只雄性健康SD大鼠,体质量(200±10)g,采用随机数字表法分为SHAM+P-MSCs组与SAP+P-MSCs组(每组5只),于术后6 h经尾静脉输注CM-Dil标记的P-MSCs(1×106个·100 g-1)。P-MSCs移植24 h后进行取材,大鼠麻醉后处死,采集末端回肠组织,置于4%多聚甲醛中固定。对肠道组织进行冰冻切片,DAPI复染核后置于荧光显微镜下观察并拍照。
1.5 CCK-8实验测定细胞增殖活性
采用CCK-8实验检测CM-Dil对P-MSCs增殖的影响,具体实验步骤参照试剂盒说明书,最后测定其在450 nm处的OD值。
1.6 肠道组织病理学检测
首先,采用HE染色观察肠道病理改变。固定后的肠道组织,经脱水、石蜡包埋、切片、脱蜡、HE染色后,置于显微镜下观察其病理改变。透射电镜检测,首先将肠道组织修剪成0.5~1.0 mm2大小,然后置于3%戊二醛预固定,经丙酮脱水后,再依次进行渗透、包埋与超薄切片,最后用醋酸铀染色,再用柠檬酸铅染色,采用H-600IV型透射电镜进行观察。
1.7 酶联免疫吸附测定
采用ELISA法测定大鼠血清中D-乳酸、内毒素、IL-1β、TNF-α与CRP浓度,操作按试剂盒说明书步骤进行。肠道组织中TNF-α、IL-1β与KGF的测定,首先取-80℃冻存的肠道组织,称取相同质量,然后超声波匀浆后离心收集上清,并采用全蛋白提取试剂盒提取总蛋白,采用ELISA法进行测定。
1.8 细菌移位的检测
无菌条件下采集大鼠肠系膜淋巴结与胰腺组织各50 mg,加入1 mL无菌生理盐水,在无菌玻璃匀浆管中匀浆,再将匀浆液稀释100倍。分别取10 μL稀释液均匀涂布接种于血琼脂培养皿与麦康凯培养皿上,置于37 ℃培养箱内培养48 h。培养结束后计数细菌菌落数,计算每克组织培养出的细菌菌落形成单位数(clonal formation unit,CFU),即CFU·g-1=平板菌落数×稀释倍数/组织质量(g)。
1.9 肠道组织ZO-1与Occludin蛋白表达水平测定
采用Western-blot法检测肠道组织中ZO-1与Occludin蛋白表达水平。剪取适量等质量的肠道组织,磨碎后提取总蛋白。进行常规的电泳、转膜、封闭后,分别与抗ZO-1与Occludin抗体(1:500)4℃孵育过夜。用TBST洗涤后,加入二抗(1:2 000)孵育30 min,采用化学发光法进行检测。
1.10 统计学方法
采用SPSS 22.0进行分析。计量资料以均数±标准差(±s)表示,若方差齐则采用单因素的方差分析,进一步两两比较采用LSD-t检验;若方差不齐,则多组间比较采用非参数检验Kruskal-WallisH法,进一步两两比较采用Mann-WhitneyU检验。检验水准α=0.05。
2 实验结果
2.1 P-MSCs减轻SAP大鼠肠道损伤
肠道HE染色结果显示,SHAM组结构完整,未见明显异常;SAP组可见固有层崩解,绒毛缺损,间质内有大量炎性细胞浸润及明显组织水肿;而SAP+P-MSCs组相较SAP组肠道损伤得到明显改善(图1)。肠道透射电镜结果显示:SHAM组肠道上皮细胞微绒毛排列整齐,上皮细胞结构完整,线粒体、粗面内质网、核糖体等细胞器结构清晰,细胞间紧密连接清晰;SAP组肠上皮细胞微绒毛排列稀疏,线粒体肿胀明显,紧密连接显著破坏;SAP+P-MSCs组肠上皮细胞微绒毛排列相对整齐,线粒体轻微肿胀,紧密连接相对完整(图2)。肠道HE染色与透射电镜结果,表明外源性P-MSCs移植可减轻SAP大鼠肠道损伤。
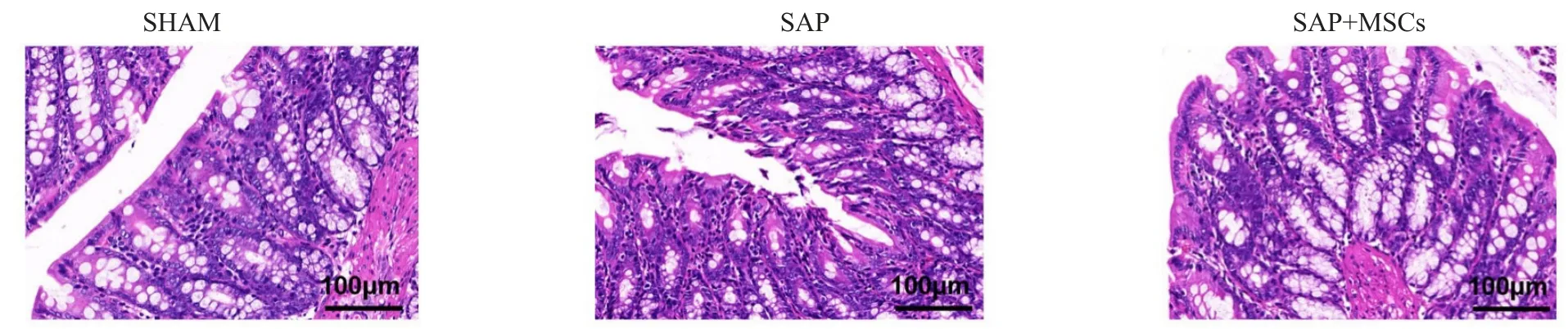
图1 肠道组织HE染色(×200)
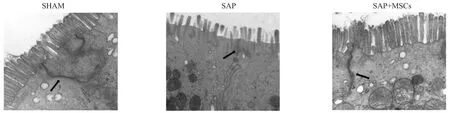
图2 肠道组织透射电镜下病理改变(箭头指示为紧密连接,×25 000)
2.2 P-MSCs向损伤部位定植
将CM-Dil细胞染料标记的P-MSCs置于细胞培养箱中培养,发现CM-Dil对P-MSCs的增殖及形态无明显影响(图3A,B)。通过CCK-8实验再次证实CM-Dil对P-MSCs的增殖无明显影响(图3C)。将CM-Dil标记的P-MSCs通过尾静脉输注到SAP大鼠体内,最后在荧光显微镜下观察P-MSCs在肠道的定植情况。如图4所示,相比SHAM+PMSCs组,SAP+P-MSCs组肠道组织中有更多的P-MSCs定植。以上结果表明,采用CM-Dil标记P-MSCs安全有效,并且P-MSCs倾向于在损伤肠道组织中募集。
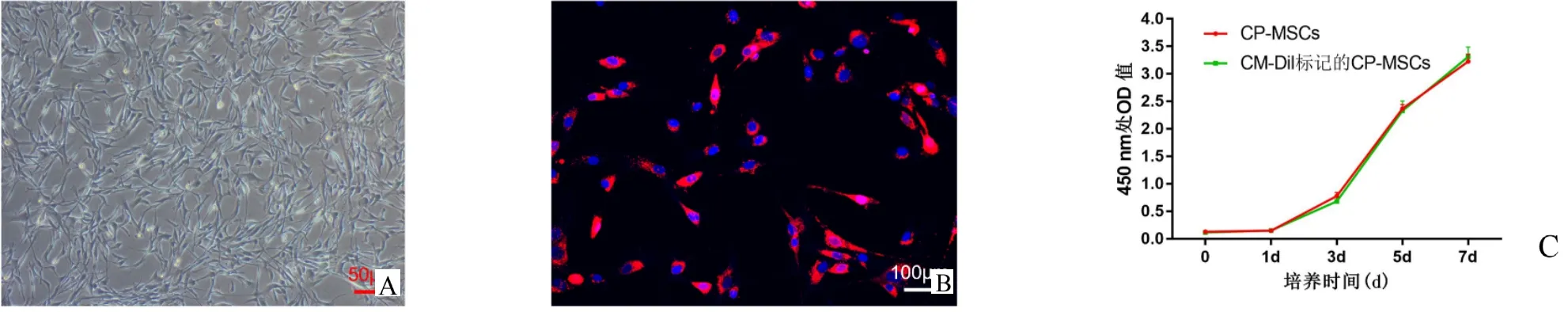
图3 P-MSCs倾向于在损伤肠道组织中定植
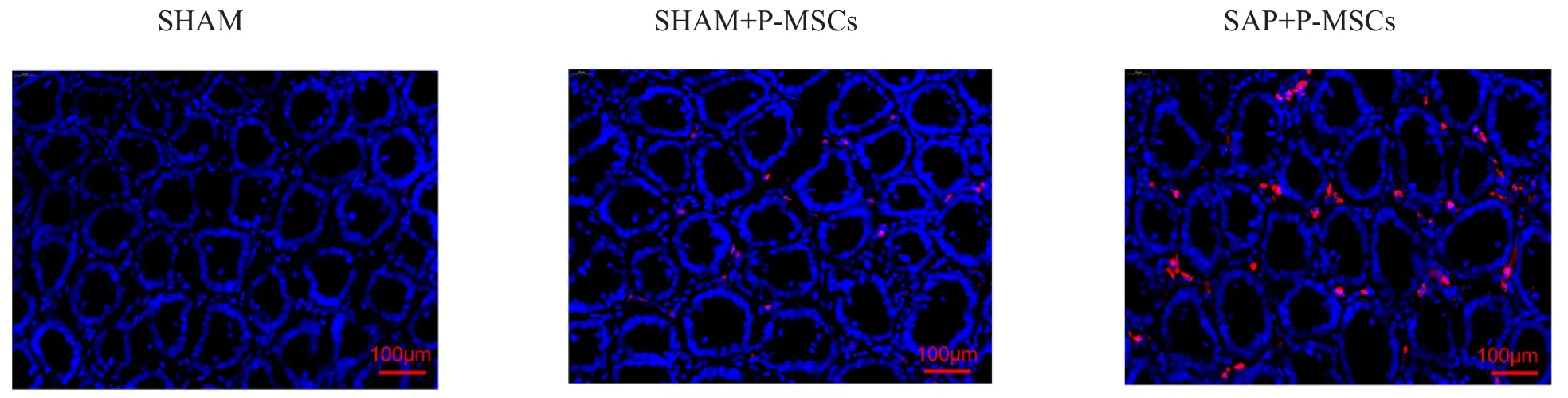
图4 CM-Dil标记的P-MSCs在肠道中的定植情况(×200)
2.3 P-MSCs减轻SAP大鼠全身炎症反应
ELISA检测结果表明:相比SHAM组,SAP组大鼠血清中IL-1β、TNF-α与CRP浓度显著增加(P<0.001);相比SAP组,SAP+P-MSCs组大鼠血清中IL-1β、TNF-α与CRP浓度显著降低,差异有统计学意义(P<0.001)(图5)。说明外源性P-MSCs移植可减轻SAP大鼠全身炎症反应。
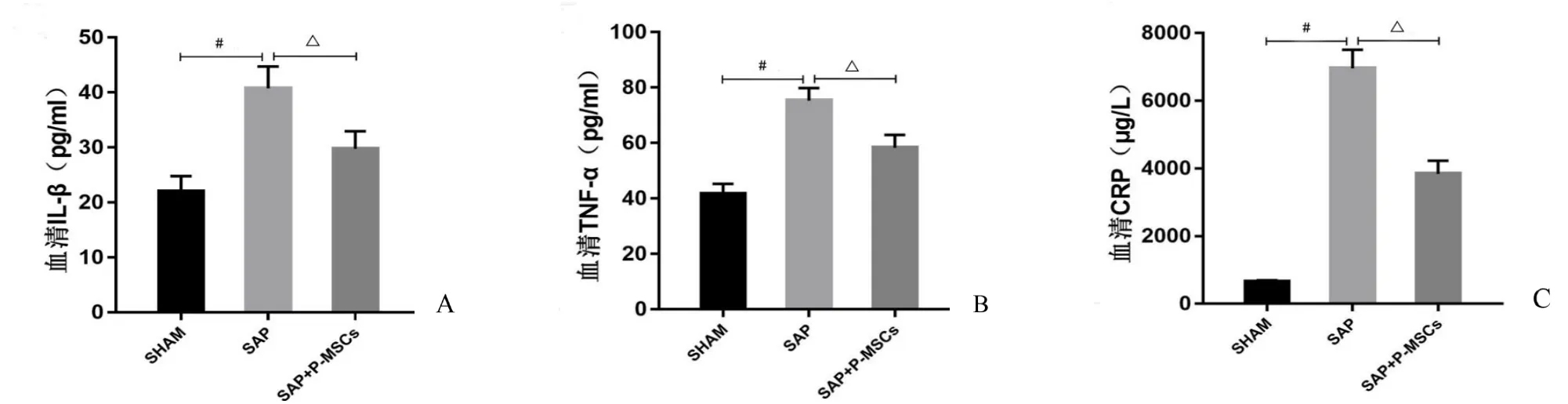
图5 P-MSCs减轻SAP大鼠全身炎症反应程度
2.4 P-MSCs减轻SAP大鼠肠道炎症反应
如图6A,B所示,相比SHAM组,SAP组肠道组织中促炎因子TNF-α与IL-1β水平显著升高(P<0.001);给予P-MSCs治疗后,SAP大鼠肠道组织中TNF-α与IL-1β水平显著降低(P<0.001)。说明P-MSCs移植可减轻SAP大鼠肠道炎症反应。此外还发现,SAP组肠道组织中KGF含量较SHAM组显著升高(P<0.01);相比SAP组,SAP+PMSCs组肠道组织中KGF含量进一步升高(P<0.01,图6C)。
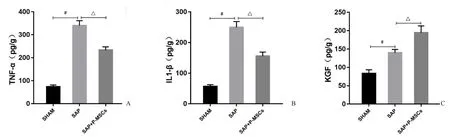
图6 P-MSCs减轻SAP大鼠肠道炎症反应
2.5 P-MSCs改善SAP大鼠肠屏障功能
本研究发现,SAP组血清D-乳酸与内毒素浓度显著高于SHAM组(P<0.001);给予P-MSCs治疗后,血清D-乳酸与内毒素浓度均明显降低(P<0.001,图7A,B)。通过对不同组进行细菌菌落计数,并对结果进行对数转化分析后发现,相比SHAM组,SAP组胰腺与肠系膜淋巴结组织培养获得的细菌菌落数显著增加(P<0.001);给予P-MSCs治疗后,胰腺与肠系膜淋巴结组组织培养获得的细菌菌落数显著减少(P<0.05,图7C)。肠道组织中ZO-1和Occludin的Western-blot检测结果表明:相比SHAM组,SAP组ZO-1与Occludin的表达量显著下降(P<0.001);而给予P-MSCs治疗后可增加ZO-1与Occludin的表达,与SAP组比较差异有统计学意义(P<0.05,图7D,E)。综上所述,P-MSCs可改善SAP大鼠肠屏障功能。
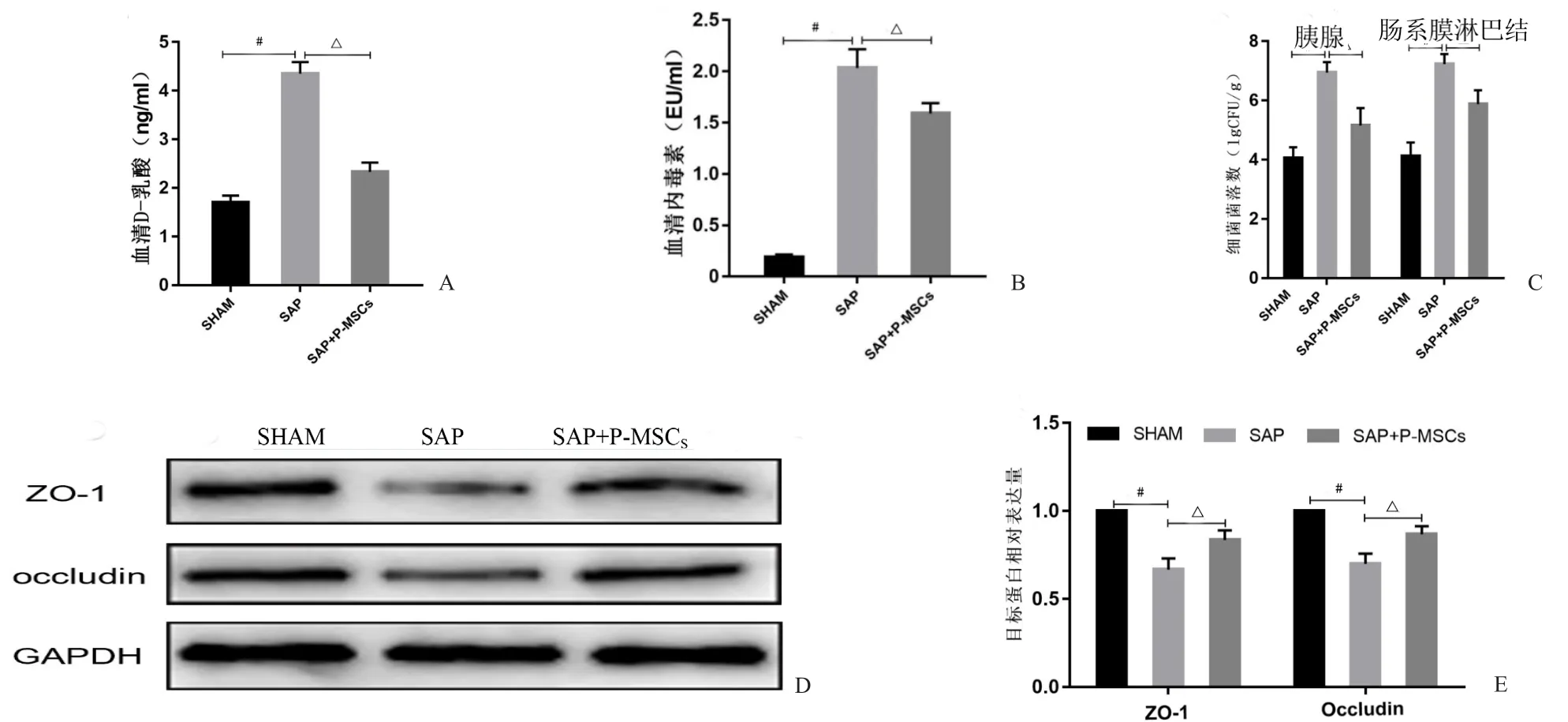
图7 P-MSCs可改善SAP大鼠肠黏膜屏障功能
3 讨论
MSCs因其具有显著的抗炎与免疫调节作用,被广泛用于炎症性疾病的治疗与研究。已有研究表明,外源性MSCs移植可减轻SAP相关性肠损伤。2012年,TU等[3]发现同种异体BM-MSCs移植可减轻SAP大鼠小肠上皮炎症与损伤,促进肠上皮细胞增殖与黏膜修复,改善肠屏障功能。
P-MSCs是从胎儿胎盘组织中分离培养获得,胎儿分娩后胎盘组织常被当作医疗废弃物抛弃,因此从胎盘组织中分离培养P-MSCs具有无创性。此外,相比BM-MSCs,P-MSCs不但具有组织来源丰富、组织中MSCs含量丰富、伦理限制少等优点,而且还具有更强的增殖与免疫调节能力[4-5]。研究[6]发现,相比UC-MSCs,P-MSCs具有更强的增殖与免疫调节能力。
SAP早期是一种无菌性炎症反应,炎症反应相对较轻,而后期出现的严重全身炎症反应及高死亡率被认为与肠道通透性改变导致肠道细菌移位以及肠道有毒物质进入血液循环有关[7]。因此,改善SAP患者肠屏障功能对于缓解病情、减少并发症、降低病死率等均具有重要作用。本研究发现外源性P-MSCs移植可减轻SAP大鼠全身炎症反应与肠道损伤,改善肠屏障功能。
大量研究证实,MSCs具有向组织损伤部位迁移与定植的特性。MSCs在组织损伤部位定植对充分发挥其治疗作用至关重要。JIANG等[8]研究发现,在缺血-再灌注肠道损伤大鼠模型中,外源性BMMSCs也倾向于在损伤肠道组织中定植。本研究发现相比SHAM+P-MSCs组,SAP+P-MSCs组肠道组织中有更多P-MSCs定植,说明在SAP大鼠体内,外源性移植的P-MSCs有向损伤肠道募集的趋势。
D-乳酸与内毒素由肠道细菌产生,肠屏障功能正常时,其几乎不能进入血循环。当肠屏障功能受损时,大量D-乳酸与内毒素可进入血循环,因此其常作为肠屏障损伤的早期指标。此外,当肠屏障出现严重损伤时,肠道中细菌也可进入血循环,导致肠源性感染。肠上皮细胞间紧密连接对维持肠屏障功能完整性至关重要。研究[9]证实,ZO-1与Occludin蛋白在肠上皮细胞间紧密连接中扮演着重要角色。本研究给予外源性P-MSCs治疗后,SAP大鼠血清D-乳酸与内毒素浓度显著降低,并且胰腺与肠系膜淋巴结组织培养获得细菌菌落数也显著减少,此外肠道组织中ZO-1与Occludin蛋白表达也显著升高,说明P-MSCs可改善SAP大鼠肠屏障功能。
本研究观察到给予外源性P-MSCs治疗后,SAP大鼠血清与肠道组织中TNF-α与IL-1β浓度均显著降低。角化细胞生长因子(keratinocyte growth factor,KGF)可促进肠道黏膜上皮细胞增殖与分化,加速肠道损伤上皮细胞修复[10]。本研究发现P-MSCs治疗后,SAP大鼠肠道组织中KGF含量显著升高,说明P-MSCs可促进肠道上皮细胞再生。
综上所述,本研究初步表明外源性P-MSCs移植可减轻SAP大鼠肠道损伤,改善肠屏障功能,但P-MSCs改善肠屏障功能的具体机制尚不清楚,仍有待进一步深入探讨。
