胶体粒子与蛋白质相互作用及其应用
2021-10-19牛付阁张秋萍杜艺轩潘伟春
牛付阁,周 娱,张秋萍,喻 娇,杜艺轩,潘伟春
(浙江工商大学食品与生物工程学院 杭州310018)
食品的众多性质,如感官、质感乃至其在体内的消化吸收,都和其结构紧密相关[1-2]。该食品的结构的尺度从宏观开始,跨越介观,直到纳米尺度的微观。和其它测试结构的技术相比,机械流变存在以下优点:测量设备相对简单,试验条件可控度高,能原位测试,测量结果是系统的平均行为,对应的基础理论成熟,因此,机械流变是研究食品以及其它高分子体系相互作用及各种结构的重要手段[3]。然而,食品中存在一类结构,如蛋白簇[4],它非常脆弱,很容易被外力破坏,这限制了该技术在食品中的应用。考虑到该类结构在食品中广泛存在,如酸奶、溶液乳化过程等,因此催生一种新的流变学技术--微流变技术(Micro rheology)[5-7]。除了继承机械流变的优点外,该技术还有用量少,速度快,可重复性高,没有外加力对食品部分弱结构造成影响,测量频率范围广等优点[8-10]。
微流变技术是通过测量小颗粒(直径约1 μm)[11]在所测量体系中的布朗运动,通过广义Stokes-Einstein 关系式,来估算体系的流变学的相关参数。这些小颗粒被命名为示踪粒子,常见的示踪粒子既可以是体系本身所含的颗粒,也可以是高分子胶体粒子[12-14]。由于颗粒大小能显著影响微流变技术所得结果,结构清晰的高分子胶体颗粒受到了研究者的青睐。由于微流变测量中,颗粒的布朗运动为热量所驱动,示踪粒子在体系中运动时,除了受到周围环境纯流体力学的拖曳力外,应不存在其它相互作用影响粒子运动。示踪粒子的尺度应小于体系中网格(如存在的话)的尺寸,同时示踪粒子可以用硬球模型来表示,即示踪粒子和体系中其它成分不存在相互作用。
随着微流变技术的普及,一些食品科学工作者开始使用该技术。有些使用者在应用的过程中对上述的要求不清晰,特别是容易忽略胶体粒子的表面性质以及与蛋白质分子之间的相互作用,使获得的微流变信息与真实值具有一定差距。解决这一问题的关键是将体系中添加的粒子与蛋白之间的相互作用进行建模,选择一个合适、简单且有效的模型研究体系的微流变行为。
在研究过程中,溶液体系的黏度是影响测量结果的一个重要指标[15-16]。然而,研究者往往会忽略黏度的校正,造成测量结果偏离真实值。黏度法是检测蛋白分子构象及溶液性质的最基本的方法之一[17-18]。目前国内利用微观流变学研究蛋白溶液黏度的报道不多。本文将不同的蛋白质与不同的胶体粒子之间的相互作用作为切入点,利用动态光散射技术建立一种有效的微观测量溶液体系黏度的方法,为复杂食品体系的微流变研究提供理论依据,为食品加工过程中蛋白质的开发和利用提供新的思路。
1 材料与方法
1.1 试验材料
三羟甲基氨基甲烷(Tris),购于国药集团化学试剂有限公司;聚苯乙烯微球(A)与聚苯乙烯-羧基微球(B),购于苏州智微纳米科技有限公司;聚苯乙烯微球(C)、牛血清蛋白(BSA)(Lot #WXBC5159V)、溶菌酶(lys)(Lot # SLBJ4107V)、β-乳球蛋白(BLG)(Lot # SLBS6536)、卵白蛋白OVA(Lot # SLBQ9036V)等,均购于Sigma 公司。
1.2 样品制备
配制1 000 mL,20 mmol/L,pH=7.4 Tris-HCl缓冲液,放入4 ℃冰箱备用。准确称取0.4 g 的BSA、BLG、lysozyme 3 种蛋白质,用Tris-HCl 缓冲液分别溶解。使最终蛋白质量浓度为20 mg/mL。称取0.1 g OVA,用Tris-HCl 缓冲液溶解,使最终蛋白质量浓度为10 mg/mL。为了使蛋白原始溶液充分水化溶解,将配好的4 种蛋白溶液分别放置在磁力搅拌器中搅拌2 h,搅拌速度为150 r/min,之后将溶液放置于4 ℃冰箱保存24 h。将放置24 h 后的4 种蛋白原始溶液用Tris-HCl 稀释2~10倍5 个浓度梯度至10 mL,备用。
1.3 动态光散射(DLS)测定
动态光散射技术通过Stokes-Einstein 方程变形得到方程(1),通过测量体系中球形颗粒的平移扩散系数来计算颗粒粒径和液体黏度[19-22]。

式中:η——溶剂的黏度,mPa·s;κB——波尔茨曼常数,J/K;T——温度,K;R——水力学半径,nm;D——扩散系数,cm2/s。
分散的胶体粒子在液体中做无规则布朗运动时,在固定散射角θ 处观测到的散射光光强Ι(t)随时间涨落,相关时间的指数衰减函数如下:

方程(2)中:Ι(t)——散射光光强;τ——衰减时间,ms。衰减时间τ 与表征体系中粒子的集体布朗运动平移扩散系数D有如下关系:

式中:q——散射矢量,cm-1;n——样品折射率;λ0——光在真空中的波长,nm;θ——散射角,°。将(3)式带入(1)式得到最终黏度计算公式为:

式中:η——溶剂的黏度,mPa·s;κB——波尔茨曼常数,J/K;T——温度,K;τ——衰减时间,ms;R——水力学半径,nm。
分别取2.5 mL Tris-HCl 缓冲液,快速经过0.22 μm 的滤膜(水膜)过滤后,缓慢滴入3 个已经由丙酮淋洗干净的光散射专用测量瓶中,用移液枪取2 μL 3 种不同胶体粒子分别加入Tris-HCl缓冲液中,轻轻摇匀使胶体粒子充分分散在体系中避免气泡给试验带来干扰,等待测量。
取2.5 mL 稀释好的不同浓度梯度的蛋白溶液,快速经过0.22 μm 的亲水滤膜,放入已经由丙酮淋洗干净的光散射专用测量瓶中。重复3 次,在相同浓度蛋白溶液测试样品中,分别用移液枪精确滴入2 μL 3 种胶体粒子(A,B,C),轻轻摇晃光散射瓶子30 s,使胶体粒子充分分散在溶液中。所测量的每种蛋白有15 个样品,所有样品均操作相同,清楚标记每个样品名称。
本试验选择的测量波长为632.8 nm,测量角度为90°,测量温度为25 ℃,测量时间为30 s,每个样品重复测量10 次。
1.4 胶体粒子zata 电位测定
取3 个试管,分别加入3 mL Tris-HCl 缓冲液,用移液枪取2 μL 3 种不同胶体粒子分别加入到3 个试管溶液中摇晃,使胶体粒子充分分散到溶液中,取样加入到样品池中25 ℃等待测量。样品测试前在仪器中平衡60 s,设定蛋白模式程序,每组运行11 次,运行3 组,结果为多次测试的平均值。
1.5 均方旋转半径Rg 的测定
在25 ℃下,将动态光散射所制备的样品放入样品瓶,利用光散射仪对BSA,BLG,lys 3 种蛋白与3 种粒子做静态光散射分析。测试角度范围为30°~60°,2°为一个梯度,测试误差为5%,测试时间为30 s,测试中入射光强保持不变,待测样品平行测定3 次。
2 结果与讨论
2.1 蛋白质与胶体粒子动态光散射自相关函数分析
图1a 是A,B,C 3 种不同胶体粒子分散到Tris-HCl 缓冲液的自相关函数,它们尺寸不同,其中,胶体粒子B 表面接有羧基基团。可以看出这3种胶体粒子相关函数均沿弛豫时间轴快速移动到较短时间,说明这3 种胶体粒子本身均一性较好,粒径均呈单峰分布且较集中,没有发生聚集现象,可以排除胶体粒子本身对试验准确性造成的干扰。
可以从图1b 看出胶体粒子C 分散的溶液体系中自相关函数沿着弛豫时间并没有快速移动,且相关函数没有衰减到0,粒径呈多峰分布。说明在胶体粒子C 存在的体系中,lys 与胶体粒子C 发生强相互作用,发生较为严重的聚集现象且有大颗粒产生。所以,使用胶体粒子C 测蛋白黏度所得到的黏度值与真实值有偏差。从图1c、1d 可以看出BSA 和BLG 体系的自相关函数沿着弛豫时间均快速移动到较短时间,并且相关函数都能衰减到0,粒径分布峰宽较窄且集中。说明BLG 和BSA与3 种胶体粒子之间均没有发生强相互作用产生大颗粒。而且整体来看,蛋白浓度的改变对粒子间相互作用影响不大。

图1 蛋白质在3 种胶体粒子体系中的弛豫时间分布图Fig.1 Dynamic light scattering attenuation curve of proteins in three colloidal particle systems
2.2 胶体粒子Zeta 电位值测定分析
由于胶体粒子C 与lys 混合体系存在大颗粒,为了进一步探究胶体粒子与蛋白之间的相互作用,本试验测定了3 种胶体粒子单一分散体系的Zeta 电位值。从图2 中可以看出,A,B,C 3 种胶体粒子均带负电,并且A 与B 所带负电荷明显少于C,而蛋白溶液所处环境pH 值为7.4,在此条件下,BSA(pI=4.7),BLG(pI=5.2),OVA(pI=4.7),3种蛋白表面均带大量负电荷,因此与胶体粒子之间没有较强的静电荷相互吸引作用。而lys 的等电点pI=11.35 高于7.4,蛋白表面会带较多正电荷,因而会与胶体粒子C 发生较强的静电相互吸引作用,甚至产生聚集现象。这也解释了1 中的试验现象。因此在后续lys 体系黏度测量时,我们选择了A 与B 两种胶体粒子。
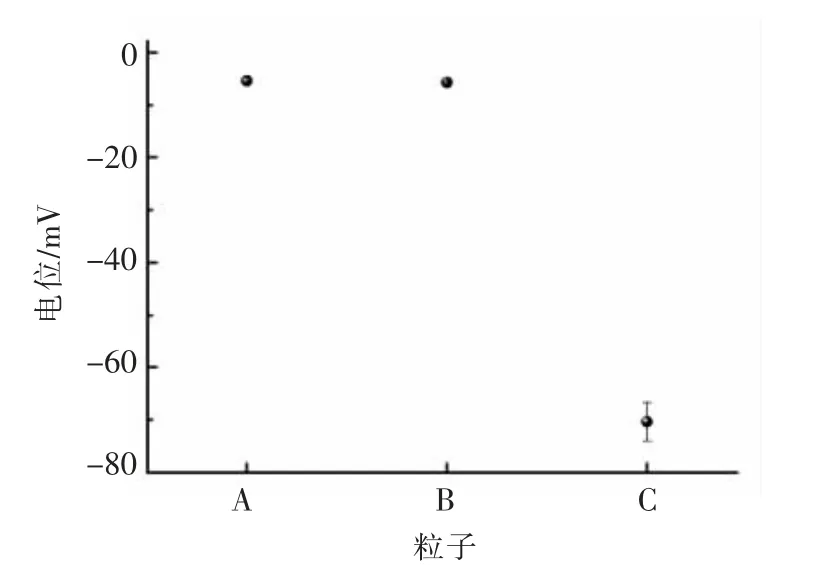
图2 3 种胶体粒子A,B,C Zeta-电位值Fig.2 The Zeta-potential values of colloidal particles(A,B,C)
2.3 胶体粒子Rg 测定分析
为了进一步说明液体分散体系中蛋白与胶体粒子之间是否存在强相互作用,确保动态光散射测量蛋白黏度的可靠性,我们利用静态光散射测量了旋转半径Rg[23-25]。通过监测Rg 随蛋白浓度梯度的变化,进一步证实所测结果的变化是由粒子间相互作用减弱所致还是由颗粒本身的几何形状变化所致。
通过图3 可以看出,胶体粒子分散在缓冲液中测得的Rg 和分散到蛋白溶液中测得的Rg 相比没有显著性差异。只有在BLG 与胶体粒子B 的体系中,Rg 随蛋白浓度改变出现轻微变化。从整体来看,蛋白浓度这一因素对粒子之间的相互作用没有较大影响。
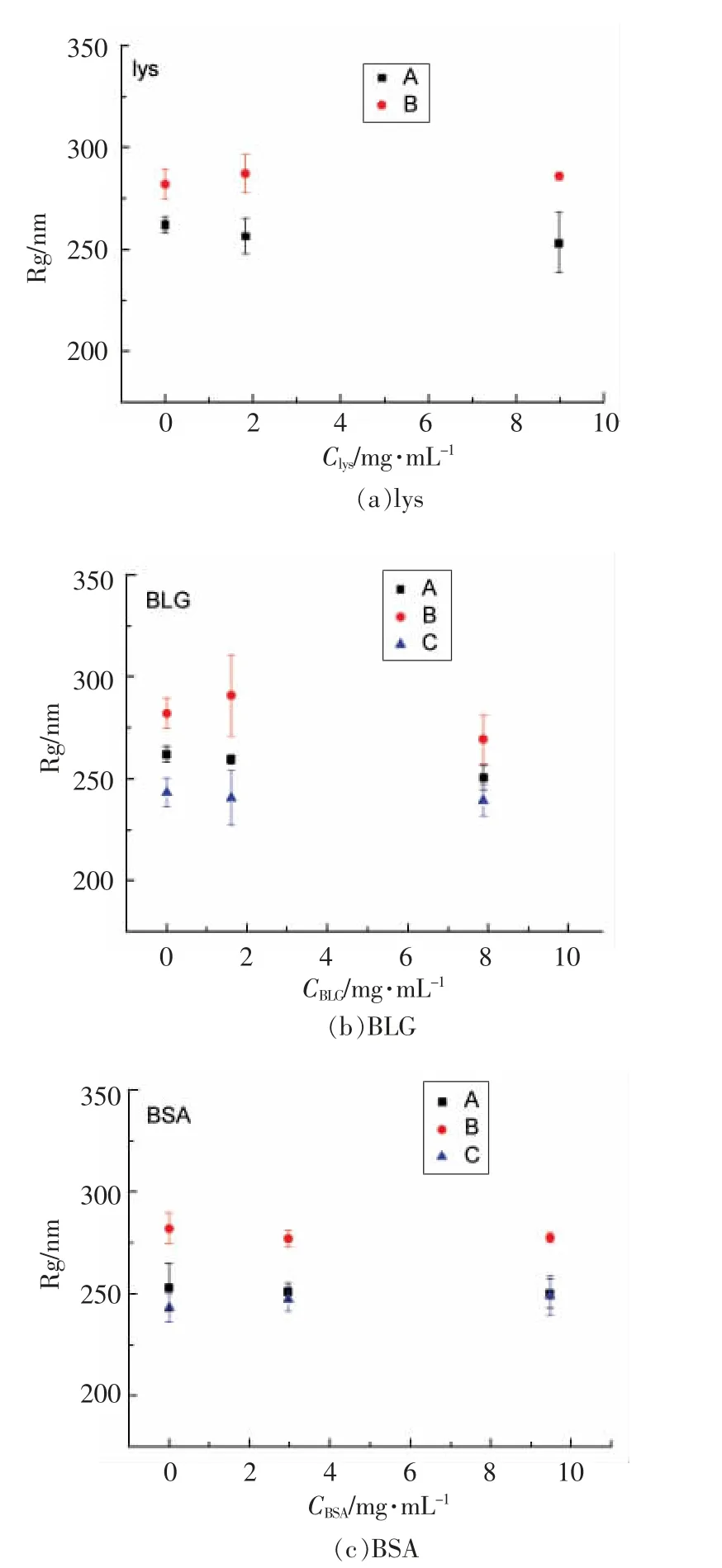
图3 蛋白-胶体粒子混合体系的Rg 变化Fig.3 Rg change of protein-colloidal particle hybrid system
2.4 lys-胶体粒子体系黏度测定
为了验证动态光散射测量溶液黏度方法的可行性,首先在水溶液中加入粒径不同的胶体粒子测定纯水的黏度[27]。其次为了避免缓冲液对黏度的影响,在Tris-HCl 缓冲液中加入3 种胶体粒子测定了缓冲液黏度。结果显示缓冲液与纯水黏度差异不大,说明缓冲液对黏度测量基本无影响。
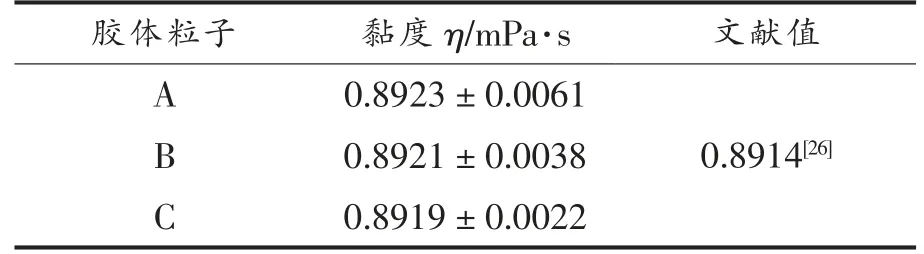
表1 水的黏度测定(25 ℃)Table 1 Determination of viscosity of water(25 ℃)
可以从图4 看出,lys 蛋白溶液的黏度随着蛋白浓度的增加有轻微上升趋势。可能是由于lys 在较低浓度时对于蛋白黏度影响较小,蛋白溶液分子内和分子之间的氢键作用比较弱。为了进一步证明测得溶液黏度值真实有效,本试验结合宏观流变测定了溶液黏度,如表3所示。通过将微观与宏观测得的黏度值进行显著性分析,发现A 与B得到的lys 黏度特性没有明显差异,说明A,B 均可适用于lys 黏度的测定。从以上结果可以初步得出,胶体粒子的粒径对lys 蛋白表观黏度测定影响较小。

表2 Tris-HCl 缓冲液的黏度测定(25 ℃,pH 7.4)Table 2 Viscosity determination of Tris-HCl buffer(25 ℃,pH 7.4)

表3 10 mg/mL lys 宏观与微观黏度结果(25 ℃,pH 7.4)Table 3 Macroscopic and microscopic viscosity results of 10 mg/mL lys(25 ℃,pH 7.4)

图4 不同胶体粒子与质量浓度下lys 黏度特性(25 ℃,pH 7.4)Fig.4 The viscosity characteristics of different concentration of lys with different colloidal particles(25 ℃,pH 7.4)
2.5 BLG-胶体粒子体系黏度测定
如图5所示,在胶体粒子A 分散的BLG 蛋白溶液体系中,BLG 溶液黏度随蛋白浓度提高有极小上升趋势,可能是由于分子间的引力没有明显变化。而B 与C 胶体粒子分散的体系中,在蛋白浓度较低时黏度趋势不变,而随着蛋白浓度进一步提高,蛋白表观黏度也有微小上升趋势,可能是由于蛋白溶液分子内的氢键作用增强从而引起黏度的增加。用宏观流变的方法测得溶液的黏度如表4所示。通过比较宏观与微观的黏度值,发现胶体粒子C 分散的溶液黏度与宏观测得的黏度差距最小,说明动态光散射利用胶体粒子所测得的黏度是真实有效的,其中胶体粒子C 与BLG 相互作用最弱,胶体粒子C 更适宜微观测黏度。

图5 不同胶体粒子与质量浓度下BLG 黏度特性(25 ℃,pH 7.4)Fig.5 The viscosity characteristics of different concentration of BLG with different colloidal particles(25 ℃,pH 7.4)

表4 8 mg/mL BLG 宏观与微观黏度结果(25 ℃,pH 7.4)Table 4 Macroscopic and microscopic viscosity results of 8 mg/mL BLG(25 ℃,pH 7.4)
2.6 BSA-胶体粒子体系黏度测定
图6 显示随着蛋白浓度的提高,蛋白溶液黏度有所波动。胶体粒子B 分散的体系中,随蛋白浓度的提高,蛋白溶液黏度有轻微上升趋势。胶体粒子C 分散的体系中,同BLG 一样,在较低浓度时蛋白溶液黏度没有随蛋白浓度提高而发生明显变化,而在蛋白浓度较高时,蛋白溶液黏度有轻微上升趋势。如表5所示,结合宏观测得的黏度进行显著性分析,可以看出pH 7.4 条件下,胶体粒子A,B,C 均适宜测量BSA 溶液黏度。

表5 10 mg/mL BSA 宏观与微观黏度结果(25 ℃,pH 7.4)Table 5 Macroscopic and microscopic viscosity results of 10 mg/mL BSA(25 ℃,pH 7.4)

图6 不同胶体粒子与质量浓度下BSA 黏度特性(25 ℃,pH 7.4)Fig.6 The viscosity characteristics of different concentration of BSA with different colloidal particles(25 ℃,pH 7.4)
2.7 OVA-胶体粒子体系黏度测定
如图7所示,随着浓度的提高,OVA 溶液黏度有所波动,整体趋于稳定,可能是由于蛋白浓度过低,蛋白分子间的氢键作用较弱导致黏度没有显著变化。结合表6,胶体粒子B 微观测得的黏度与宏观无显著性差异。因此,通过DLS 选择合适的胶体粒子微观测得的黏度值可以信赖。可能对微观测量结果造成偏差的主要原因有:1)颗粒团聚,本研究在试验前均将分散体系充分摇晃,但即便如此,也无法保证颗粒在分散体系中不会出现颗粒团聚现象。2)颗粒在待测液体样品中可能存在分布不均匀的情况,局部颗粒浓度过高可能会导致多重散射的现象。

图7 不同胶体粒子与质量浓度下OVA 黏度特性(25 ℃,pH 7.4)Fig.7 The viscosity characteristics of different concentration of OVA with different colloidal particles(25 ℃,pH 7.4)

表6 5 mg/mL OVA 宏观与微观黏度结果(25 ℃,pH 7.4)Table 6 Macroscopic and microscopic viscosity results of 5 mg/mL OVA(25 ℃,pH 7.4)
3 结论
本文利用光散射技术监测蛋白-胶体粒子体系的相互作用,优化了一种有效的微观测定溶液黏度的方法,增加了研究蛋白分子构象及溶液性质的另一个维度。结果表明,胶体粒子的粒径和蛋白浓度均对粒子间的相互作用影响较小,而胶体粒子与蛋白质表面带电性质却显著影响分子间的相互作用,且对体系黏度测定也有较大影响。因此利用黏度测定的方法监测分子间的相互作用是可行的。此外,比较宏观与微观测得的黏度值,发现表面接有羧基的胶体粒子在测量溶液黏度时适用性较高。这也说明了DLS 微观测得的黏度值是真实有效的,且DLS 测量蛋白溶液黏度具有显著的优势。
