超声辅助双连续型离子液体微乳液提取南极磷虾壳中的虾青素
2021-10-19张莉莉温淑媚
张莉莉,温淑媚,高 静
(1 广东药科大学食品科学学院 广东中山528458 2 广东海洋大学食品科技学院 广东湛江524088)
虾青素(3,3′-二羟基-4,4 ′-二酮基-β,β′-胡萝卜素)分子结构中含有共轭双键、β-紫罗兰酮环以及羟基,有“最强抗氧化剂”和“超级维生素E”之称[1]。此外,虾青素具有抗脂质氧化、抗炎、抗糖尿病、心血管疾病预防、免疫调节及抗癌变等作用,在饲料、食品、医药以及化妆品等领域展现出极高的经济价值和广阔的应用前景[2-4]。目前,商业获取虾青素主要通过化学合成和天然提取两种途径,且90%以上是化学合成虾青素。然而,化学合成虾青素与天然虾青素在结构、功能、应用及安全等方面存在较大差距。近年来,人们日益增长的食品安全意识及政府部门对虾青素安全性的严格监管,使从生物资源中获取天然虾青素成为广泛关注的焦点。然而,碱提法对设备腐蚀严重;有机溶剂法存在试剂残留、污染环境的风险;植物油黏度大不利于虾青素分离纯化。不仅如此,传统提取过程因温度高、时间长而导致虾青素的部分降解,不利于维持其稳定性和生物活性[5]。由于提取技术研究基础薄弱,天然虾青素的产量十分有限,因此远远不能满足国内外市场的需求。探索萃取天然虾青素的理想溶剂体系成为该领域亟待攻克的技术瓶颈。
离子液体具有熔点低、热稳定性好、溶解能力强以及可设计等优点,已成功用于虾青素等天然活性物质的萃取[6-7]。此外,Martins 等[8]研究表明中、低剂量的离子液体不会导致细胞损伤,离子液体在食品领域中具有良好的应用潜力。然而,离子液体单独作为提取剂不仅价格昂贵,而且黏度大,在萃取过程中通常以助剂的形式添加到有机溶剂中使用[9-10]。例如,Desai 等[11]利用1-乙基-3-甲基咪唑二丁基磷酸酯水溶液(质量分数40%)辅助乙酸乙酯,于45 ℃下从雨生红球藻中提取虾青素,因提取体系性质不稳定,故提取率仅达到70%。微乳液是由两种互不相溶的液体在表面活性剂界面膜的作用下形成热力学稳定,各向同性和透明的均相分散体系[12]。近年来,离子液体微乳液体系已广泛应用于萃取[13-14]、催化[15]、酶工程[16]、纳米材料[17]和生物质预处理[18]等多个领域。例如,Cao 等[13]以30 μL 海藻酸钠硫酸盐混合0.005 g 双(2-乙基己基)磺基琥珀酸钠(AOT),加入270 μL 1-丁基-3-甲基咪唑六氟磷酸([Bmim]PF6)作水相构筑离子液体微乳液,于室温下从牛血清白蛋白中提取低密度脂蛋白,提取率达83%。类似的,Shu 等[19]利用50 μL AOT 水溶液(0.5 mol/L)和450 μL[Bmim]PF6制备离子液体反相微乳液,在室温下振荡10 min,血红蛋白提取率高达96%。
尽管如此,现有微乳液体系的研究局限在采用咪唑基离子液体作为主要成分,其微乳液的特性更适宜于提取亲水性分子。更重要的是,微乳液体系提取天然虾青素仍有许多基础科学问题尚未解决,如:一是虾青素难溶于水,而含水微乳液体系中水含量高达50%,如何提供适宜虾青素溶解的内部条件? 二是虾青素的稳定性受多重因素影响,如何准确调控利于虾青素萃取的外部环境?这是微乳液萃取疏水性分子的基础以及应用基础研究中面临的共性难题。
本文针对从生物资源中提取天然虾青素的迫切需求,传统萃取方法面临的技术瓶颈以及现代微乳液萃取体系面临的新挑战,以膦基盐离子液体替代咪唑基离子液体(化学结构如图1所示),以卵磷脂替代亲水性表面活性剂构筑一种新型微乳液体系,采用超声辅助从南极磷虾壳中提取虾青素。首先研究离子液体种类、表面活性剂与助表面活性剂的比例(Km)和温度3 个因素对微乳液相行为的影响,并以电导率、动态光散射等方法表征微乳液体系的微观结构。然后,以离子液体微乳液为溶剂体系,从南极磷虾壳中萃取天然虾青素,研究不同条件下虾青素提取率,以及温度对虾青素稳定性的影响规律。最后,通过分析提取虾青素后虾壳残渣的结构特点,揭示离子液体微乳液提取南极磷虾壳中虾青素的机理。
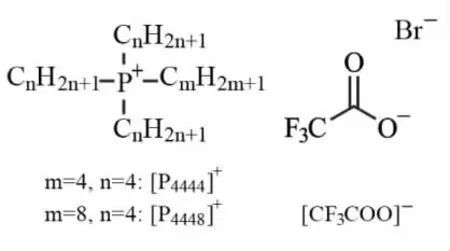
图1 离子液体的化学结构Fig.1 Chemical structure of ionic liquids
1 试验材料和方法
1.1 材料
南极磷虾,广东省湛江市国联水产食品有限公司;卵磷脂(Lecithin,来源于大豆,纯度>98%)、正丁醇(纯度>99.5%)、虾青素标准品(纯度>98%),上海Aladdin 化学试剂公司;四丁基三氟乙酸膦([P4444]CF3COO)、辛基三丁基溴化膦([P4448]Br)(纯度均>95%),中国科学院兰州化学物理研究所;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
LD-20AD 凝胶渗透液相色谱仪,日本岛津公司;DDSJ-308A 电导率仪,上海仪电科学仪器股份有限公司;Zetasizer NANO ZS90 动态光散射仪,英国Malvern Panalytical 公司;KQ-300 超声波清洗器,上海精科实业有限公司;HH-6 数显电子恒温水浴锅,常州国华电器有限公司;AW120 电子天平,日本岛津公司;UV757CRT 紫外分光光度计,上海精科仪器有限公司。
1.3 试验方法
1.3.1 拟三元相图绘制 首先固定卵磷脂与正丁醇的质量比(Km=1∶3,1∶4,1∶5,1∶6,1∶7 或1∶8),准确称取质量比为9∶1,8∶2,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8,1∶9 的离子液体和复合表面活性剂,经漩涡振荡后,分别在30 ℃和60 ℃下逐步加水,使其充分振荡并以超声辅助至其混匀,当溶液由澄清透明转变至浑浊分层时,记录水的质量,并计算各组分的质量分数。Origin 软件绘制得三元相图,相分离临界点各组分质量比所对应的点依次连成的曲线即为单相区和多相区的边界[20]。
1.3.2 微观结构表征 固定Km,配制不同R值(离子液体与复合表面活性剂的比例)的溶液并将其置于恒温水浴,达到热力学平衡后,使用移液枪逐个加蒸馏水,每加一次水,旋涡仪振荡至均匀,待体系温度稳定平衡后,用电导率仪测定离子液体微乳液体系的电导率,记录加入水的量和电导率值,根据体系电导率随水质量分数改变的曲线划分微乳液的微区结构[21]。
1.3.3 粒径测定 通过使用动态光散射(DLS)即激光粒度仪测量离子液体/卵磷脂/正丁醇/水在30℃和60 ℃下的粒径分布和粒径变化。
1.3.4 提取虾青素 洗净南极磷虾壳,冷冻干燥48 h 后取出并将其置于高速粉碎机粉碎,过120目筛,于-18 ℃下储存备用。随后按照质量比为离子液体∶卵磷脂∶正丁醇∶水=0.2∶0.12∶0.48∶0.2 配制离子液体微乳液。控制温度为30 ℃,以不同溶剂提取虾青素,确定最佳微乳液体系。随后在超声辅助条件下测定固液比、体系组分、超声功率和超声时间对虾青素提取的影响规律。
1.3.5 高效液相色谱测定虾青素含量 将提取液充分离心,取1 mL 虾青素上清液于10 mL 棕色容量瓶中定容,过0.45 μm 有机膜待用。色谱柱:C18;柱温:30 ℃;流动相:甲醇∶乙腈∶二氯甲烷∶水=85.0∶5.5∶5.0∶4.5(体积比)(A)、甲醇∶乙腈∶二氯甲烷∶水=28∶42.5∶25∶4.5(体积比)(B);流速:1.00 mL/min;检测波长:474 nm;进样量:20 μL[22]。虾青素提取量计算公式:

式中:X——虾青素提取量,μg/g;c——由标准曲线得到的虾青素质量浓度,μg/mL;V——提取液体积,mL;N——稀释倍数;m——虾壳粉质量,g。
1.3.6 虾青素稳定性测定 将反萃取所获虾青素提取物溶于乙醇,分别置于25~55 ℃下加热,利用紫外分光光度计在474 nm 处测定0,2,4,8,12 h的吸光值。
1.4 数据处理方法
试验均3 次平行测定,采用软件JMP 进行显著性分析,P<0.05 时具有统计学差异。
2 试验结果与讨论
2.1 离子液体微乳液体系的构建与表征
2.1.1 相行为
1)离子液体种类的影响 离子液体由不对称有机阳离子和有机或无机阴离子组成,自身结构对离子液体的亲疏水性质起到决定作用,也是影响其微乳液内部结构的首要因素[23]。图2a 列举了60 ℃时[P4444]CF3COO 或[P4448]Br 与卵磷脂、正丁醇、水形成的微乳液体系的拟三元相图。微乳液单相区域面积越大,表明各组分形成微乳的能力越强[24]。可以看出,离子液体成相能力关系为:[P4444]CF3COO>[P4448]Br。根据文献报道,尽管离子液体的阴离子Br-的亲水性指数大于CF3COO-,但是阳离子[P4448]+比[P4444]+侧链长,摩尔体积大,因此,[P4448]Br(HI=6.7)较[P4444]CF3COO(HI=9.0)具有更强的疏水性[25]。由此可见,在离子液体/卵磷脂/正丁醇/水微乳液体系中离子液体的阳离子摩尔体积是影响其微乳液成相能力的主要因素。
2)Km的影响 表面活性剂与助表面活性剂的比例Km是影响微乳液内部结构的另一个重要因素。例如,Wang 等[26]构建甘油三油酸酯/TX-100/正丁醇/[Bmim]BF4微乳液体系,表明Km对甘油三油酸酯基离子液体微乳液体系相行为具有重要的影响作用。为了降低表面活性剂的毒性,本文采用卵磷脂替代传统亲水性表面活性剂。卵磷脂是一种重要的生物表面活性剂,在医药保健、食品工业、化妆品等领域应用广泛[27-29]。但是,卵磷脂常温下为固体,单独以此作表面活性剂不利于离子液体的微乳化。Amiri-Rigi 等[30]利用卵磷脂/1-丙醇/橄榄油/水微乳液从工业番茄渣中提取番茄红素,提取率达88%。醇类的加入促使卵磷脂溶解后填补表面活性剂的空隙,使界面张力降低,并增加其流动性[31-32]。据此,以正丁醇作为助表面活性剂,绘制不同Km下离子液体/卵磷脂/正丁醇/水微乳液体系在35 ℃下的拟三元相图。
以[P4444]CF3COO 微乳液为例,Km=1∶8 的微乳区面积比Km=1∶3 的有所增加,但在1∶3~1∶7 范围内变化不明显,如图2b所示。当离子液体为[P4448]Br 时也有类似的结果。表面活性剂和助表面活性剂的比例对微乳液成相能力的影响主要与其亲水亲油平衡值(HLB)有关[33]。卵磷脂的HLB=7.0,正丁醇的HLB=6.9,二者十分接近,在不同Km条件下所计算的复合表面活性剂HLB 值差异不显著,这解释了Km对离子液体微乳液成相能力影响不显著的原因。但是,当Km值小于1∶3 时,因体系黏度过大而难以形成流动性良好的微乳液。
3)温度的影响Alexandridis 等[34]采用嵌段共聚物探究了胶团萃取过程中温度变化对胶团与伸展单体间发生转变行为的影响作用,研究表明温度是影响微乳液内部结构变化的重要因素。我们前期研究发现,[P4444]CF3COO 或[P4448]Br 与水、TX-100 形成的微乳液具有低临界溶解温度(LCST)的相转变行为,而四丁基四氟硼酸膦([P4444]BF4)、三丁基辛基三氟乙酸膦([P4448]CF3COO)或三丁基辛基四氟硼酸膦([P4448]BF4)微乳液具有高临界溶解温度(UCST)的相转变行为[23]。不仅如此,温度还是影响生物活性分子的稳定性和功能的关键因子。例如,Liu 等[35]研究了物质的量比为1∶1 的柠檬酸与葡萄糖合成的低共熔溶剂、甲醇等体系提取的姜黄素稳定性随温度的变化规律,结果表明,温度过高,姜黄素分子降解迅速,温度过低,溶剂体系传质减弱从而抑制了姜黄素的溶出。因此,探索温度对离子液体微乳液体系的影响规律可以为虾青素的溶解提供良好的外部环境。
图2c 和图2d 分别为20~70 ℃下[P4448]Br 和[P4444]CF3COO 微乳液体系的相图。整体来看,单相区域面积随温度的升高而增大,表明高温利于微乳液体系的形成。咪唑基离子液体也存在类似的微乳液相行为特点[36]。与此相反,在[P4444]CF3COO/TX-100/正丁醇/水和[P4448]Br/TX-100/正丁醇/水微乳液中,单相面积随温度升高而降低[23]。这可能是因为卵磷脂渗透到离子液体相后,更多地进入了栅栏层,升高温度使其在离子液体中的溶解度增加,从而使单相面积增大[37]。另一方面,[P4444]CF3COO 微乳液的单相区面积随温度变化较大,说明该离子液体的疏水性受温度影响显著,可以通过调控温度实现“破乳”和虾青素的分离纯化以及离子液体的循环利用。而[P4448]Br/卵磷脂/正丁醇/水微乳液体系的相平衡随温度变化相对较弱,说明该体系热物理学性质更加稳定。
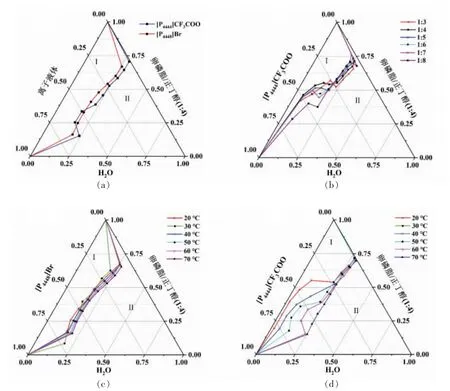
图2 离子液体微乳液体系的拟三元相图Fig.2 Phase diagrams of ionic liquid microemulsions
2.1.2 微观结构 通过测定电导率来划分微乳液单相区是研究微乳液微观结构的常用方法。如图3所示,含水量较低时,电导率随水分子含量的增加而迅速升高。当水分含量增加到一定程度,导电的微粒间距较大而彼此不相连,只能靠分散水滴碰撞导电,因此电导率缓慢上升,直至混合体系出现浑浊。据此判断,离子液体/卵磷脂/正丁醇/水微乳液体系的微观结构主要包括离子液体包水(W/IL)型和双连续(B)型两种,是因为卵磷脂的HLB值较低,油脂含量较高,有助于W/IL 型微乳液的形成。根据电导率变化关系,绘制离子液体微乳液微区结构(图4),为该溶剂体系萃取虾青素选择合适的组分比例提供依据。

图3 30 ℃下离子液体微乳液的电导率Fig.3 Conductivity of ionic liquid micromulsions at 30 ℃
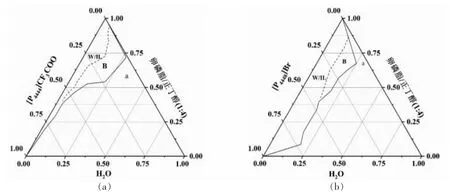
图4 30 ℃下离子液体微乳液体系微区划分Fig.4 Microsctructure of ionic liquid microemulsions at 30 ℃
2.1.3 粒径分布 根据离子液体微乳液的微区,按照离子液体∶卵磷脂∶正丁醇∶水质量比为0.2∶0.12∶0.48∶0.2 配制了双连续型微乳液体系,并在30~60 ℃范围内测定其粒径分布和平均粒径。如图5所示,[P4448]Br 和[P4444]CF3COO 两种离子液体微乳液在30 ℃时的平均粒径分别为56.74 nm 和60.04 nm,均小于100 nm,证明在该温度下[P4448]Br和[P4444]CF3COO 能够与卵磷脂、正丁醇、水形成微乳液(<100 nm)。该结论与图2 和图4 中离子液体微乳液的相平衡结果相一致。
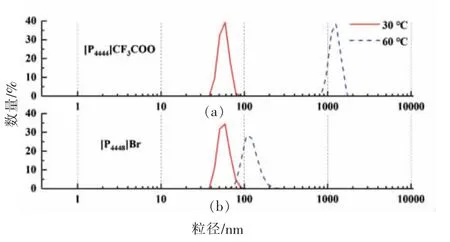
图5 [P4444]CF3COO 微乳液和[P4448]Br 微乳液的粒径分布Fig.5 Size distribution of[P4444]CF3COO-based microemulsions and[P4448]Br-based microemulsions
文献报道1-丁基-3-甲基咪唑四氟硼酸盐/TX-100/环己烷微乳液的粒径随温度升高而增大,出现这一结果的主要原因是温度升高致使表面活性剂尾基在有机溶剂中溶解度增强,减少了表面活性剂膜的界面曲率和分散水分子之间的氢键或水化作用,最终导致粒径增加[38]。对于[P4448]Br 和[P4444]CF3COO 微乳液,粒径随温度升高整体也呈现增大趋势。当温度由30 ℃升高至60 ℃,[P4444]CF3COO 微乳液体系粒径由60.04 nm 增至1 167 nm,较[P4448]Br 微乳液(由56.74 nm 增至133.0 nm)变化更显著,与其相图中单相区域面积变化规律一致(图2),这从微观角度进一步解释了[P4448]Br 和[P4444]CF3COO 微乳液相平衡随温度变化差异的原因。即温度的增加使[P4444]CF3COO/卵磷脂/正丁醇/水体系各组分的乳化作用增强,进而胶束溶胀形成微乳液。然而,温度过高不仅促使体系挥发过快,导致反应环境缩小,而且加剧粒子相互碰撞,破坏微乳液热力学稳定体系,最终因产生团聚而导致粒径增大。
2.2 离子液体微乳液提取虾青素
2.2.1 比较不同溶剂的影响 乙醇是工业中提取虾青素常用的试剂[39]。首先将离子液体微乳液萃取虾青素的能力与水、有机试剂、纯离子液体相比较,结果如图6所示。不同溶剂从南极磷虾壳中提取虾青素的能力如下:[P4444]CF3COO 微乳液≈[P4448]Br 微乳液≈乙醇≈正丁醇>[P4444]CF3COO >水>>[P4448]Br。当温度为30 ℃、质量分数为5%,提取时间为30 min 时,采用[P4444]CF3COO 微乳液提取虾青素的结果为(25.41±0.48)μg/g。
值得注意的是,纯离子液体常因离子液体分子之间以团簇形式相互作用形成黏度大的分子结构不利于传质而在生物分子萃取领域受到局限[31]。[P4448]Br 在室温下呈现黏稠状,难以提取虾青素。[P4444]CF3COO 具有一定流动性,但是传质速率仍然很低。离子液体微乳液体系因含有一定质量的水和醇类表面活性剂从而黏度小,利于虾青素的迁移。因此,离子液体微乳液不仅保留了纯离子液体的极性特征,而且黏度低,可以替代有机溶剂作为虾青素的理想溶剂。
2.2.2 固液比的影响 为了进一步促进虾青素在离子液体微乳液体系中的溶解能力,采用超声辅助微乳液从南极磷虾壳中提取虾青素。Amiri-Rigi等[40]以皂苷作表面活性剂、甘油为助表面活性剂、双蒸水作水相构建微乳液体系并从番茄工业废弃物中提取番茄红素,当在一定范围内增大微乳液的用量时,番茄红素的溶解度显著增加。类似的,[P4444]CF3COO 微乳液固液比从1∶10 增加到1∶90,虾青素的提取量从(9.17±1.20)μg/g 增加到(55.54±5.22)μg/g,但[P4444]CF3COO 微乳液固液比增至1∶60 后微乳液用量的进一步增加对提高虾青素提取量没有显著性影响(图6)。因此,当超声功率与超声时间分别为60 W 和30 min,微乳液体系组成为[P4444]CF3COO/卵磷脂/正丁醇/水(质量比=0.2∶0.12∶0.48∶0.2),质量分数为1.7%时,虾青素提取量达到(45.09±2.67)μg/g。
2.2.3 组分的影响 不同的组分比例对离子液体微乳液的微观结构有显著影响,从而决定了对生物分子的溶解能力。在超声功率60 W,超声时间30 min,质量分数为1.7%条件下,测定了微乳液的不同组分质量比(离子液体∶卵磷脂∶正丁醇∶水)对虾青素提取量的影响。
从图6 可以看出,当[P4444]CF3COO 含量由20%增至35%,离子液体微乳液对虾青素的提取量由(45.09±2.67)μg/g 降低至(38.53±0.08)μg/g。一方面因为[P4444]CF3COO 用量过多导致微乳液体系黏度增大而不利于传质,这与图6a 中纯离子液体对虾青素提取率较低的结果一致。另一方面,离子液体含量的逐渐增大促使微乳液的微观结构从双连续型转变为离子液体包水型(图4),虾青素难以溶解在“水池”中,因此该微观结构不利于虾青素的提取。当微乳液体系组成为[P4444]CF3COO/卵磷脂/正丁醇/水(质量比=0.2∶0.12∶0.48∶0.2)时,微乳液为双连续型微观结构,对虾青素溶解能力强。
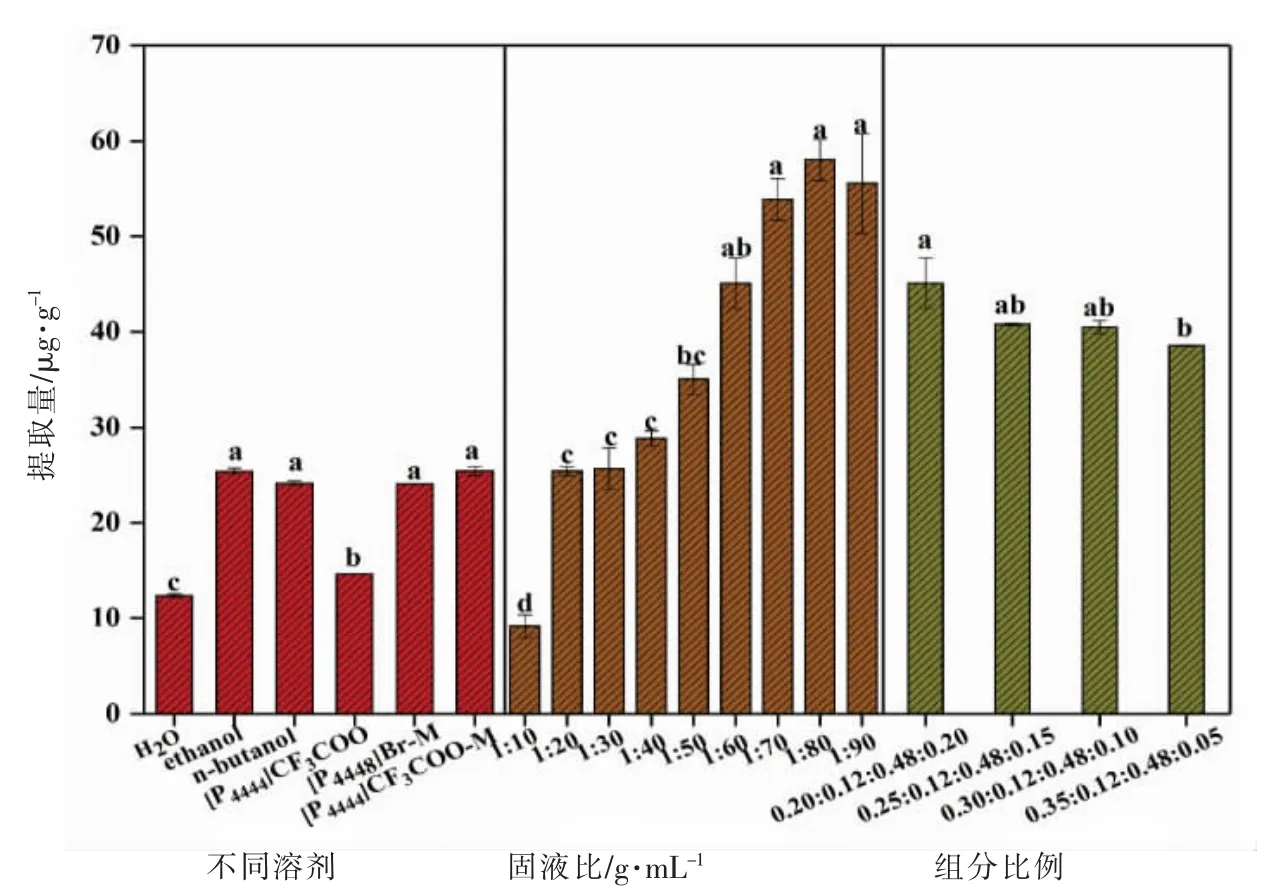
图6 [P4444]CF3COO 微乳液提取虾青素Fig.6 Extraction of astaxanthin by[P4444]CF3COO-based microemulsions
2.2.4 超声功率和时间的影响 与乙醇等有机试剂相比,离子液体微乳液黏度较纯离子液体虽有降低,但仍存在较大的内摩擦力。因此传统植物油提取法常采用升温降低溶剂体系黏度进行萃取。例如,向日葵油或向日葵油甲酯于70 ℃处理虾废弃物150 min,所获虾青素提取率分别为60%和80%[41]。然而,该方法不仅提取率低而且不利于生物分子活性的保持。超声辅助是常温下提取生物分子的重要辅助手段之一[42]。Zhao 等[43]利用超声辅助探究虾青素稳定性随超声功率和时间的变化规律,结果表明超声时间的增加利于增加物料与液体的有效接触时间,促进虾青素的有效溶解,从而获得更高提取量。然而,超声功率以及处理时间的进一步增长均会导致虾青素降解加速。
为了进一步提高虾青素的提取效率,以[P4444]CF3COO/卵磷脂/正丁醇/水(质量比=0.2∶0.12∶0.48∶0.2)为介质,在质量分数为1.7%条件下超声辅助从南极磷虾壳中提取天然虾青素,结果如图7所示。当超声辅助提取30 min 后,虾青素提取量基本接近饱和,达到(45.09±2.67)μg/g。然而,超声辅助提取2 min 即可达到最大提取量的97.98%,这一结果表明[P4444]CF3COO 微乳液体系在超声辅助条件下短时间内可达到良好的提取效果,不仅降低了经济成本,而且利于维持虾青素的稳定性。此外,适宜的超声功率可促进溶质的溶解分散,但是当超声功率过高,超声波所产生的机械作用过于强烈时会使提取物的微观结构遭到破坏,导致虾青素提取量降低。综上所述,当超声辅助提取的功率和时间分别为100 W 和2 min,质量分数为1.7%,[P4444]CF3COO/卵磷脂/正丁醇/水(质量比=0.2∶0.12∶0.48∶0.2)的虾青素提取量达到(48.21±0.07)μg/g,此时提取率为97.75%。
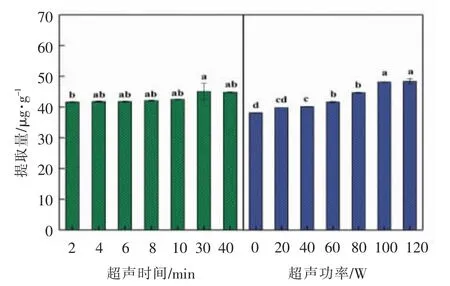
图7 超声辅助对[P4444]CF3COO/卵磷脂/正丁醇/水微乳液提取虾青素的影响Fig.7 Effect of ultrasonic assistance on astaxanthin extraction by[P4444]CF3COO/lecithin/n-butanol/water microemulsions
2.3 虾青素的稳定性
Qiao 等[44]在评价游离虾青素和虾青素酯稳定性的研究中明确指出,当处理温度由40 ℃升至80℃,虾青素降解增大,具有热敏性的特点。吸光值是用来衡量光被吸收程度的物理量,通过在474 nm 处测定虾青素的吸光值,可评价虾青素稳定性情况。为了证明虾青素在离子液体微乳液体系中的稳定性,测定了25,35,45,55 ℃下虾青素在[P4444]CF3COO/卵磷脂/正丁醇/水微乳液中的吸光值。结果如图8所示,经过12 h 水浴恒温处理,所测吸光值分别为0.653,0.649,0.636 和0.624,降解率由2.54%增至5.88%。这一结果表明随温度升高,虾青素降解增大,这是因为温度升高加速了[P4444]CF3COO/卵磷脂/正丁醇/水微乳液中各物质的分子运动,从而导致虾青素部分降解,吸光值下降,稳定性受到破坏。
提取时间是影响虾青素稳定性的另一个主要原因。随着加热时间延长,游离虾青素两端的羟基易被脂肪酸取代,从而增加了虾青素酯的稳定性,因此,虾青素在短时间内降解不大[45]。但是,随着处理时间延长至12 h,45 ℃下所测虾青素吸光值分别为0.654(2 h),0.650(4 h),0.650(8 h),0.644(10 h),0.636(12 h),降解率由0%增至2.54%。这是因为虾青素所富含的电子共轭双键结构长期处于高温下对物理和化学降解高度敏感,导致降解增加[46]。类似的,Parjikolaeib 等[41]利用向日葵油在70 ℃下处理北极甜虾2.5 h 提取虾青素的研究与谈俊晓等[47]利用碱性蛋白酶与木瓜蛋白酶和乙醇混合溶剂体系在51 ℃下处理南极磷虾2.1 h 提取虾青素的研究均存在高温且耗时长的不足,虾青素易发生降解。与此相反,由图8 可知,在[P4444]CF3COO/卵磷脂/正丁醇/水微乳液中,虾青素经25℃水浴恒温12 h 与在35,45,55 ℃下水浴恒温2 h 的吸光值在统计学上差异不显著,表明在该条件范围内利于虾青素稳定性的保持。
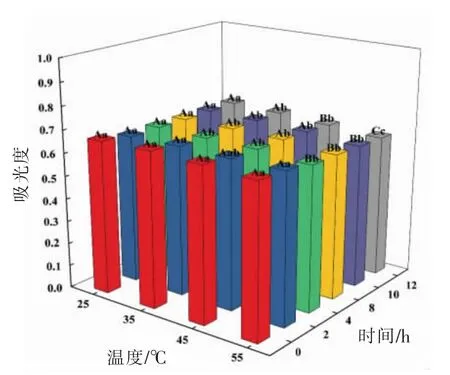
图8 虾青素在[P4444]CF3COO/卵磷脂/正丁醇/水微乳液中的稳定性Fig.8 Stability of astaxanthin in[P4444]CF3COO/lecithin/n-butanol/water microemulsions
2.4 双连续型离子液体微乳液提取虾青素的机理
离子液体结构内部的氢键、π-π 键、范德华力以及离子间作用力使其对生物分子具有良好的溶解特性。为了考察[P4444]CF3COO 和[P4448]Br 微乳液对南极磷虾壳的溶解作用,采用扫描电镜观察了提取前后南极磷虾壳的表观形貌。如图9所示,未处理的南极磷虾壳表面光滑且呈现致密的多层结构,但经过[P4444]CF3COO 微乳液处理后的虾壳出现不同程度的弯曲,且多层结构遭到破坏。这可能是因为微乳液体系中的离子液体阳离子和卵磷脂疏水端通过静电作用形成的晶体空间点阵吸引了具有共轭双键和β-紫罗兰酮环的虾青素分子。此外,研究表明番茄红素分子与卵磷脂疏水尾的相互作用能力是番茄红素在微乳液中具有良好溶解性的重要原因[30]。类似的,Liu 等[48]以胆固醇为油相、卵磷脂和胆盐为表面活性剂和助表面活性剂并结合聚氧乙烯蓖麻油水相制备微乳从穿心莲中提取穿心莲内酯、二萜内酯等酯类化合物,证明亲脂性脂肪酸结构的卵磷脂对于疏水性分子的提取起到重要的作用。另一方面,微乳液体系中的离子液体阴离子与正丁醇和虾青素分子共轭双键的氢键作用也是促进南极磷虾壳内部多孔结构形成的重要原因。

图9 [P4444]CF3COO/卵磷脂/正丁醇/水微乳液处理虾壳前后对比Fig.9 Comparison of[P4444]CF3COO/lecithin/n-butanol/water treatment of Antarctic krill shells
综上所述,双连续型离子液体微乳液提取虾青素的机理为(图10):1)[P4444]CF3COO/卵磷脂/正丁醇/水或[P4448]Br/卵磷脂/正丁醇/水微乳液通过破坏瓦解南极磷虾壳内部结构,增大虾壳与微乳液的接触面积,利于虾壳表面及内部的虾青素向溶剂中迁移。2)虾青素的共轭双键和β-紫罗兰酮环与微乳液中卵磷脂和离子液体的阳离子疏水端存在较强的静电作用,虾青素的氢键与正丁醇、离子液体阴离子之间存在较强的氢键相互作用。
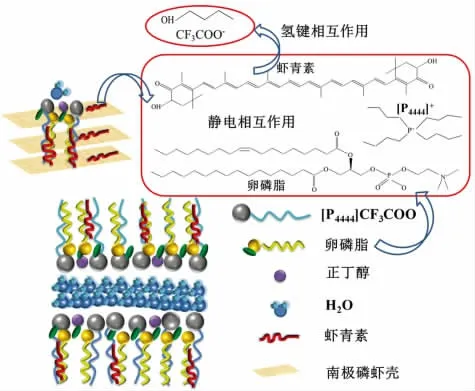
图10 [P4444]CF3COO/卵磷脂/正丁醇/水体系提取虾青素的机理Fig.10 Mechanism of[P4444]CF3COO/lecithin/n-butanol/water extracting astaxanthin
3 结论
本文采用卵磷脂作为乳化剂与离子液体构建双连续型微乳液体系,并从南极磷虾壳中提取天然虾青素。在20~70 ℃范围内,[P4448]Br 和[P4444]CF3COO 能够与卵磷脂、正丁醇和水形成微乳液体系。该微乳液体系不仅能够破坏虾壳的致密组织,形成多孔疏松的结构,而且卵磷脂和离子液体与虾青素之间的疏水性作用和氢键作用提高了虾青素的溶解度。在超声辅助条件下(100 W 和2 min),当质量分数为1.7%时,[P4444]CF3COO/卵磷脂/正丁醇/水(质量比=0.2∶0.12∶0.48∶0.2)微乳液的虾青素提取量达(48.21±0.07)μg/g。研究结果为天然虾青素的提取提供了一种温度低、时间短、提取率高、虾青素稳定性强的新方法。当然离子液体微乳液体系组分复杂,破乳困难,生物分子的分离纯化是需要进一步突破的科学问题。
