黑木耳及其多糖对高脂饮食大鼠的降血脂和肠道菌群调节作用
2021-10-19张廷婷赵文颖谢倍珍
张廷婷,赵文颖,谢倍珍,2,3*,刘 红,2,3
(1 北京航空航天大学生物与医学工程学院环境生物学与生命保障技术研究所 北京100083 2 北京航空航天大学生物医学工程高精尖创新中心 北京100083 3 北京航空航天大学空天生物技术与医学工程国际联合研究中心 北京100083)
大量研究表明,长期高脂肪饮食或可诱发机体多种慢性疾病的发生,包括肥胖、非酒精性脂肪肝与高脂血症等[1-3]。高脂饮食中的大量脂质会引发血脂代谢异常,血脂水平增高,进而诱发高脂血症。目前,临床上常使用他汀类药物抑制体内胆固醇的合成,起到降低胆固醇的功效[4],然而,这类药物可能对肝功能造成损伤,引发不良反应[5]。目前已证实功能性食品成分包括植物固醇和膳食纤维等具有降血脂的作用[6-7]。植物固醇在体内可与胆固醇形成竞争关系,抑制体内胆固醇的吸收。膳食纤维可与体内的胆固醇相结合,刺激肠道蠕动。
黑木耳是一种肉质鲜美,药食同源的真菌类植物,富含蛋白质(10.6%)、糖类(65%)、粗纤维(20%)以及大量的生物活性物质,如黑木耳多糖、多酚类物质等[8-9],具有降血脂、降血糖、抗氧化、抗血栓、抗肿瘤、抑菌等药用价值[10-16]。谢意珍等[17]发现灌胃3 mL 0.25 g/kg 体重的黑木耳多糖,能够显著降低高脂饮食大鼠的血清总胆固醇及低密度脂蛋白胆固醇水平(P<0.05)。何嘉烽[18]发现高脂饮食大鼠经黑木耳多糖预防性给药后达到降低总胆固醇,提高高密度脂蛋白胆固醇的预防高脂血症效果。
黑木耳对血脂的有益调节作用或与其对肠道微生物结构的改变有关。肠道微生物与饮食有着天然的联系,一方面,饮食会部分地通过调节肠道微生物组成直接影响人类健康,摄入的食物部分在胃和小肠被消化吸收,而较难消化的食物可能会进入大肠并改变肠道菌群的多样性[19-20]。大量研究证明肠道菌群改变与肥胖、糖尿病、结肠癌及情绪等健康状况相关[21-25]。另外,肠道微生物可以发酵未消化的食物,生成的代谢产物会对人体健康产生潜在影响,膳食纤维发酵生产的短链脂肪酸已被证实对机体健康有益[26]。张放放等[27]发现黑木耳对肠道菌群的体外干预富集了双歧杆菌,而关于黑木耳的体内调节菌群作用研究较少。黑木耳中丰富的多糖及多酚等生物活性物质可能在肠道菌群的调节中发挥重要作用。目前对黑木耳生理功能的研究大都针对黑木耳中的重要活性物质黑木耳多糖,而忽视了对黑木耳中其它膳食纤维及多酚类物质的研究。对于黑木耳及其多糖预防高脂血症功效的差异,以及与肠道菌群结构调节的相关性等尚未见研究报道。本文研究黑木耳及其主要生物活性物质——黑木耳多糖对高脂饮食大鼠诱发高脂血症的预防作用以及对肠道菌群的调节作用。
1 材料与方法
1.1 动物、材料与试剂
5 周龄健康雄性SD 大鼠 【生产许可证号:SCXK(京)2012-0001】,北京维通利华生物科技有限公司。常规饲料与高脂饲料,北京科澳协力有限公司。常规饲料蛋白质、脂肪、碳水化合物供能比分别为23.1%,11.8%,65.1%,总能3.4 kcal/g,高脂饲料蛋白质、脂肪、碳水化合物供能比分别为11.3%,38.3%,50.4%,总能4.23 kcal/g,饲料配方见表1(生产许可证号:SCXK(京)2014-0010)。
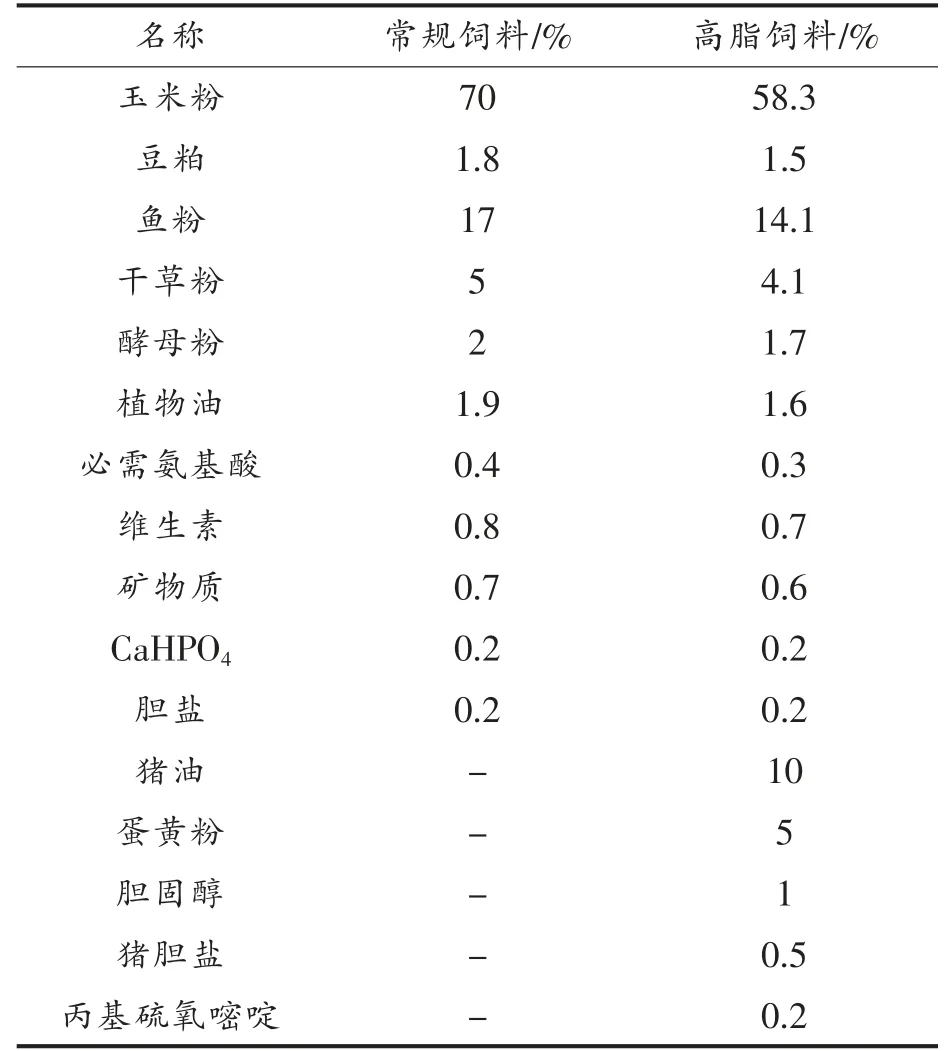
表1 大鼠饲料配方Table 1 Rat feed formula
黑木耳(Auricularia auricula)和黑木耳多糖(Auricularia auriculapolysaccharides),中国黑龙江省丹江老黑山镇农场。将黑木耳用蒸馏水清洗数次至水澄清后泡发8 h、40 ℃烘箱烘干后保存于4 ℃冰箱中备用。取一定量的黑木耳送至西安国联质量检测技术股份有限公司检测其中的黑木耳多糖含量,经检测黑木耳中的黑木耳多糖质量分数为8.96%,购买的黑木耳多糖质量分数为50%。
总胆固醇(Total Cholesterol,TC)测定试剂盒、低密度脂蛋白胆固醇(Low-density Lipoprotein Cholesterol,LDL-C)测定试剂盒和高密度脂蛋白胆固醇(High-density Lipoprotein Cholesterol,HDL-C)测定试剂盒,北京中生北控生物科技股份有限公司;油红“O”染色试剂盒,武汉谷歌生物科技有限公司;DNA 强力提取试剂盒(PowerSoilRDNA Isolation Kit),北京百迈客生物科技有限公司。
1.2 仪器与设备
CM1520 型冰冻切片机,德国徕卡公司;LV100ND 型金相显微镜,北京新卓仪器有限公司;LC-20AT 型高效液相色谱仪,日本岛津公司。
1.3 方法
1.3.2 样品收集与处理 在1 周的适应性饲养后随机选取6 只大鼠无菌收集粪便(标记为NCD0组)。在干预性饲养过程中,分别于干预初始时(week 0)及之后每两周(week 2,week 4 和week 6)对各组大鼠称重并于次日尾尖取血1 mL,离心后取上清液作为血清样品于-20 ℃冰箱保存。试验结束时(干预6 周),将大鼠隔夜禁食12~16 h 后于次日尾尖取血1 mL,并随后每组随机解剖6 只大鼠,大鼠解剖前收集新鲜粪便样本置于灭菌的离心管内,于-80 ℃冰箱保存;解剖大鼠后分离肝脏组织并称重,取1 cm×1 cm×1 cm 体积的肝脏置于4%的多聚甲醛固定液中,于4 ℃冰箱保存;取盲肠内容物于-80 ℃冰箱保存。
1.4 大鼠相关指标测定
1.4.1 大鼠血清生化指标的测定 大鼠血清样品用于检测TC、LDL-C 和HDL-C 含量。将冻贮的血清样本室温解冻30 min,用移液器取100 μL 血清,按相关试剂盒的使用说明,分别采用CHODPAP 法测定血清中TC 含量,采用直接法-表面活性剂清除法测定血清的LDL-C 及HDL-C 含量。
1.4.2 大鼠肝指数的测定 试验结束时,解剖大鼠、分离其肝脏并称重,按公式(1)计算肝指数。
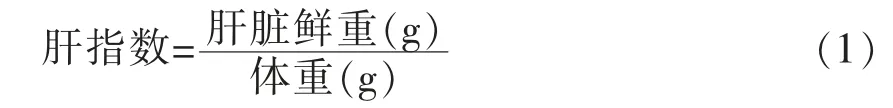
1.4.3 大鼠肝脏组织形态学的观察 取1cm×1cm×1cm 体积的肝脏组织置于涂有OCT 包埋剂(optimal cutting temperature compound,OCT)的样品托上速冻,冰冻切片机切片,厚度为6 μm。组织切片按油红“O”染色试剂盒说明进行染色,待组织切片干燥后用金相显微镜观察染色结果。
1.4.4 大鼠肠道代谢产物检测 称取一定量的盲肠内容物,按2 mL/g 加入超纯水,充分混匀后于4℃10 000 r/min 离心15 min,吸取上清液。将上清液过0.22 μm 滤膜,过滤液稀释1 倍后利用高效液相色谱仪测定其中的有机酸的浓度。其中液相色谱条件设置如下:1)色谱柱:Aminex HPX-87H柱(4.6 mm×250 mm,5 μm);2)柱温:30 ℃;3)检测器:紫外检测器;4)检测波长:215 nm;5)流动相:5 mmol/L 硫酸水溶液;6)进样量:10 μL;7)流速:0.6 mL/min。
1.4.5 大鼠肠道微生物DNA 提取及测序 取一定量的冻贮粪便样本室温解冻30 min,按照土壤基因组DNA 强力提取试剂盒说明提取DNA,于-20 ℃保存。使用扩增引物(338F 5'- ACTCCTACGGGAGGCAGCA-3' 和806R 5'- GGACTACHVGGGTWTCTAAT-3')对样品 16S rDNA的V3-V4 区进行PCR 扩增,利用Illumina Hiseq 2500 平台使用QIIME v1.8.0 软件对16S rDNA的V3-V4 区进行高通量测序(北京百迈客生物科技有限公司)。
使用vsearch2.8.1 软件对高通量测序得到的原始数据进行双端序列合并,切除引物并去冗余;使用usearch10 软件对序列ESV 非聚类去噪;参考Silva 数据库,在97%的相似度水平下聚类获得操作分类单位(Operational Taxonomic Unit,OTU);以最小样品数据量对OTU 等量抽样标准化得到抽平的OTU 表;使用Rstudio 软件分析群落的丰度、多样性及差异并作图。
式(10)表示根据zn,p,h,kn,p,f,wn,p计算每一个分块p与芯片f分区交集数值上限,式(11)规约分块p在左右两侧与f分区部分相交时重叠区域的范围.
1.5 统计学分析
用SPSS v22.0 软件(SPSS 公司)进行统计学分析,使用单因素方差分析(One way ANOVA)方法统计,用Graphpad Prism 8 软件进行作图,数据以均数±标准差表示。
2 结果与分析
2.1 黑木耳及黑木耳多糖对高脂饮食大鼠生理指标的影响
2.1.1 黑木耳及黑木耳多糖对高脂饮食大鼠体重及肝脏重的影响 干预阶段各组大鼠体重随时间变化趋势如图1a所示。大鼠适应性饲养1 周后,各组大鼠的体重无显著性差异(P>0.05),在第6周时,HFD 组、HFA 组和HFAAP 组大鼠的体重分别比NCD 组高出16.81%(P<0.01)、3.94%(P<0.05)和13.87%(P<0.01),说明高脂饮食能够引起大鼠体重增长从而导致肥胖;与HFD 组相比,HFA 组和HFAAP 组大鼠的体重分别降低了11.02%(P<0.01)和2.52%(P>0.05),表明黑木耳能够显著抑制高脂饮食大鼠体重的增长,预防大鼠肥胖,而黑木耳多糖对高脂饮食大鼠的体重并无明显影响。
与NCD 组相比,HFD 组大鼠的肝重及肝指数显著升高(P<0.05)(图1b),肝脏是脂质代谢的重要场所,过量脂肪的摄入在肝内堆积引起肝脏脂质代谢障碍,导致肝脏负担加重[28],肝重及肝指数的增加说明高脂饮食能够造成大鼠的肝脏损伤;而HFA 组和HFAAP 组大鼠均能够显著降低高脂饮食大鼠的肝重及肝指数(P<0.05),且喂食黑木耳的大鼠其肝重及肝指数恢复至与正常对照组相当的水平,二者无显著差异。
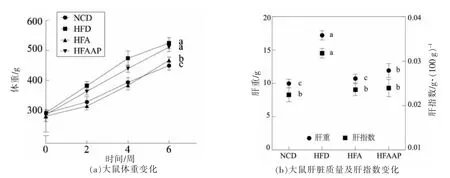
图1 黑木耳及黑木耳多糖对高脂饮食大鼠体重及肝指数的影响Fig.1 Effects of Auricularia auricula and Auricularia auricula polysaccharides on body weight and liver index in high-fat diet rats
2.1.2 黑木耳及黑木耳多糖对高脂饮食大鼠血清生化指标的影响 各组大鼠血清中TC、LDL-C 和HDL-C 的含量在干预阶段的变化情况如图2所示,试验开始时,各组大鼠的血清TC、LDL-C 和HDL-C 含量均无显著差异(P>0.05)。干预期间,NCD 组大鼠血清生化指标均保持稳定,而HFD 组大鼠的血清TC 和LDL-C 含量随着饲喂时长的增加迅速上升,HDL-C 含量迅速下降,在干预结束时HFD 组大鼠的血清生化指标均与NCD 组大鼠呈现出显著性差异,表明持续饲喂高脂饮食能够导致大鼠的血清生化指标异常,形成高脂血症。
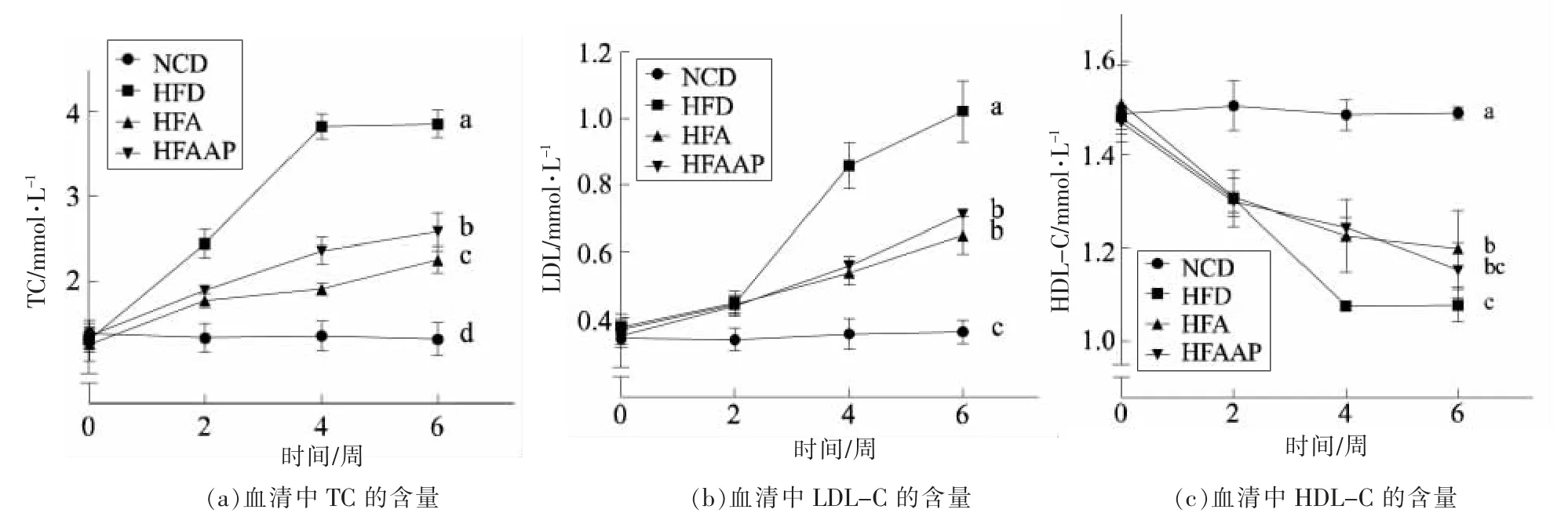
图2 黑木耳及黑木耳多糖对高脂饮食大鼠血清生化指标的影响Fig.2 Effect of Auricularia auricula and Auricularia auricula polysaccharides on serum biochemical parameters in high-fat diet rats
HFA 组及HFAAP 组大鼠的血清生化指标与HFD 组呈现出相似的增加或降低趋势,但有一定的改善。与HFD 组大鼠相比,HFA 和HFAAP 组大鼠的血清TC 和LDL-C 含量均显著降低,且HFA 组大鼠的血清TC 含量较HFAAP 组降低了12.79%(P<0.01),但两组大鼠的血清LDL-C 含量无显著差异(P>0.05);HFA 组大鼠的血清HDL-C含量相比于HFD 组升高11.11%(P<0.01),而HFAAP 组无显著性差异(P>0.05)。血脂是机体血液内所含脂质的总称,其中包括胆固醇、甘油三脂、胆固醇脂、β-脂蛋白、磷脂等,脂肪代谢或运转异常使其中一种或多种脂质高于正常称为高脂血症。大鼠的血清生化指标数据表明,黑木耳能够显著抑制高脂饮食TC、LDL-C 含量升高和HDLC 含量降低,而黑木耳多糖仅对TC、LDL-C 水平升高具有显著的抑制作用,且黑木耳较黑木耳多糖具有更明显的降低血清TC 水平的作用。
2.1.3 黑木耳及黑木耳多糖对高脂饮食大鼠肝脏及其脂肪堆积的影响 黑木耳及黑木耳多糖对肝内脂类代谢的影响由肝脏油红“O”染色结果反映,肝细胞内红染脂肪滴的体积与脂肪堆积程度呈正比。图3 结果显示,NCD 组大鼠肝细胞内未见明确的红染脂肪滴;HFD 组大鼠肝细胞内呈现大片的红染脂肪滴,肝脏脂肪堆积程度较为严重;HFA 组与HFAAP 组大鼠的肝脏脂肪堆积程度较HFD 组均有所减轻,且HFA 组减轻效果更明显。
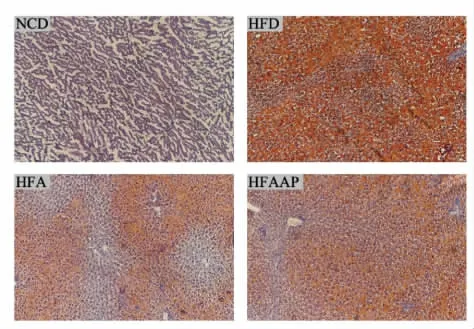
图3 大鼠的肝脏组织油红“O”染色结果(×20)Fig.3 Results of oil red “O” staining in liver tissues of rats(× 20)
2.2 黑木耳及黑木耳多糖对高脂饮食大鼠肠道代谢及菌群结构的影响
2.2.1 黑木耳及黑木耳多糖对高脂饮食大鼠肠道代谢的影响 各组大鼠盲肠内容物中乙酸、丙酸、丁酸及总短链脂肪酸浓度的检测结果见图4,可以看出,与NCD 组相比,HFD 组大鼠的乙酸、丁酸和总短链脂肪酸的含量均显著降低(P<0.05);HFA 组大鼠的乙酸、丁酸和总短链脂肪酸含量均显著升高(P<0.05);而HFAAP 组大鼠的短链脂肪酸中仅乙酸和总短链脂肪酸的含量有所升高(P<0.05)。结果表明黑木耳能够显著增加高脂饮食大鼠的肠道代谢产物中乙酸和丁酸的含量,分析其原因可能是黑木耳中丰富的膳食纤维能够作为肠道代谢底物经发酵生成短链脂肪酸,从而增加了盲肠内容物中短链脂肪酸的含量。

图4 黑木耳及黑木耳多糖对高脂饮食大鼠肠道代谢产物的影响Fig.4 Effects of Auricularia auricula and Auricularia auricula polysaccharides on intestinal metabolites in high-fat diet rats
2.2.2 黑木耳及黑木耳多糖对高脂饮食大鼠肠道菌群结构的影响 通过高通量测序检测分析黑木耳及黑木耳多糖对大鼠肠道菌群多样性和结构的影响。本试验中样品的平均测序量为54 588 条序列,最少的样品序列达到40 278 条。通过对原始序列拼接过滤抽平后,按照97%的相似度划分OTU,以便后续分析。
图5a 为样品的稀释性曲线,反映样品测序数据量合理度。可以看出,随着测序量的增加,新增OTU 的数量逐渐增加并趋向平坦,说明测序量合理,测序深度足以覆盖大多数细菌。
Alpha 多样性通常用来衡量物种多样性及均匀度。其中,Chao1 指数(图5b)用于衡量物种多样性,Simpson 指数(图5c)用于衡量物种均匀度。如图所示,与NCD0 组相比,NCD 组大鼠物种多样性及均匀度均显著提高,说明6 周的饲养使大鼠菌群更加丰富且均匀;HFD 组大鼠粪便菌群的物种多样性指数Chao1 相比于NCD 组显著降低,而HFA 组和HFAAP 组相比于HFD 组均有所升高,且HFA 组的升高作用更为显著;与NCD 组相比,HFD 组大鼠的物种均匀度降低,黑木耳多糖的干预使高脂饮食大鼠物种均匀度有所提高,黑木耳则改善了部分大鼠的物种均匀度,说明高脂饮食导致大鼠的肠道菌群多样性及均匀度降低,黑木耳及黑木耳多糖的干预明显提高了高脂饮食大鼠的肠道菌群多样性并在一定程度上使物种分布更加均匀。
为了更好地表征个体间微生物组成的相似性,选用Beta 多样性来衡量。图5d 中,NCD0 组与NCD 组大鼠菌群完全分离,说明喂食常规饲料的大鼠在6 周的饲养结束后粪便菌群发生了较大变化;HFD 组大鼠的菌群与NCD 组很好地分离,说明高脂饮食使大鼠菌群结构改变;通过比较HFD组、HFA 组及HFAAP 组大鼠的菌群分布,可以看出喂食黑木耳及黑木耳多糖的大鼠菌群更倾向于远离HFD 组,且HFA 组趋势更明显。
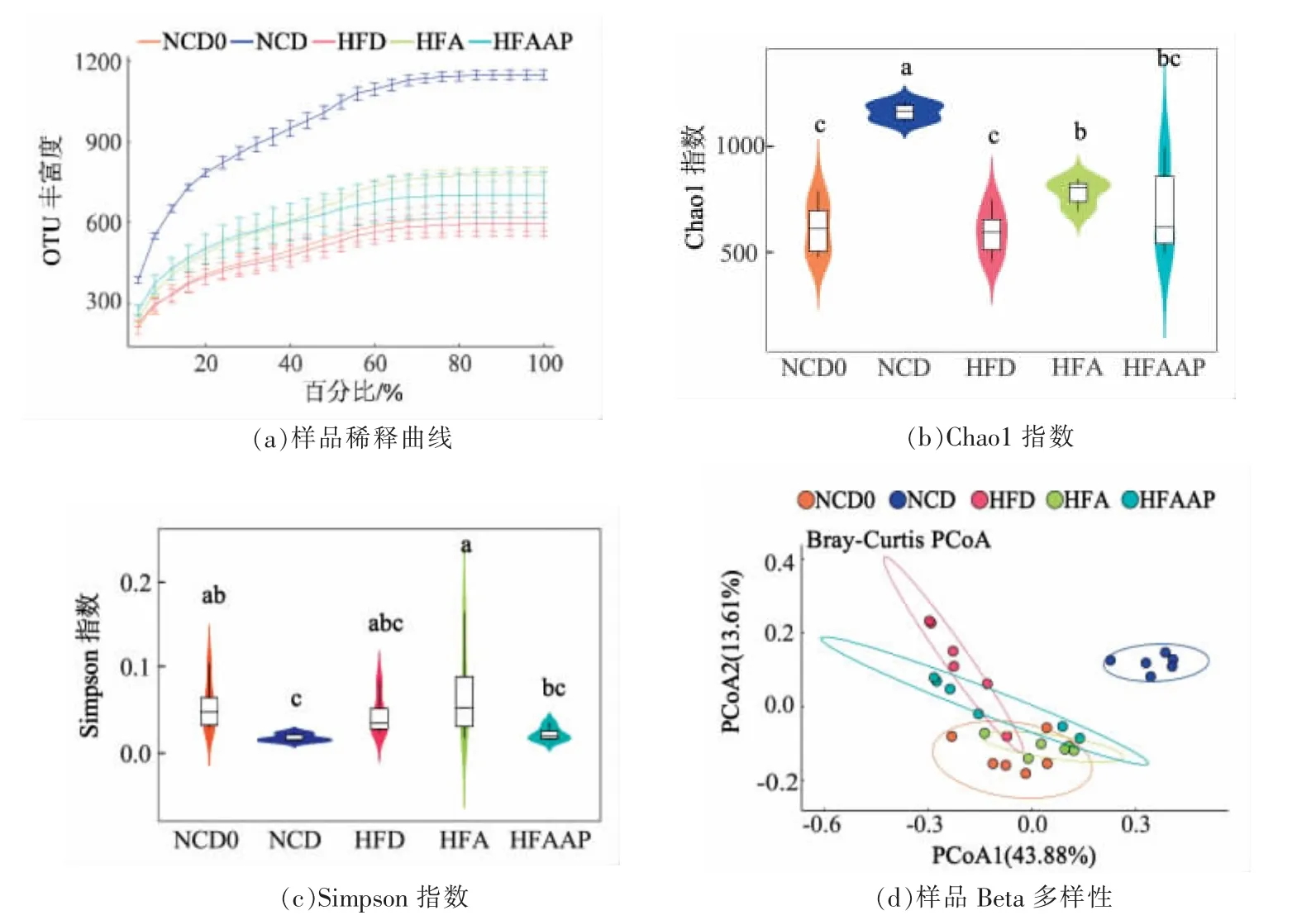
图5 黑木耳及黑木耳多糖对高脂饮食大鼠肠道菌群丰度及多样性的影响Fig.5 Effects of Auricularia auricula and Auricularia auricula polysaccharide on intestinal flora abundance and diversity in high-fat diet rats
将OTU 的代表序列与微生物参考数据库进行比对可得到每个OTU 对应的物种分类信息,对各组样本在门分类学水平上作物种分布图(图6a),同时对各个样本的物种丰度进行聚类分析,以比较主要肠道菌群的相似性和差异性,结果见图6b。由图6a 可以看出,拟杆菌门、厚壁菌门和变形菌门为各组大鼠肠道菌群内含量最多的3 个菌门。与NCD 组相比,HFD 组大鼠的拟杆菌门的相对丰度升高,厚壁菌门的相对丰度降低;与HFD组相比,HFAAP 组大鼠的厚壁菌门的相对丰度升高,HFA 组和HFAAP 组大鼠的拟杆菌门的相对丰度降低。热图分析中的颜色梯度由蓝色到红色表示相对丰度由低到高。热图分析结果发现,HFD组拟杆菌门丰度较高,黑木耳及黑木耳多糖干预的大鼠放线菌门、疣微菌门等丰度有所提升。接着,对各组样本在属水平下的物种信息进行统计,绘制丰度排名前13 的菌属及低丰度菌属堆叠柱状图,结果见图6c。可以看出,与NCD 组相比,高脂饮食组大鼠粪便中的普雷沃菌属相对丰度显著升高;与HFD 组相比,HFA 组及HFAAP 组大鼠的拟杆菌属、萨特氏菌属及副拟杆菌属相对丰度升高,普雷沃菌属、罗氏菌属和布劳特氏菌属相对丰度降低。
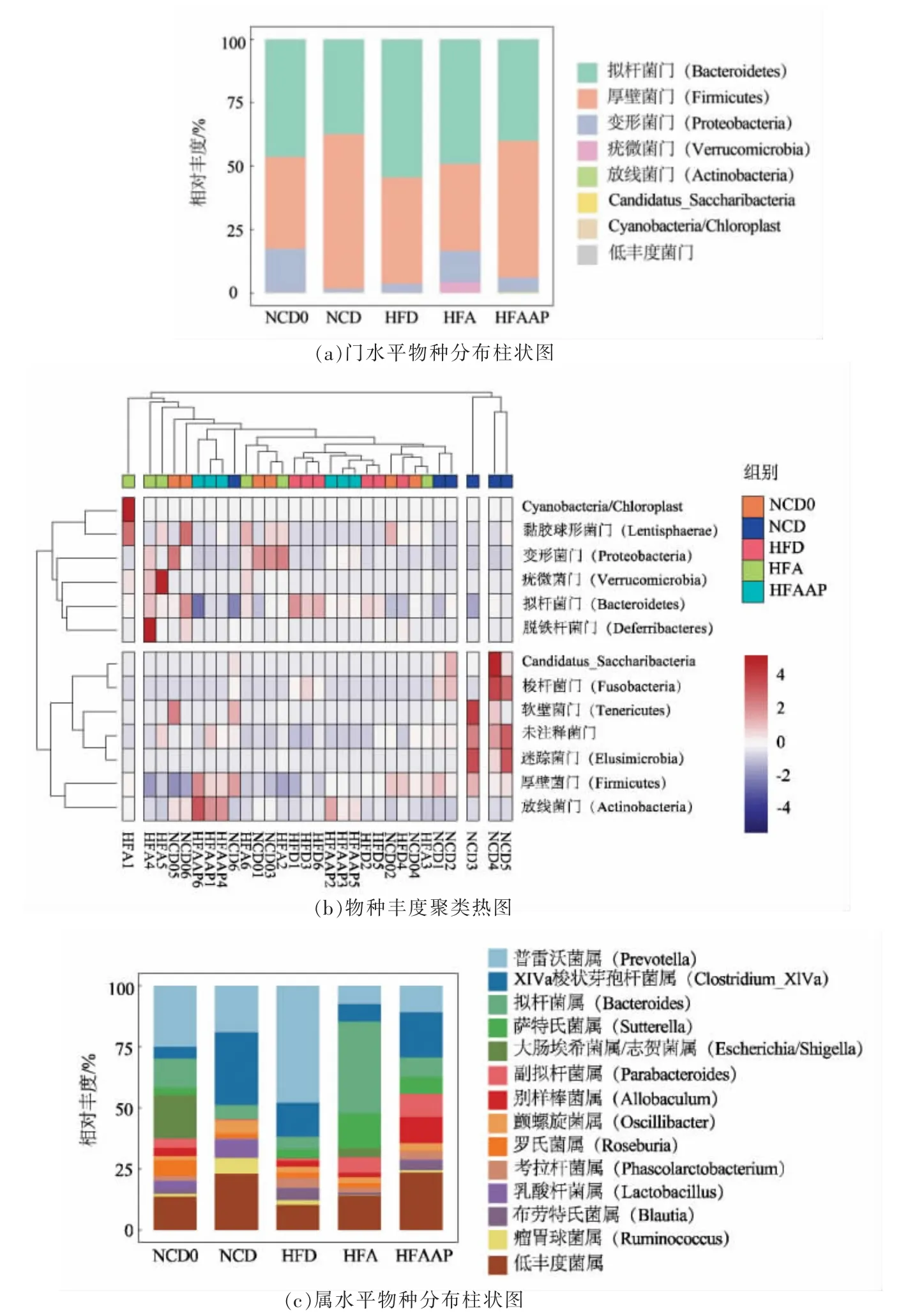
图6 黑木耳及黑木耳多糖对高脂饮食大鼠肠道菌群结构的影响Fig.6 Effects of Auricularia auricula and Auricularia auricula polysaccharides on the structure of intestinal flora in high-fat diet rats
为了明确造成组间差异的关键物种,采用火山图对组间物种进行两两比较,结果见图7。从图中可以看出,与NCD 组相比,HFD 组大鼠纺锤链杆属和布劳特氏菌属丰度显著上调,并未发现显著下调的菌属;相比于HFD 组大鼠,HFA 组的普雷沃菌属、布劳特氏菌属及属水平未注释的瘤胃球菌科下的菌属等显著下调,拟杆菌属、副拟杆菌属和属水平未注释的紫红球菌科下的菌属显著上调,HFAAP 组的非消化糖杆菌属和副拟杆菌属显著上调,普雷沃菌属显著下调;HFA 组相比于HFAAP 组拟杆菌属和属水平未注释的紫红球菌科下的菌属显著上调,非消化糖杆菌属显著下调。
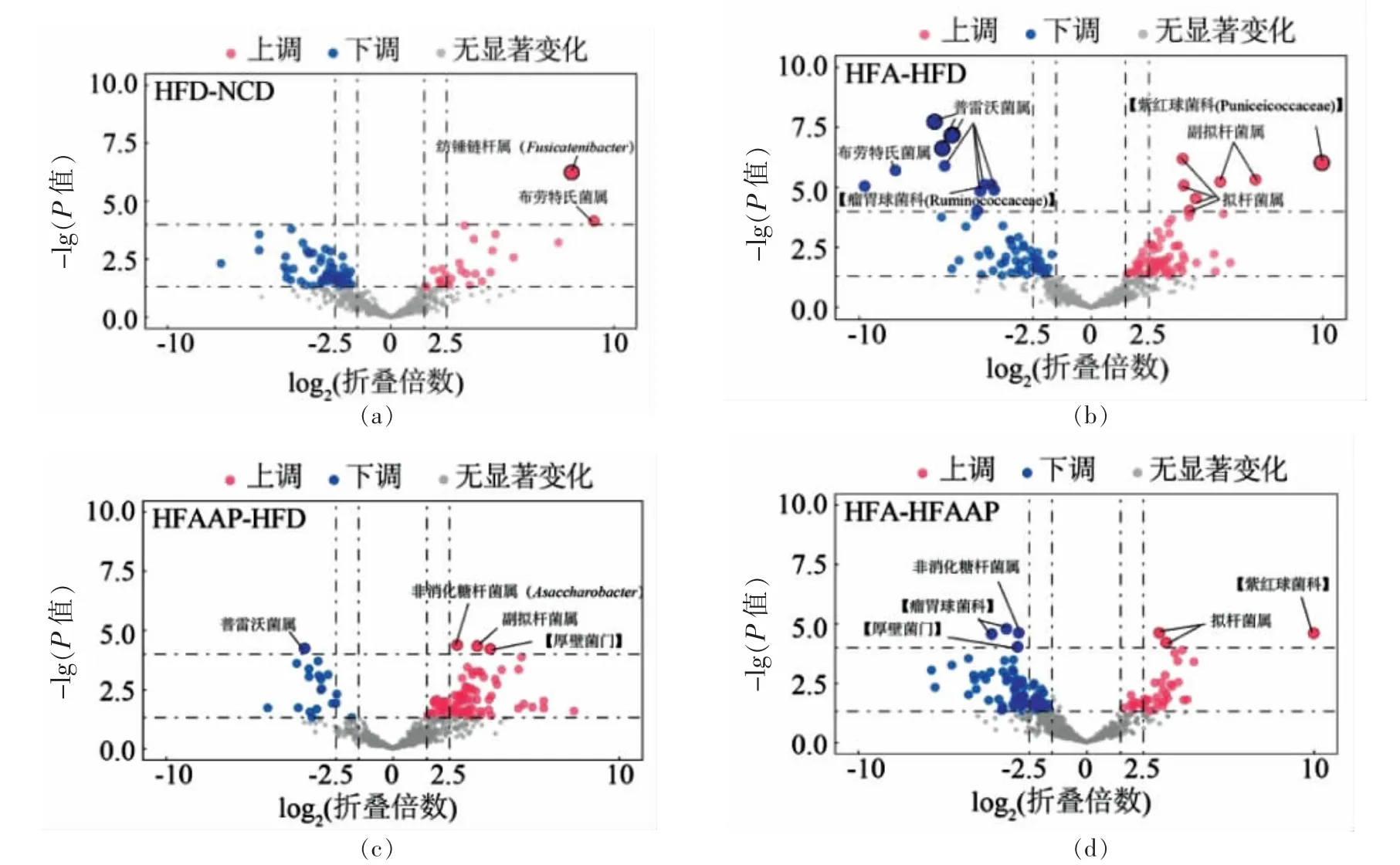
图7 差异物种火山图Fig.7 Volcanic map of different genus
最后,为了进一步阐释肠道菌群与其代谢物之间的相关性,以相关性及显著性P值作为筛选条件来评判短链脂肪酸与菌群属水平(相对丰度前20 的菌属)的相关关系(图8),图中有颜色的点均为P值小于0.05 时的相关性大小。从图中可以看出,短链脂肪酸含量与副拟杆菌属、萨特氏菌属及拟杆菌属存在显著正相关,与乳酸杆菌属及普雷沃菌属呈负相关。
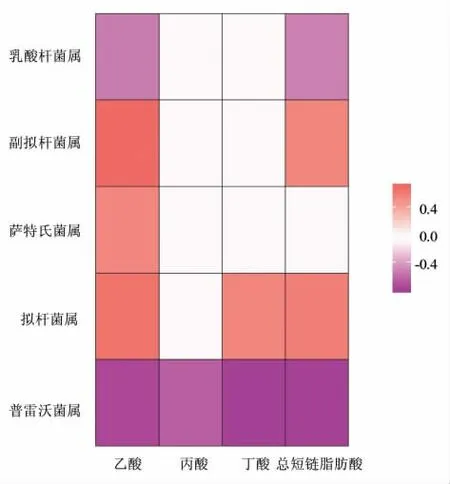
图8 肠道菌群与其代谢物相关性聚类热图Fig.8 Cluster heat map of intestinal flora and its metabolites
3 讨论
本研究发现高脂饮食能够引起大鼠肥胖,同时还会引起血清总胆固醇和高密度脂蛋白胆固醇含量升高,低密度脂蛋白胆固醇含量降低,即血脂代谢异常,造成高脂血症。肝脏是脂类代谢的关键场所,人体内血脂的相对恒定主要靠肝细胞调节,肝细胞能够将胆固醇转化成胆汁酸,并分泌胆汁,促进脂肪在肠道的消化和吸收[29]。当肝脏功能受损时,胆汁的生成和排泄出现障碍,体内的血脂代谢也会发生异常。然而,膳食纤维能够减少肠道对胆固醇的吸收从而降低血清总胆固醇和低密度脂蛋白胆固醇的含量[6-7],黑木耳富含丰富的蛋白质、粗纤维以及大量的生物活性物质如黑木耳多糖、多酚类物质等。如本试验所述,黑木耳能够明显抑制高脂饮食所导致的体重增长,从而预防肥胖,且黑木耳和黑木耳多糖能够降低高脂饮食大鼠的肝脂肪堆积,并可能通过改善其肝脏功能途径发挥预防血脂异常的作用,从而促进肝脏代谢。膳食纤维能够刺激肠胃蠕动,同时还能在肠道中发酵,生成短链脂肪酸等代谢产物,从而促进机体代谢[26]。因此,黑木耳及其多糖的降血脂作用可能与黑木耳中含有的膳食纤维、多酚类物质等功能性成分密切相关。
尽管机体的微生物群落组成存在很大的个体差异,但主要由放线菌门、拟杆菌门和厚壁菌门组成,饮食组成对肠道菌群有重要影响,这些细菌的相对比例随饮食依赖性变化。饮食对机体状况的改善离不开肠道菌群的介导。因此,在饮食切换后的几天,便可以检测到粪便菌群的变化[30-32]。Wu等[33]研究发现,与脂肪摄入呈正相关但与纤维摄入呈负相关的细菌门主要是拟杆菌门和放线菌门,而厚壁菌门和变形菌门则显示相反的关联。在本研究中发现高脂饮食大鼠的粪便中拟杆菌门丰度升高而厚壁菌门丰度降低,而黑木耳及其多糖的干预在一定程度上逆转了高脂饮食中优势菌群丰度的分布,说明拟杆菌门和厚壁菌门的丰度比例在脂肪的代谢中发挥重要作用,黑木耳及黑木耳多糖能够预防脂肪摄入造成的菌群结构的改变。在属水平上,本文的差异物种火山图显示高脂饮食仅显著提高了纺锤链杆属和布劳特氏菌属的丰度,说明高脂饮食是通过富集相应的菌属以改变群落结构。Wang 等[34]也同样发现高脂血症患者的粪便样本中纺锤链杆属和布劳特氏菌属明显增加。Shen 等[35]在非酒精性脂肪性肝炎的患者中发现布劳特氏菌属的丰度显著高于健康受试者,且其丰度的增加响应于高脂饮食的摄入[36]。本文中食用黑木耳的大鼠显著降低了布劳特氏菌属的丰度,说明高脂饮食造成的大鼠肝重及肝指数上升,肝脏形态结构的损伤可能与布劳特氏菌属丰度的升高有关,黑木耳的干预降低了其丰度从而改善了肝脏受损情况。
富含膳食纤维的饮食可增加肠道放线菌门和疣微菌门的相对丰度[37]。本文的物种丰度聚类热图显示黑木耳及黑木耳多糖的干预使高脂饮食大鼠粪便菌群中放线菌门和疣微菌门丰度提高,根据火山图推测可能是提高了非消化糖杆菌属和紫红球菌科下菌属的丰度。非消化糖杆菌属已被发现在慢性乙型肝炎患者中显著减少[38],紫红球菌科在帕金森患者的粪便菌群中显著减少[39]。本文中黑木耳多糖的摄入使高脂饮食大鼠粪便菌群中非消化糖杆菌属丰度显著提升,同时其丰度也显著高于HFA 组大鼠,说明黑木耳多糖可能是通过对非消化糖杆菌属的富集在一定程度上改善了肝脏损伤,确保脂质在肝脏的正常代谢以预防高脂血症。另一方面,黑木耳干预的高脂饮食大鼠有较高丰度的紫红球菌科,表明黑木耳中除多糖外的其它生物活性物质可能还对机体健康的其它方面起到积极作用,越来越多的数据证明黑木耳还具有降血糖[40-42]、抗血栓[43-44]、调节免疫系统[45-46]等益处。除此之外,与HFD 和HFAAP 组相比,HFA 组大鼠肠道中拟杆菌属丰度升高,瘤胃球菌科丰度降低,而二者在HFD 和HFAAP 组间无差异。拟杆菌属为肠道中的共生菌,为机体提供必需的营养;瘤胃球菌科在高脂饮食诱导的肥胖大鼠的肠道中富集,复合多糖的摄入及运动的干预后使肥胖大鼠的瘤胃球菌科丰度显著降低[47],在小鼠体内也同样发现高脂饮食所造成的瘤胃球菌科丰度的增加[48-49]。说明黑木耳中除黑木耳多糖作用外,其它生物活性物质还可能通过富集拟杆菌属,降低瘤胃球菌科丰度来抵抗高脂饮食对血脂代谢的影响,使得HFA 组在血清指标以及大鼠体重控制等方面均有更好的表现。本研究结果还发现黑木耳及黑木耳多糖的干预均显著提高了副拟杆菌属丰度、降低了普雷沃菌属的丰度。有研究发现,食用纤维素的大鼠副拟杆菌属丰度较高[37],副拟杆菌属的丰度与人类体重指数(Body Mass Index,BMI)有显著的负相关性[50]。小鼠研究则表明了普雷沃菌属介导黏膜炎症,可以通过增加免疫细胞和各种基质细胞中炎性介质的释放来诱导疾病和炎症特征[51]。因此,黑木耳及黑木耳多糖的干预还可能通过上调代谢有益菌副拟杆菌属的丰度,下调促炎菌普雷沃菌属的丰度,起到对高脂饮食大鼠高脂血症的预防作用。
黑木耳中富含的膳食纤维可以作为肠道代谢底物,在盲肠内产酸菌的发酵下生成短链脂肪酸,包括乙酸、丙酸和丁酸。乙酸是细菌为宿主提供能量的主要来源;丙酸能够抑制肝脏内胆固醇和脂肪酸的合成[52];丁酸是结肠上皮细胞的主要能量来源[53]。短链脂肪酸不仅能增强肠道上皮屏障功能,对降低体重及促进血脂代谢产生重要作用[54],而且可使肠道内具有疾病调节功能的细菌富集从而影响机体代谢[24]。本文在对短链脂肪酸及菌群变化相关性的探讨中发现副拟杆菌属、萨特氏菌属和拟杆菌属与短链脂肪酸有较强的正相关关系,与乳酸杆菌属及普雷沃菌属呈负相关;在属水平物种图中发现高脂饮食导致大鼠粪便菌群中普雷沃菌属丰度升高,黑木耳及黑木耳多糖的干预富集了副拟杆菌属、萨特氏菌属和拟杆菌属。研究发现,食用纤维素的大鼠肠道中副拟杆菌属丰度较高且其糖酵解产物为有益的乙酸和琥珀酸[37,55];拟杆菌属是乙酸、丁酸及琥珀酸盐的生产者[56-57]。本文研究发现黑木耳和黑木耳多糖干预均能够增加盲肠内的短链脂肪酸的含量,后者对抑制高脂饮食大鼠的体重增加及促进血脂代谢都具有重要的作用,因此猜测黑木耳及其多糖可能通过增加富集产生短链脂肪酸的有益菌来提高盲肠中短链脂肪酸的含量以预防高脂饮食大鼠体重增加、促进血脂代谢。
综上,黑木耳及其多糖可能通过改善高脂饮食大鼠的肝脏功能、增加短链脂肪酸含量以及调节肠道菌群结构等途径调节血脂水平,对高脂血症的发生起到一定的预防作用,且黑木耳对肝脏功能的改善、短链脂肪酸的提高及菌群结构的改善更为显著。
4 结论
本研究表明:黑木耳能够显著预防大鼠高脂饮食引起的血清TC、LDL-C 含量升高,HDL-C 含量降低,而黑木耳多糖显著下调LDL-C 含量,对HDL-C 有上调趋势,黑木耳对血清TC 水平的调节作用比黑木耳多糖更明显,降血脂效果更佳;黑木耳及黑木耳多糖对肝脏代谢都具有一定的促进作用,且均显著增加了盲肠内的短链脂肪酸含量;肠道菌群的高通量测序分析表明黑木耳及黑木耳多糖都能够增加高脂饮食大鼠的肠道菌群的多样性,并引起肠道菌群结构发生变化。高脂饮食使与脂肪摄入呈正相关的拟杆菌门丰度提高,同时也提高了与肝炎有关的纺锤链杆属和布劳特氏菌属的丰度,造成肝指数上升,肝脏结构损伤;黑木耳及其多糖的干预使大鼠粪便菌群中非消化糖杆菌属或紫红球菌科丰度提升,缓解高脂饮食摄入造成的肝炎及其它疾病,下调普雷沃菌属以缓解高脂饮食带来的炎症;黑木耳同时也调节了与肥胖有关的瘤胃球菌科的丰度,说明黑木耳中除黑木耳多糖外的其它生物活性物质主要是通过降低瘤胃球菌科来更显著地预防高脂血症,同时在大鼠体重的控制上发挥一定的作用。黑木耳及其多糖可能通过上调副拟杆菌属和拟杆菌属等的丰度来产生对机体有益的短链脂肪酸以促进血脂代谢,预防高脂血症。因此猜测黑木耳及其多糖可能通过调节肠道菌群结构,增加短链脂肪酸含量,并进一步改善高脂饮食大鼠的肝脏功能等途径发挥降血脂作用,且黑木耳降血脂的作用更显著。本研究结果有望更好地解释黑木耳及黑木耳多糖的降血脂作用,并为饮食干预调节肠道菌群和改善机体健康提供理论基础。
