软坚散结方对肾透明细胞癌细胞裸鼠移植瘤生长的影响
2021-10-19刘丽坤王晞星
高 宇,王 栋,刘丽坤,王晞星
(山西省中医院,山西省中医药研究院,山西 太原030012)
肾细胞癌(renal cell carcinoma,RCC)是恶性度高且致命的泌尿系恶性肿瘤,其发病率和死亡率呈逐年上升趋势,全球每年新增病例约33.8万例,死亡有14.24万人[1]。局限性RCC的5年存活率为65%,而转移性RCC 5年存活率降至10%~20%[2],目前我国大部分RCC患者病理类型为肾透明细胞癌(clear cell renal cell carcinoma,ccRCC),占比70%~75%[3]。手术切除是其根治的唯一手段,但术后复发率达50%[4],靶向及免疫治疗等药物目前在临床广泛使用,有效率较高,但因药品昂贵患者经济负担重,药物不良反应较大,易产生耐药,这些问题都严重影响了患者的临床疗效及生活质量[5]。而中医药治疗肾癌具有多靶点抑瘤、增效减毒、提高患者生存质量、延长生存期等优势。肾癌归属于中医学“尿血”“肾积”“腰痛”等病范畴,前期研究认为痰瘀毒互结是肾癌发生发展的关键因素,活血解毒、软坚散结法为肾癌治疗的重要法则[6],软坚散结方为肾癌有效临床治疗药物。
Notch信号在肾脏发育中起关键作用[7],Notch1过表达诱导肾小管上皮细胞异常增殖[8],异常Notch表达可能直接导致肿瘤的发生。在ccRCC组织样本中,发现Notch通路被广泛激活[8],但Notch信号对ccRCC的具体作用尚不明确。课题组既往研究已证实软坚散结方可在体外抑制7860细胞增殖,诱导凋亡[9]。本研究拟通过建立裸鼠ccRCC移植瘤模型,观察软坚散结方对肾透明细胞癌荷瘤裸鼠的体内抑瘤作用,检测瘤体组织中Notch信号通路及相关凋亡蛋白、基因的表达,探究软坚散结方抗ccRCC的作用靶点及机制,为开发低毒高效的抗肾癌药物提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 动物及细胞株4~6周龄SPF级BALB/c雄性裸鼠15只,体质量(20±2)g,购于北京维通利华,合格证号:SCXK(京)2019-0009。人肾透明细胞癌7860细胞株购于中科院上海生命科学院细胞库。
1.1.2 药物与试剂 软坚散结胶囊(山西省中医院内部制剂,药物组成:猫爪草、山慈菇、莪术、枸橘、夏枯草、浙贝母、壁虎、鸡内金、醋山甲、牡蛎,批号:AZ20090347);Notch通路抑制剂DAPT(5 mg/支,Med Chem Express,批号:GSI-IX);RPMI1640培养液(Corning公司,批号:05118006)、胎牛血清(Gibco公司,批号:10270106)、0.25%胰蛋白酶(Hyclone公司,批号:SH30042.01B)、链霉素青霉素双抗(杭州四季青公司,批号:2018050052)、PBS缓冲溶液(Hyclone公司,批号:NZG1189);一抗兔抗人Notch1(CST,20 μL,批号:VAL1744)、一抗兔抗人NICD(Millipore,100 μL,批号:07-1232)、一抗兔抗人Bax(Abcam公司,10 μL,批号:ab32503)、一抗鼠抗人Bcl-2(Abcam公司,10 μL,批号:ab196495)、二抗(Abcam公司,批号:AR1017)、苏木素-伊红(HE)试剂盒(上海碧云天生物技术有限公司,批号:C0105S)、DAB显色液(上海碧云天生物技术有限公司,批号:P0203)、RIPA蛋白裂解液(上海碧云天生物技术有限公司,批号:AR0102);Notch1、Bax、Bcl-2引物序列由上海生工生物工程股份有限公司合成;免疫组化试剂盒(批号:18001)、RNA抽提试剂盒(批号:B0004DP),购自南京Biomiga公司。
1.1.3 实验仪器 恒温细胞培养箱(美国赛默飞世尔科技公司,型号:Cytoperm 2),低温台式离心机(美国Thermo公司,型号:H1650-W/H1650W);倒置荧光生物显微镜(日本奥林巴斯公司,型号:CX23);实时荧光定量PCR仪(美国Bio-Rad公司,型号:7900);石蜡包埋机(德国Leica公司,型号:EG 1150H);Excelsior全自动全封闭脱水机(德国Leica公司,型号:TP 1020);F325旋转石蜡切片机(德国Leica公司,型号:EG 1150C)。
1.2 实验方法
1.2.1 造模 参照文献[1],裸鼠腋下皮肤接种对数生长期7860细胞悬液,0.1 mL/只(1×108个/mL),隔日观察肿瘤生长情况及小鼠一般情况。
1.2.2 分组与给药 选择15只BALB/c裸鼠,适应环境7 d后,随机编号,分为模型组、软坚散结方组、DAPT组3组,每组5只。参照《中药药理研究方法学》[11]换算裸鼠等效剂量为成人临床用量的15倍,以此设定软坚散结方组给药剂量为46.8 g/kg,予灌胃给药,3 d停1 d,DAPT组按5 mg/kg配DMSO-PBS溶液腹腔注射,模型组予等量的DMSO-PBS腹腔注射,各组腹腔给药,1次/4 d。
1.2.3 计算瘤体积及抑瘤率 给药干预4周后,处死裸鼠,剥离肿瘤组织,滤纸吸干血水后称重,并按公式计算抑瘤率。抑瘤率(%)=(1-实验组平均瘤重/模型组平均瘤重)×100%。
1.2.4 HE染色观察肿瘤组织形态 剥取的瘤体经4%多聚甲醛固定、脱水、石蜡包埋,4 μm连续切片,HE染色、封片后在光学显微镜下观察,并拍照保存。
1.2.5 免疫组化检测Notch1、NICD、Bcl2、Bax蛋白的表达 石蜡切片常规脱蜡、水化,置0.05 M柠檬酸缓冲液中微波加热(95℃10 min)激活抗原;0.3%过氧化氢甲醇溶液室温孵育20 min以阻断内源性过氧化物酶活性,加入一抗4℃过夜孵育;加二抗,DAB显色,苏木素轻度复染,脱水、透明,中性树脂封片,镜检;同时用PBS代替一抗染色作阴性对照。染色的切片在显微镜下有棕黄色颗粒沉着,从每张免疫组化染色切片中随机选取5个视野,输入病理图像分析系统。按阳性细胞百分比及阳性细胞染色强弱两个方面进行评分。①阳性细胞百分比:无阳性细胞=0;阳性细胞占1%~10%=1;阳性细胞占11%~50%=2;阳性细胞占51%~80%=3;阳性细胞占81%~100%=4。②阳性细胞染色强弱:阴性=0;弱阳性=1;中度阳性=2;强阳性=3。①②两项乘积为该样本的IHS。IHS分级:0分为(-);1~4分为(+);5~8分为(++);9~12分为(+++)。
1.2.6 RT-PCR检测Notch1、Bcl-2、Bax mRNA表达 用TrIzol提取各组组织样本总RNA,琼脂糖凝胶电泳分离,逆转录合成cDNA反应模板,按各基因引物设计PCR扩增,检测Notch1、Bcl-2、Bax mRNA表达水平。引物均采用Primer网站设计,Notch引物序列:F:5′-GTGCTGGAAGTATTTTAGCGAC-3′,R:5′-GTCCTTGCAGTACTGGTCATAC-3′,Bcl-2引物序列:F:5′-TGGGATGCCTTTGTGGAACTAT-3′,R:5′-GCTGATTTGACCATTTGCCTGA-3′,Bax引物序列:F:5′-GAGCGAGTGTCTCCGGCGAATT-3′,R:5′-GCCACAAAGATGGTCACTGTCTGC-3′。
1.3 统计学方法
运用SPSS 21.0软件和GraphPad Prism7软件对数据进行处理和分析进行统计分析,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差(ANVOA)分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组裸鼠一般状况及肿瘤生长情况比较
7860细胞接种后约5 d,皮下可见绿豆大小结节,质韧,活动度差,与皮下组织粘连,后期逐渐突出体表,形状不规则,部分瘤体出现破溃,成瘤率100%。实验期间,各组裸鼠体质量逐渐增加,组间比较差异无统计学意义。模型组和DAPT组后期随着肿瘤增大饮食及活动明显减少,软坚散结方组食水及活动基本正常。软坚散结方组和DAPT组均对裸鼠皮下移植瘤的生长有抑制作用,与模型组比较,平均瘤体积明显减小,瘤质量明显降低(P<0.05)。软坚散结方组、DAPT组抑瘤率分别为46.26%和24.83%。结果见表1,图1。
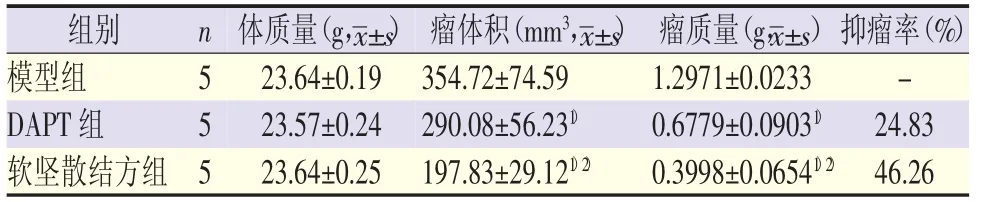
表1 各组体质量、瘤体积、瘤体质量比较

图1 各组裸鼠及移植瘤生长情况
2.2 各组瘤体组织病理学表现
模型组见癌细胞生长旺盛,体积较大且排列紊乱,形态不一,呈立方形、楔形、片状等;胞浆呈透明状;细胞核大且深染,呈圆形、卵圆形或怪异型;间质有丰富的毛细血管。软坚散结方组、DAPT组凋亡细胞增多,可见凋亡细胞与邻近细胞分离,细胞核浓缩甚至消失,胞质呈明显嗜酸性,凋亡小体可见。结果见图2。
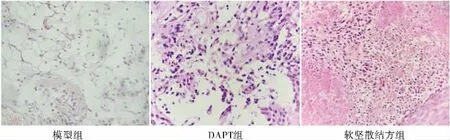
图2 各组裸鼠瘤体组织形态学表现(HE,×200)
2.3 免疫组化检测各组Notch1、NICD、Bcl-2、Bax蛋白表达
在7860细胞移植瘤中,Notch1、NICD、Bcl-2、Bax蛋白阳性表达呈棕黄色或黄色着色,其中Notch-1、Bcl-2、Bax阳性表达为胞质染色,而NICD表达主要位于细胞胞核,各组阳性细胞百分率和显色强度均有差异性(图3)。与模型组比较,软坚散结方组、DAPT组Notch1、NICD、Bcl-2蛋白阳性表达明显减少(P<0.05),Bax蛋白阳性率明显增高(P<0.05)。与DAPT组相比,软坚散结方组NICD、Bcl-2阳性率明显下降,Bax阳性率明显增高(P<0.05)。结果见表2。

图3 各组裸鼠瘤体组织Notch1,NICD,Bax、Bcl-2蛋白表达的影响(×40)
表2 各组瘤体组织中Notch1、NICD、Bcl-2、Bax蛋白表达 ±s()

表2 各组瘤体组织中Notch1、NICD、Bcl-2、Bax蛋白表达 ±s()
注:与模型组比较,1)P<0.05;与DAPT组比较,2)P<0.05
组别 Notch1 NICD Bcl-2 Bax模型组 3.45±0.38 3.26±0.34 4.67±0.67 1.33±0.33 DAPT组 1.4±0.171)1.79±0.321)2.33±0.331)1.67±0.341)软坚散结方组1.04±0.231)1.13±0.231)2)0.33±0.341)2)8.00±1.001)2)
2.4 各组Notch1、Bcl-2、Bax mRNA表达情况
7860裸鼠移植瘤组织各基因表达情况,与模型组相比,DAPT组、软坚散结方组Notch1、Bcl-2表达显著降低(P<0.05),Bax表达显著升高(P<0.05);与DAPT组比较,软坚散结方组Notch1 mRNA表达无明显差异;Bcl-2、Bax mRNA表达差异显著。结果见图4。

图4 各组裸鼠Notch1、Bcl-2、Bax mRNA表达
3 讨论
中药是肿瘤治疗重要手段之一,临床疗效确切,特别是在减毒增效,预防复发转移,防治并发症,逆转多药耐药等方面发挥了关键作用,中药复方抗肿瘤的机制也成为学术界研究热点。恶性肿瘤属中医癥瘕、积聚范畴,痰瘀毒互结是其发生发展的主要病机。软坚散结法属于八法之一的消法,广泛应用于临床肿瘤的治疗,疗效确切[12]。黄洋等[13]研究表明,软坚扶正汤联合DP化疗方案(多西他赛联合顺铂),可有效改善患者临床症状,并提高临床疗效。基础研究表明,龙葵提取物龙葵多糖可通过调控Caspase-3和Bcl-2抑制荷瘤小鼠肿瘤生长[14];夏枯草通过调控激活子蛋白-1(activator protein 1,AP-1)、核因子(nuclear factor κB,NF-κB)、P38、血管内皮生长因子(vascular endothelical grouth factor,VEGF)、基质金属蛋白酶9(matrix metallo proteinase 9,MMP-9)等信号转导抑制肝细胞癌转移[15]。白花蛇舌草乙醇提取物能够通过阻断丝/苏氨酸激酶(serine/threonine protein kinase,Akt)、丝裂原活化蛋白激酶(mitogen activated mprotein kinase,MAPK)、转 录 激 活 因 子3(transcription activator 3,STAT3)等信号通路诱导大肠癌细胞凋亡,抑制细胞增殖[16]。山西省中医院制剂软坚散结胶囊,由猫爪草、山慈菇、莪术、夏枯草、浙贝母等药物组成,本研究证明,软坚散结方对肾透明细胞癌荷瘤鼠移植瘤具有明显的生长抑制作用,且荷瘤鼠对软坚散结方具有良好的耐受性,未见明显不适及不良反应,能下调抗凋亡因子Bcl-2,上调促凋亡因子Bax蛋白及基因的表达,进一步明确软坚散结方通过凋亡途径抑制肾透明细胞癌生长。
Notch信号通路具有调节细胞增殖、分化和凋亡等作用,Notch缺乏或减少会导致肾脏发育异常并直接影响肾脏疾病的发生、发展及转归。Notch通路与肿瘤的发生发展关系密切,已有研究表明,它是T细胞急性淋巴细胞白血病(T-ALL)和头颈癌的致癌途径[17-19]。Notch信号独立于VHL/HIF通路,在肾细胞癌中发挥着重要作用[20],组织芯片检测和TCGA数据显示,肾透明细胞癌组织中Notch表达明显增加[8],Notch1基因过表达导致肾脏细胞过度增殖,同时Notch1配体Jagged1的高表达降低了肾癌患者总生存期和无病生存期[21]。敲除Notch信号可下调Myc和Cyclin A1的表达阻断ccRCC细胞生长周期,抑制增殖[8];Notch抑制剂处理后的裸鼠可以有效抑制肾癌细胞移植瘤生长[25]。团队研究发现,软坚散结方促进肾透明细胞癌细胞系7860凋亡,其机制是通过阻断Notch1及凋亡信号通路[22]。为此,本研究在前期基础上,进一步通过体内实验证明软坚散结方通过阻断Notch信号(DAPT组)可抑制7860细胞裸鼠移植瘤生长,并下调Bcl-2,上调Bax等凋亡因子;软坚散结方组与DAPT组比较,具有更明显的抑瘤作用,下调Notch1表达与DAPT作用相当,与DAPT组相比,NICD、Bcl-2显著下降,Bax表达显著上升,说明软坚散结方通过抑制Notch通路调控相关凋亡因子抑制肾透明细胞癌癌组织生长,这与既往在体、离体实验结论一致[8,20]。其中NICD为Notch剪切后的胞内段,并进入细胞核与转录因子CSL结合形成NICD/CSL复合体,激活下游通路,而本研究中软坚散结方对NICD有更强的调控作用,推测软坚散结方可能阻滞了Notch1的切割,或在核内阻断NICD/CSL复合体的形成,或软坚散结方协同阻滞Notch相关交叉通路共同诱导凋亡。
综上所述,软坚散结方可有效抑制移植瘤肿瘤生长,其作用机制可能与靶向阻断Notch信号表达,从而进一步诱导凋亡有关。值得注意的是,软坚散结方相比DAPT阻断剂具有更明显抑瘤效果及促凋亡作用,这可能是中药多组分多通路多靶点协同调控的结果。本研究涉及的蛋白表达较少,且未涉及交叉通路,软坚散结方对裸鼠肾透明细胞癌的作用机制值得进一步研究。
