人源性胃癌肿瘤组织移植免疫模型的建立与评价
2021-10-19朱艳阳张秋玉
陈 玲,刘 英,朱艳阳,胡 莉,张秋玉,2
胃癌是我国恶性肿瘤中危害最为严重的疾病之一。2020年,中国胃癌新发病例数48万,死亡病例数37万,发病人数和死亡人数分别占全球胃癌发病人数和死亡人数的44%和48%[1]。传统的治疗胃癌的方案包括放化疗、手术及靶向治疗等。目前,已有多项免疫治疗研究在胃癌治疗中开展[2-3]。2020年3月,程序性死亡受体(programed death-1, PD-1)阻断剂纳武利尤单抗在中国获批用于治疗晚期胃癌,标志着免疫治疗在胃癌中取得重要进展。临床Ⅲ期试验显示:PD-1抗体使得患者1 a生存率提高至27.3%,是对照组的2倍[4]。如何进一步提高PD-1抗体等免疫治疗方案的受益患者比例是肿瘤免疫学研究领域的热点问题。构建反映胃癌临床特征的实验动物模型,将有助于推进免疫治疗方案在胃癌治疗中的转化应用,提高胃癌的免疫治疗效果。
患者来源的肿瘤组织异种移植(patient derived xenograft, PDX)模型是通过将患者新鲜的肿瘤组织直接移植到免疫缺陷小鼠体内而建立的肿瘤模型[5-6]。该模型能更好地模拟人肿瘤组织的生长情况和微环境,并可在组织病理学、分子生物学和基因水平上保留原代肿瘤的大部分特点。因其具有较好的临床疗效预测性,被广泛应用于肿瘤基础研究及肿瘤药物临床前药效评估[7-9]。然而,随着免疫治疗的迅速发展,如何在动物模型中重建人体免疫微环境成为亟待解决的问题。通常情况下,肿瘤组织中天然存在浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL),是免疫微环境的主要组成部分,并在清除肿瘤细胞中发挥重要作用[10]。在异种移植过程中,这些TIL能否随肿瘤一起进入小鼠体内及在异体中的存活和状态如何,相关研究仍较少。
本研究旨在建立胃癌免疫PDX模型,分析人源TIL在肿瘤组织及小鼠外周血的存活情况,为提高抗肿瘤免疫药物治疗胃癌的疗效预测提供动物模型依据。
1 材料与方法
1.1 材料
1.1.1 动物与临床样本 NCG(NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)免疫缺陷小鼠,雌性,SPF级,6~8 周龄,体质量20~24 g[江苏集萃药康生物科技有限公司,许可证号:SCXK(苏)2018-0008],饲养于福建医科大学实验动物中心SPF屏障系统,并在实验动物管理与使用指南下进行实验(动物伦理审查号为2017-035)。选取2017年1—12月福建医科大学附属第一医院胃肠外科手术切除并经病理证实的新鲜胃癌组织样本3 例。术前均未接受任何治疗。本研究经医学伦理委员会批准,所有患者均自愿参加并签署知情同意书{伦理审查号为[2017]福医伦理审字第(27)号(2017vNO.27)}。
1.1.2 试剂 流式细胞术检测抗体FITC标记的抗小鼠CD14、PE标记的抗人CD3及PerCPcy5.5标记的抗人CD8(美国Thermo Fisher Scientific公司);免疫组织化学抗体羊抗人CD3(美国Abcam公司);免疫组织化学染色试剂盒(福州迈新生物技术开发有限公司)。
1.2 方法
1.2.1 人胃癌肿瘤组织的移植与传代 新鲜肿瘤组织在离体2 h内接种于NCG小鼠。初次移植的具体步骤如下:将肿瘤块分成两份,1份用于组织化学包埋和冰冻样本保存;另1份平均切成多块5 mm×5 mm×5 mm的正方小块。NCG小鼠下背部中间纵向切口1 cm,用无菌棉球棒从切口伸入,由下而上推至上背部,为肿瘤块的植入疏通皮下空间。将切好的肿瘤块从切口移至小鼠上背部,两侧各移植1块。缝合切口。待小鼠苏醒后放入笼内并持续监测其肿瘤生长情况。再次移植传代时,CO2窒息法处死荷瘤小鼠,无菌条件下取出皮下肿瘤,并切成3 mm×3 mm×3 mm的小块。按上述方法接种至新的NCG小鼠皮下,此即第二代移植肿瘤(P1),移植前保存部分第一代肿瘤组织(P0)。
1.2.2 苏木精-伊红(hematoxylin-eosin,H-E)及免疫组织化学染色 取移植前(primary)、移植后5周(P0)及二次传代(P1)后2周的肿瘤组织浸泡于10%福尔马林溶液中固定24 h;常规脱水制作石蜡切片。H-E染色观察组织病理变化。羊抗人CD3抗体作为一抗,通过免疫组织化学染色观察T细胞在组织中的浸润情况。
1.2.3 流式细胞术分析 小鼠眼眶静脉取血,裂解红细胞后,制成单细胞悬液。加入抗小鼠CD16/CD32抗体封闭处理15 min,加入FITC标记的抗小鼠CD14、PE标记的抗人CD3和PerCPcy5.5标记的抗人CD8抗体,4 ℃避光染色30 min后上机进行流式细胞术分析。
1.3 统计学处理 肿瘤大小以长短径的平均值表示,并用GraphPad Prism 8.0软件进行作图;采用FlowJo软件分析流式细胞术检测结果。
2 结 果
2.1 胃癌免疫PDX模型的建立 将胃癌肿瘤组织分为8 小块,移植到4 只NCG小鼠(分别命名为P0-1、P0-2、P0-3和P0-4)背部两侧(L和R)。移植2 周后,4 只小鼠背部皮下均可见肿块(图1A)。随着时间延长,接种的7 个肿块直径逐渐增大,且在移植8 周后生长更为迅速,生长特性符合肿瘤增殖的生物学特征;1 个肿块未见明显增长,且在移植8 周后开始减小(图1B)。移植12周后,取生长迅速的肿瘤块P0-2L传代至2 只新的NCG小鼠皮下,即第二代(P1),P1代肿瘤块的生长速度较P0代更快(图1C)。

PDX:患者来源的肿瘤组织异种移植。A:新鲜胃癌肿瘤组织及小鼠皮下移植5 周后肿瘤组织照片;B、C:原代移植(P0)及再次移植(P1)肿瘤组织的生长曲线。P0-1、2、3、4及P1-1、2代表不同NCG小鼠编码,L和R代表左侧和右侧组织。
2.2 免疫PDX病理及组织化学分析 P0代肿瘤移植5周后,取出P0-3和P0-4荷瘤小鼠的肿瘤进行组织H-E及免疫组织化学染色分析。与Primary肿瘤组织比较,初次移植第5周(P0-3L)及再次移植第2周(P1-1L)的肿瘤组织仍保留胃癌细胞的形态特征,表现为细胞异形,核大小不一,核浆比例高。在移植与传代过程中,亦可见肿瘤组织发生形态变化,包括:(1)腺管样结构减少,移植前肿瘤组织中可见明显的、较多的腺管样结构散布其中,移植后腺管样结构减少并且变小,再次移植肿瘤中无腺管样结构;(2)人基质细胞减少,小鼠纤维细胞逐渐增多且侵入到肿瘤组织内部,逐渐取代人基质细胞。免疫组织化学染色显示,Primary胃癌肿瘤组织中有较多的T淋巴细胞浸润,P0代T细胞数量逐渐减少,P1代后肿瘤组织检测不到T细胞(图2)。
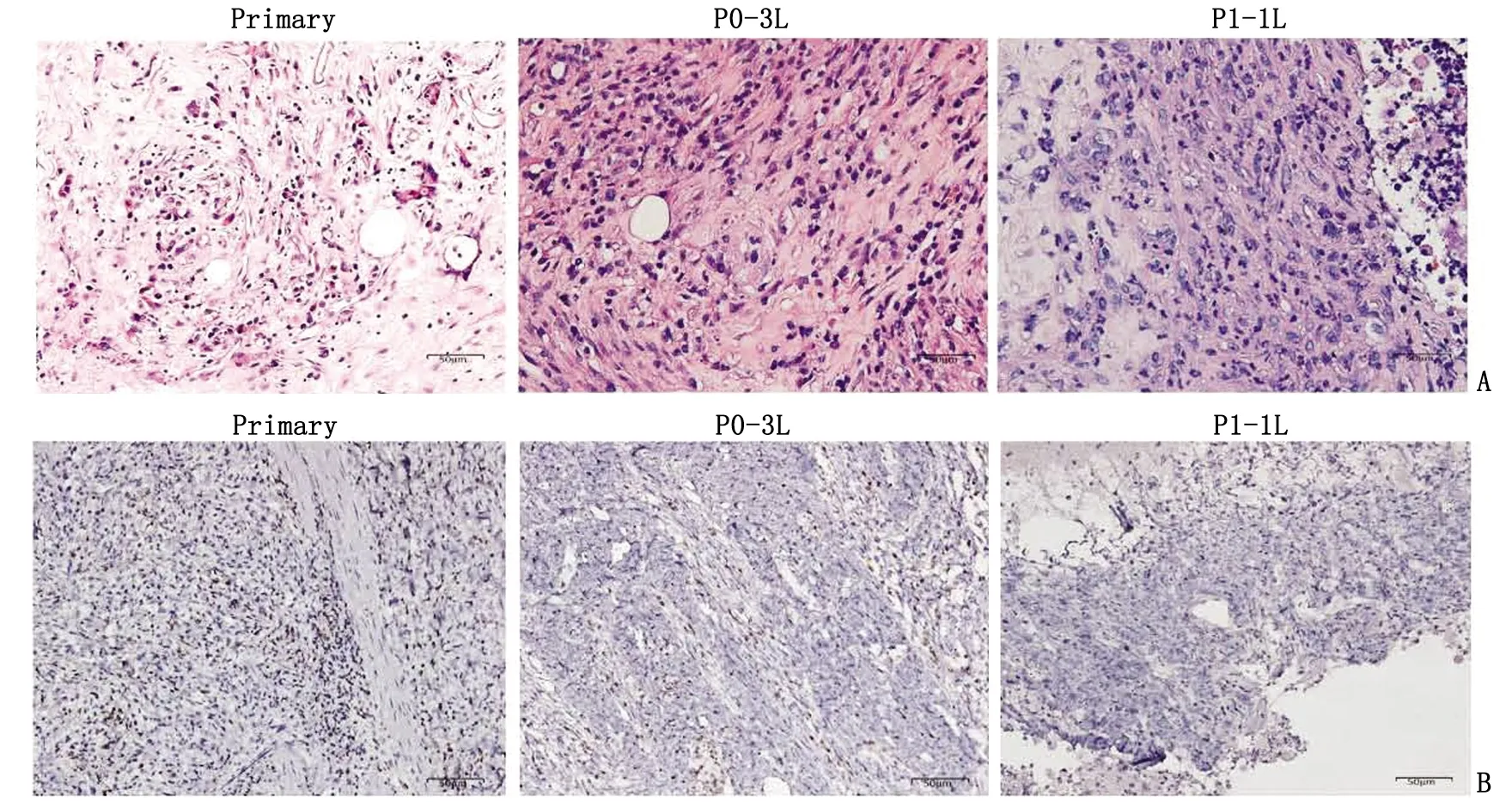
A:H-E染色结果;B:CD3免疫组织化学染色结果。Primary、P0和P1分别为新鲜、首次移植和再次移植后的肿瘤组织,3L及1L为移植小鼠的标号。
2.3 荷瘤小鼠外周血人源性T细胞分析 通过流式细胞术定期检测荷瘤小鼠外周血人源性T细胞比例,可见移植2周后,小鼠外周血白细胞中人CD8+CD3+T细胞比例极低(<1%),随后开始上升;移植4~5周后,人CD8+CD3+T细胞比例达到峰值(P0-1小鼠为24.5%,P0-2小鼠为16%),随后开始下降;移植10周后,人CD8+CD3+T细胞比例仍为4%(图3)。
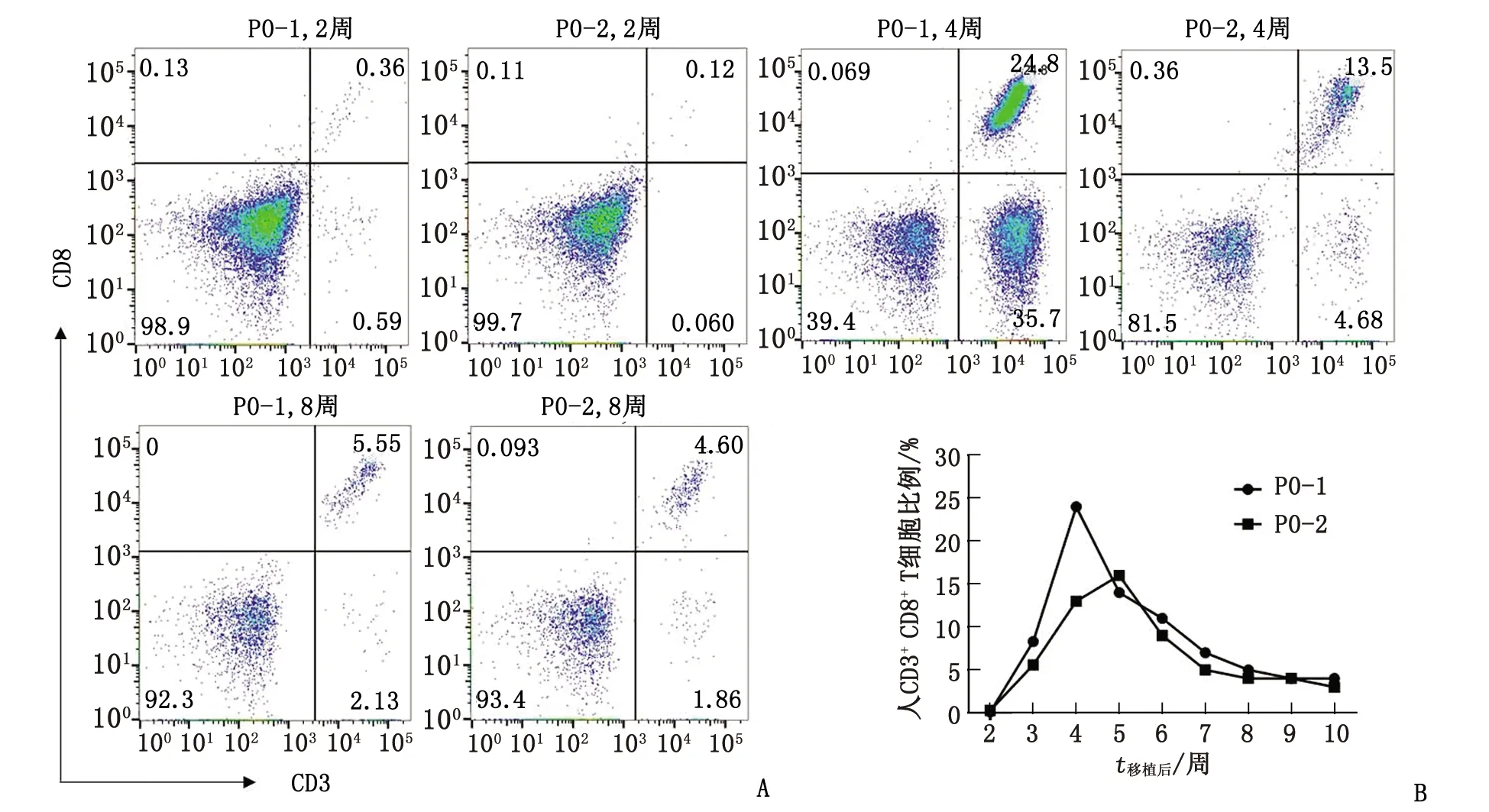
PDX:患者来源的肿瘤组织异种移植。A:移植后不同时间点小鼠外周血CD3+CD8+T细胞比例的流式细胞术分析图(设门在小鼠外周血活细胞中);B:流式细胞术分析免疫结果的统计图(P0-1及P0-2为初次移植的小鼠编号)。
3 讨 论
随着胃癌临床免疫治疗的推广应用,相应的人源免疫系统PDX模型的构建逐渐成为研究热点。利用PDX模型重建人源免疫系统,是研究肿瘤与免疫系统相互作用及评估预测免疫治疗药物抗肿瘤效果的关键。已有文献报道,移植CD3阳性造血干细胞(hematopoietic stem cell, HSC)的免疫缺陷小鼠体内,可以产生包括人T、B细胞在内的多种免疫细胞[11-13]。但由于MHC的限制性,产生的人T细胞无法与小鼠抗原提呈细胞(antigen presenting cell,APC)相互作用,导致肿瘤移植后不能产生有效的适应性免疫应答[14-15]。尽管自体同源的骨髓、胎肝和胸腺组织共移植到免疫缺陷小鼠体内,可以克服上述问题,但这些组织较难获得,模型建立过程复杂且耗时较长,其广泛应用具有一定的局限性[16-17]。相较于人造免疫系统,随肿瘤组织一起移植的TIL更能充分反映原代肿瘤的免疫微环境。本研究从胃癌手术中获取新鲜肿瘤组织构建PDX模型。鉴于已有的研究报道TIL主要集中于肿瘤周边组织[7],本研究取材时选择靠近正常组织边缘的肿瘤组织。免疫组织化学结果显示,移植5周后仍能在肿瘤组织中检测CD8 T细胞的浸润,但再次移植2周后肿瘤组织无法检测到CD8 T细胞。这些结果为探索潜在的肿瘤免疫药物提供了实验模型。本研究结果提示,移植后5周的人胃癌免疫模型仍可用于研究肿瘤与免疫系统相互作用,不建议使用多次传代的移植模型。
本研究分析了胃癌PDX模型小鼠外周血的人源T细胞比例变化,结果发现:在移植后2周即可在小鼠外周血测到肿瘤组织来源的CD3+CD8+T细胞,随后比例逐渐上升,提示PDX模型小鼠体内存在人源T细胞扩增现象。Simpson-Abelson等[18]报道,人源CD8T细胞在人肺癌PDX模型小鼠体内有扩增现象。根据已有的文献报道,人源CD8T细胞扩增的可能原因:(1)移植受体为免疫缺陷小鼠,其获得性免疫功能完全消失,天然免疫功能也大部分受损,无法清除或抑制外源T细胞;(2)肿瘤组织中存活的人CD8 T表型多为记忆细胞,可通过识别肿瘤细胞表面抗原而活化增殖[19]。本研究发现,移植后4~5周,外周血中人源T细胞比例达到峰值,随后开始下降,移植后10周仍可检测到人CD8 T细胞。由于移植物来源的TIL大多是经历肿瘤抗原的特异性活化的寡克隆,其识别小鼠组织而引发移植物抗宿主(graft versus host disease, GVDH)的能力有限[20]。一旦小鼠发生GVDH效应后,可导致小鼠外周血中人源T细胞持续增加,直至小鼠发生死亡。本研究通过动态监测移植瘤小鼠外周血T细胞比例的变化规律后,基本可以排除GVHD的作用。因此,笔者推测,扩增的T细胞可能是记忆T细胞识别肿瘤抗原后发生活化增殖所致。类似研究也报道,PDX模型中CD8 T细胞随肿瘤进入小鼠后可在体内存活63~290 d[21-22],人CD8 T细胞存活的时间受肿瘤类型、肿瘤组织大小、取材部位及受体小鼠的状态等多种因素影响。
综上所述,本研究探索了人胃癌肿瘤组织来源的免疫PDX模型的构建方案,提示该模型进行肿瘤免疫研究的最佳时间段,即移植后3~8周人源T细胞存活较多的阶段。尽管免疫PDX模型仍存在诸多问题,但其仍是较为客观地反映肿瘤患者体内免疫微环境的实验模型,可推广应用于免疫治疗药物的机制研究与临床前试验。后续将进一步探索如何在免疫PDX模型肿瘤组织中更有效保留人源T细胞,避免T细胞外渗至外周血及其他免疫器官。
