孕期镉暴露后子代成年卵巢颗粒细胞激素合成基因相关microRNA表达谱改变
2021-10-19刘张嫔李庆宇吕亚可李静雯张文昌
刘张嫔,李庆宇,吕亚可,李静雯,张文昌
镉对雌性性腺的毒性是目前研究的热点之一,子宫和卵巢是其靶器官,且镉能通过胎盘,影响子代雌孕激素的合成与分泌[1]。课题组先前的研究发现,孕期镉暴露致子代成年雌性大鼠孕酮含量下降[2]。而microRNA(miRNA)可参与调控卵巢颗粒细胞雌孕激素的合成与分泌[3]。本课题拟建立孕期镉暴露动物模型,筛选子代中可能参与调控卵巢颗粒细胞雌孕激素合成与分泌相关miRNAs,并进行生物信息学分析,探讨镉致子代雌孕激素合成障碍的可能机制,为进一步研究子代卵巢损害的表观遗传机制提供依据。
1 材料与方法
1.1 仪器与试剂 氯化镉(纯度:99%,美国Sigma公司);SPF级SD大鼠[上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2012-0002]。
1.2 卵巢颗粒细胞提取 无菌条件下,迅速从大鼠背部取出双侧卵巢,置于经37 ℃孵育、含双抗(青霉素100 U/mL,链霉素100 mg/L)的DMEM-F12培养液中清洗,洗净后换置新的预热DMEM-F12培养液。体式显微镜下用25号针头刺破卵泡,引导颗粒细胞流出。收集所有细胞液,用0.075 mm(200目)不锈钢过滤网过滤,1 000 r/min离心5 min,弃上清。加入PBS重悬细胞,按1∶1的比例将悬液加入已配好的50% Percoll分离液上,400×g离心20 min,吸取中间白色颗粒细胞层,加入PBS,1 000 r/min条件下离心5 min,洗涤2次,加入适量含双抗的DMEM-F12+10%FBS培养基制成单细胞悬液,血球计数板计数,调整细胞浓度为1×106个/mL,移至培养皿中,置于37 ℃培养箱中培养24 h,提取颗粒细胞总RNA。
1.3 获取卵巢颗粒细胞miRNA芯片数据 大鼠孕期分别予生理盐水、8 mg/kg氯化镉灌胃染毒,自然分娩获F1代;常规饲养至成年,与新购健康雄性大鼠交配产F2代。提取F1、F2代成年雌性大鼠卵巢颗粒细胞总RNA。RNA标记及芯片杂交等具体操作由上海康成生物公司完成。从以下3个来源探索性地筛选出可能调控子代雌孕激素合成的miRNAs。
1.3.1 miRNA芯片表达谱 以差异表达倍数(fold change, FC)>2.0且P<0.05为判断标准,挑选出差异表达的miRNAs纳入备选。以FC>2.0为判断标准,挑选出差异表达的miRNAs纳入备选。
1.3.2 数据库预测的靶miRNA 使用TargetScan、miRWalk和miRDB在线预测软件对甾体合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)及类固醇生成因子1(steroidogenic factor-1,Sf-1)、细胞色素P450侧链裂解酶(Cyp11a1)、细胞色素P450羟化酶(Cyp17a1)和细胞色素P450芳香化酶(Cyp19a1)等雌孕激素合成过程中的关键基因进行靶miRNA预测,将SUM≥2的靶miRNAs纳入备选。
1.3.3 文献检索 利用Pubmed、中国知网、万方数据库检索国内外文献,将与卵巢颗粒细胞合成雌孕激素相关的miRNAs纳入备选。
1.4 生物信息学分析 应用TargetScan、miRWalk和miRDB在线预测软件预测筛选的miRNAs的可能靶基因,取三者交集,应用在线数据库DAVID系统(http://david.ncifcrf.gov/)将获得的靶向基因进行GO(Gene ontology)及KEGG(Kyoto Encyclopedia of Gene and Genomes)pathways富集分析。
2 结 果
2.1 卵巢颗粒细胞miRNA芯片分析
2.1.1 以FC>2.0作为判断标准 使用FC>2.0作为筛选条件,筛选差异表达的miRNAs,F1代筛选出76个miRNAs,其中31个上调,45个下调;F2代筛选出63个miRNAs,其中22个上调,41个下调。
2.1.2 以FC>2.0且P<0.05作为判断标准 使用FC>2.0且P<0.05作为筛选条件筛选差异表达的miRNAs,F1代筛选出3个miRNAs,其中 2个上调,1个下调;F2代筛选出7个miRNAs,其中6个上调,1个下调(表1、2)。

表1 F1代差异表达的microRNAs
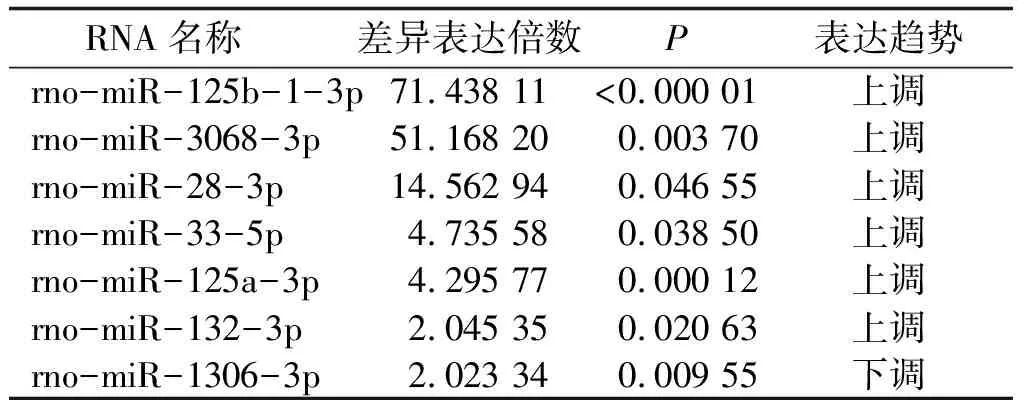
表2 F2代差异表达的microRNAs
2.2 miRNAs筛选
2.2.1 以FC>2.0且P<0.05作为判断标准 通过miRNA芯片差异表达分析、数据库预测和文献检索筛选出可能调控子代雌孕激素合成的miRNAs,F1代挑选出2个miRNAs:rno-miR-532-3p、rno-miR-92a-2-5p;F2代挑选出4个miRNAs:rno-miR-125a-3p、rno-miR-132-3p、rno-miR-28-3p、rno-miR-125b-1-3p。
2.2.2 以FC>2.0作为判断标准 同上,F1代挑选出25个可能的miRNAs:rno-miR-132-5p、rno-miR-184、rno-miR-708-5p、rno-miR-628、rno-miR-3577、rno-miR-18a-5p、rno-miR-27a-3p、rno-miR-532-5p、rno-miR-182、rno-miR-122-5p、rno-miR-532-3p、rno-miR-431、rno-miR-326-3p、rno-miR-758-5p、rno-miR-92a-2-5p、rno-miR-151-3p、rno-miR-128-3p、rno-miR-126a-5p、rno-miR-148a-3p、rno-miR-1-3p、rno-miR-187-5p、rno-miR-103-1-5p、rno-miR-27a-5p、rno-miR-96-5p、rno-miR-29b-5p;F2代挑选出20个可能的miRNAs:rno-miR-146a-5p、rno-miR-222-3p、rno-miR-883-5p、rno-miR-874-5p、rno-miR-193a-3p、rno-miR-125a-3p、rno-miR-132-3p、rno-miR-138-5p、rno-miR-143-3p、rno-miR-24-2-5p、rno-miR-28-3p、rno-miR-30d-3p、rno-miR-145-5p、rno-miR-532-3p、rno-miR-125b-1-3p、rno-miR-135b-5p、rno-miR-29a-5p、rno-miR-96-5p、rno-miR-126a-5p、rno-miR-181d-3p。
2.3 生物信息学分析
2.3.1 靶基因GO富集分析
2.3.1.1 以FC>2.0且P<0.05作为判断标准 对F1代筛选的rno-miR-532-3p、rno-miR-92a-2-5p的靶基因进行GO富集分析,富集到与雌孕激素相关的生物学功能为卵巢卵泡发育。对F2代筛选出的4个miRNAs进行GO富集分析,富集到两个相关的生物学功能:MAPK级联和胚胎发育。
2.3.1.2 以FC>2.0作为判断标准 分别对F1、F2代筛选出来的25、20个miRNAs的靶基因进行GO富集分析,取排名前10的结果(图1、2)。挑出与雌孕激素相关的富集结果,F1代25个miRNAs主要位于膜区域,具有类固醇激素受体活性,参与女性性腺发育、类固醇激素介导的信号通路等生物过程。F2代20个miRNAs主要位于细胞质区域,具有mRNA 3′-UTR结合活性,参与胆固醇生物合成过程的负调控、生殖发育过程、对雌二醇的反应等生物学过程。

图1 F1代microRNAs靶基因GO富集分析
2.3.2 靶基因KEGG富集分析
2.3.2.1 以FC>2.0且P<0.05作为判断标准 对F1代筛选的2个rno-miR-532-3p和rno-miR-92a-2-5p的靶基因进行KEGG分析,未富集到相关通路。对F2代筛选的4个miRNAs的靶基因进行KEGG分析,富集到FOXO信号通路与雌孕激素相关。
2.3.2.2 以FC>2.0作为判断标准 分别对F1、F2代筛选出的25、20个miRNAs的靶基因进行KEGG分析,富集得分排名前10位如图3、4所示。F1代富集到雌激素信号通路、Wnt 信号通路[4]、cAMP信号通路[5]、孕激素介导的卵母细胞成熟、FOXO信号通路[6]、MAPK信号通路[7]、PI3K-Akt信号传导途径[8]等7条与雌孕激素作用相关的通路。F2代富集到与雌孕激素相关的通路有孕激素介导的卵母细胞成熟、MAPK信号通路和cAMP信号通路。
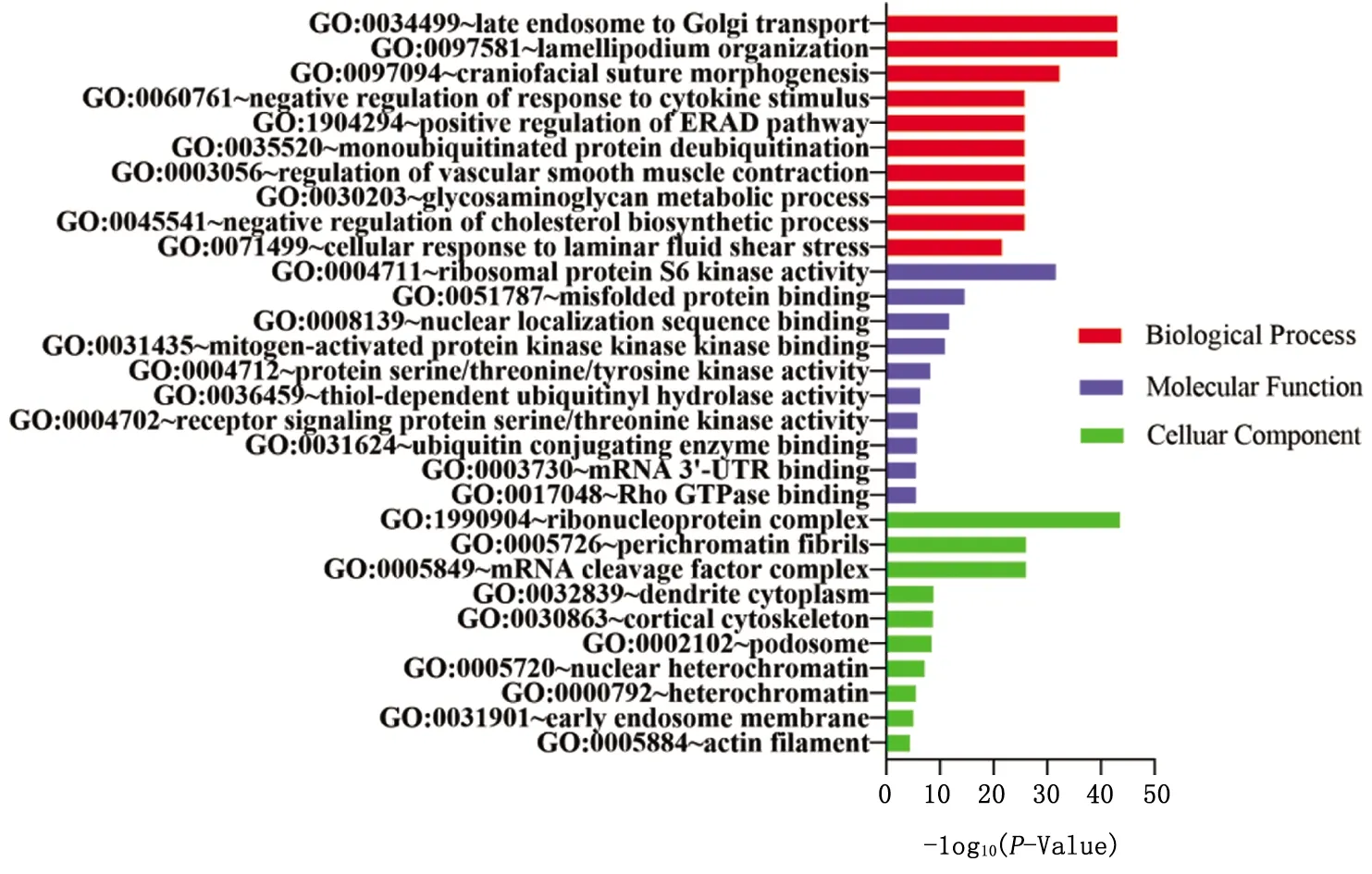
图2 F2代microRNAs靶基因GO富集分析

图3 F1代microRNAs靶基因KEGG富集分析

图4 F2代microRNAs靶基因KEGG富集分析
3 讨 论
孕期镉暴露会影响子代卵巢颗粒细胞雌孕激素合成与分泌。课题组前期研究表明,孕期镉暴露后F1代和F2代雌性子代卵巢颗粒细胞上清液孕酮水平降低,合成雌孕激素的关键基因StAR和Cyp11a1的蛋白表达水平均显著下降[2]。但镉引起子代雌孕激素合成与分泌障碍机制尚未清楚,而表观遗传学修饰被认为起重要作用。
miRNAs是一类20~24个核苷酸单链非编码RNA分子,在转录后水平对基因表达起着关键的调控作用[9]。众多研究表明,许多miRNAs在雌孕激素合成与分泌过程中有着重要的调控作用[3,9]。但较少研究关注镉暴露引起的多代类固醇激素合成障碍中miRNAs是否发挥重要作用。本研究采用孕期镉暴露后子代卵巢颗粒细胞的miRNA芯片表达谱,以FC>2.0、P<0.05为判断标准,在F1和F2代分别获取有3、7个显著差异表达的miRNAs;以FC>2.0为标准筛选芯片差异表达的miRNAs,再综合数据库预测和文献检索进行分析,F1和F2代分别筛选出25、20个可能调控子代雌孕激素合成与分泌的miRNAs,该部分结果表明与雌孕激素合成基因相关的miRNA表达谱在孕期镉暴露的两代子代中均发生变化。而课题组先前研究已证实,孕期镉暴露后两代子代合成孕酮能力显著下降,并且发现在F1代和F2代中均表达上调的miR-10b-5p和miR-27a-3p,可通过靶向StAR介导子代卵巢颗粒细胞功能损伤[2],说明miRNAs确实参与了子代激素合成障碍的调控。结合本研究两代子代的GO分析均富集到与雌孕激素相关的生物学过程,其中女性性腺发育与雌孕激素密不可分[10];类固醇激素介导的信号通路可能和雌孕激素的作用途径相关;胆固醇是合成雌孕激素的原料[11],对其生物合成过程的调控会直接影响激素的合成。KEGG分析均富集到与雌孕激素作用的相关通路。已有研究表明,重金属镉可通过抑制 cAMP信号通路和类固醇生成酶StAR、Cyp11a1和3βHSD的活化,显著降低类固醇激素水平[5],提示孕期镉暴露后子代成年卵巢颗粒细胞中与雌孕激素相关的miRNAs会发生改变,并且可能在镉致子代孕酮合成障碍中发挥一定作用,需引起重点关注。
孕期镉暴露,F1代为胚胎,属于直接暴露;F2代为F1代胚胎中原始生殖细胞,属于间接暴露。课题组既往研究发现[2],孕期镉暴露后的F1代和F2代成年卵巢颗粒细胞激素表型变化一致,提示本模型中激素表型存在代际效应,故以miRNAs改变为代表的表观遗传学修饰表型是否也存在代际效应是本次研究的关注重点之一。miRNAs在卵母细胞中存在为其代际效应提供了理论基础。Nilsson等[12]的研究发现,在F0代孕期暴露于vinclozolin或DDT的F3代卵巢颗粒细胞中长链非编码RNA和非编码小RNA均存在差异表达,因其未做F1~F3代非编码RNA的比较,故仅能提示表观遗传学修饰表型可能存在代际或跨代效应。本研究以FC>2.0作为判断标准,F1代和F2代分别筛选出的25、20个目标miRNAs中存在3个共同的miRNAs,包括rno-miR-532-3p、rno-miR-126a-5p和rno-miR-96-5p,表明孕期镉暴露后,与雌孕激素合成相关的miRNAs可能出现传代效应,可进一步确认其是否在F2代中差异表达。
F1和F2代的KEGG分析结果均涉及cAMP信号通路、MAPK信号通路和孕激素介导的卵母细胞成熟。研究表明,在人乳腺癌细胞、人支气管上皮细胞、肾系膜细胞等细胞系中,镉暴露可激活MAPK信号通路[13-14],MAPK信号通路与雌孕激素相关[7],但镉是否会通过MAPK信号通路对卵巢颗粒细胞合成与分泌雌孕激素造成影响未知。阳良生等[15]的研究表明,孕酮诱发两栖类卵母细胞成熟。基于以上结果,前两条通路可能是孕期镉暴露后两代子代孕酮合成障碍的共同机制,需在今后进一步验证。
本研究仅在F1代富集到雌激素信号通路、Wnt 信号通路、PI3K-Akt信号传导途径、FOXO信号通路。人肾近曲小管细胞系氯化镉暴露可激活PI3K-Akt信号传导途径[16]。Hu等[8]的研究表明,PI3K-Akt信号传导途径参与颗粒细胞类固醇激素合成。镉暴露诱导的氧化应激与FOXO相关,且FOXO作为一种转录因子参与调控雌孕激素合成[17]。本研究仅在F1代富集到的PI3K-Akt信号传导途径和FOXO信号通路,可能仅在F1代影响孕酮合成,并且可能是F1与F2代导致孕酮合成障碍的不同机制,但仍有待进一步验证。
综上所述,孕期镉暴露致子代卵巢颗粒细胞雌孕激素合成分泌障碍的机制中,相关的miRNA表达谱有发生变化,部分miRNAs出现代际效应。结合课题组以往的研究结果及本研究的生信分析,提示miRNAs可能在两代子代孕酮合成障碍中起重要的调控作用;cAMP信号通路和MAPK信号通路可能是两代孕酮合成受损的共同机制,而PI3K-Akt信号传导途径和FOXO信号通路可能是F1代孕酮水平下降比F2代更为显著的原因。
