小麦赤霉病抗病机制研究进展
2021-10-18苏培森
苏培森
聊城大学农学院,山东聊城252000
小麦作为世界上第三大粮食作物,是人类能量和蛋白质的主要来源,小麦的生产对确保我国和全球粮食安全具有重要的意义。然而,小麦在生长发育过程中,往往会遭受来自外界各种病原菌的侵染,导致小麦产量和品质的降低,严重影响小麦的生产和粮食安全。小麦赤霉病是一种严重的小麦穗部真菌病害,主要由禾谷镰孢菌(俗称禾谷镰刀菌,Fusarium graminearum)引起,被称为小麦“癌症”,会造成小麦大幅度减产。据统计,在2019年,全世界范围内,由于赤霉病引起的减产仅次于小麦锈病[1]。我国作为小麦赤霉病常年发生和局部地区常年流行的国家之一,在2000—2018年间,由于赤霉病引起的小麦年均产量损失超过341万t[2-3]。近年来,随着气候变化以及耕作制度的改变,我国小麦赤霉病常发及重发区域也从长江中下游麦区扩展到黄淮麦区。2012年,小麦赤霉病在全国大面积爆发,发病面积达到994.91万hm2[4]。在随后的2016年,小麦赤霉病的发病面积达到了174.0万hm2[5-6]。小麦赤霉病防治工作已经刻不容缓。目前生产上,防治小麦赤霉病有效的策略是化学防治,然而,农药的大量使用对环境具有破坏作用。长远来看,筛选小麦抗赤霉病种质资源,挖掘抗性基因,培育抗赤霉病品种是最经济、绿色、环保有效的方式。
小麦赤霉病抗性是数量遗传性状,受遗传和环境双重因素的影响,其抗性机制复杂。目前小麦赤霉病的抗性机制已经进行了大量的研究,关于小麦赤霉病抗性的QTL已经被报道了数百个,分布在小麦所有的染色体上[7]。然而,迄今为止,只有7个赤霉病抗病位点被正式命名为小麦抗赤霉 病基因,即Fhb1~Fhb7。其中,仅有Fhb1和Fhb7基因被克隆。Rawat等[8]首次从小麦赤霉病抗性品种苏麦3号中克隆到了Fhb1基因,并指出其为编码一种带有凝集素结构域以及类毒素成孔结构域的嵌合凝集素(pore-forming toxin-like,PFT)基因,通过基因沉默、Tilling突变体等手段证明了其在小麦赤霉病中的功能。随后,Su等[9]和Li等[10]同时克隆到了Fhb1基因,并指出其为富含组氨酸的钙结合蛋白基因(histidine-rich calcium-binding-protein gene,简称His或HRC)。但是,两项研究的结论却截然不同:即一个认为是感病基因丧失功能引起抗病,另一个认为His基因部分序列缺失导致赤霉病抗性单倍型产生,从而获得抗病功能。虽然Fhb1基因的抗性机制还存在争议,但是我们不可否认Fhb1在小麦抗赤霉病育种中的作用,其创制的不同品系及小麦品种对赤霉病均展现出了非常好的抗性。Wang等[11]克隆了来自小麦近缘植物长穗偃麦草中的抗赤霉病基因Fhb7,该基因编码一种谷胱甘肽S-转移酶,对多种单端孢霉烯族毒素具有解毒作用。此外,田间试验表明导入携带Fhb7基因染色质片段的不同背景小麦对产量均没有显著的负面影响。这两个基因的克隆为小麦抗赤霉病遗传改良提供了优异的抗病基因资源,在未来小麦抗赤霉病种质资源创新及分子辅助育种中具有非常广泛的应用价值。
目前通过正向遗传学分离得到小麦抗赤霉病关键基因仍是一项非常具有挑战性的任务。随着生物工程技术、测序技术以及基因操作技术的飞速发展,使得利用转录组、代谢组以及蛋白质组等多组学分析手段阐明小麦赤霉病抗性机制成为可能,这也使得参与调控小麦赤霉病抗性的各个生物学过程被发现,像细胞壁防卫反应、信号转导通路(激素信号通路、钙离子信号通路、ROS信号通路)、次级代谢生物合成(黄酮合成路径、酚胺合成路径)、识别应答、降低胞内毒素转化等,并可能通过调控这些路径的相关基因,像ABC转运蛋白、UDP-葡萄糖基转移酶、转录因子、锌指蛋白、病程相关蛋白、单体α-淀粉酶和二聚α-淀粉酶抑制剂、醛脱氢酶、乌头酸水合酶和依赖NADP的苹果酸酶等,抵御禾谷镰孢菌的侵染[12-17]。随着多组学研究技术的进一步发展,越来越多的赤霉病抗性相关基因和调控赤霉病抗性的分子网络以及具有抗性功能的天然活性代谢物也将被进一步挖掘和验证,这将逐步完善小麦抗赤霉病的分子调控网络,为我们通过生物技术手段改造小麦赤霉病抗性提供理论基础,对于解决小麦赤霉病这一世界难题具有重要的意义。
1 赤霉病抗性机制
1.1 细胞壁防卫与赤霉病抗性
细胞壁作为一个高度动态的结构,是寄主抵御病原菌的第一道防线。当病原菌侵染植物时,首先附着和侵染的是寄主细胞壁。病原菌的侵染往往会引起细胞壁中沉淀酚类化合物、胼胝质、木质素等,从而引起细胞壁厚度和强度的增加[18]。有研究指出,细胞壁主要通过两种方式参与对病原菌的防御反应,一种是通过改变自身的结构和成分来抑制病原菌降解酶对自身的降解,进而延缓或阻止病原菌;另一方面则是通过调节植物抗性相关的基因来增强植物的系统抗性[19]。在拟南芥中,ERECTA(ER)类受体蛋白激酶可以影响细胞壁胼胝质和糖醛酸含量,进而影响拟南芥对病原菌Plectosphaerella cucumerina的抗性。此外,当突变掉er基因后,发现er-1突变体在病原菌侵染后不能产生胼胝质[20-21]。富含脯氨酸蛋白(proline-rich protein,PRR)是细胞壁结构蛋白的一个重要组成成分。有研究指出将小麦PRP基因TaPRP3转化普通小麦扬麦158可以提高转基因株系的赤霉病抗性[22]。肌动蛋白是构成细胞骨架的重要成员之一,肌动蛋白解聚因子(actin depolymerizing factor,ADF)则是作为肌动蛋白表达的一个重要调节因子,在植物防卫真菌侵染过程中有重要的作用。Geddes等[23]通过蛋白质组学分析了大麦赤霉病蛋白质组分,发现ADF在大麦抵御赤霉病过程中发挥重要的作用。魏芳和马鸿翔[24]在小麦中克隆到了一个ADF基因TaADF,表达模式分析发现其在接种禾谷镰刀菌72 h以内均上调表达,认为其在小麦赤霉病发生过程中具有重要的作用。
在病原菌侵染的早期,会释放出多聚半乳糖醛酸酶(polygalacturonase,PG),其可以通过降解细胞壁的主要成分果胶,引起细胞壁的破坏,进而导致病原菌的侵染[25-26]。与之对应的是,寄主自身分泌的多聚半乳糖醛酸酶抑制蛋白(polygalacturonase inhabiting protein,PGIP)可以特异性识别并结合病原菌产生的PG,进而抑制其分解细胞壁的能力,此外还能促进多聚半乳糖醛酸的积累,从而更有效地激活植物自身的防卫反应[27]。康振生等[28]结合细胞化学技术发现在禾谷镰孢菌侵染和延展的过程中,会分泌大量的细胞壁降解酶(纤维素酶、木聚糖酶和果胶酶),引起寄主细胞壁分解,从而引起细胞坏死,最终导致寄主感病。有研究指出,拟南芥AtPGIP1和AtPGIP2基因均能提高转基因植株对腐生型灰葡萄球菌侵染的抗性。此外还证明该基因可以抑制禾谷镰孢菌PG蛋白,表现出较高的赤霉病抗性[29-30]。将大豆中的多聚半乳糖醛酸酶抑制蛋白基因GmPGIP3转入普通小麦扬麦18和扬麦19中,可以提高小麦对赤霉病、纹枯病和根腐病等多种真菌性病害的抗性[31]。侯文倩[32]认为TaPGIP在禾谷镰孢菌侵染小麦过程中与分泌的PG结合,进而抑制PG活性,阻止禾谷镰孢菌的侵染。此外,还有一些其他细胞壁防卫相关的物质参与了植物抵抗病原菌的侵染,像多酚氧化酶(PPO)、活性氧(ROS)。李祥义等[33]指出麦穗中的PPO活性和小麦品种感染赤霉病的程度呈正相关。接种小麦抗赤霉病品种宁麦6号48 h,发现小穗中的PPO活性急剧升高,随后还发现褐色的酚醌类物质充满了木质部的导管和韧皮部。这说明在禾谷镰孢菌侵染的过程中,小麦体内的PPO酶被激活,并导致酚类等物质的合成,从而破坏植物细胞和导致植物细胞死亡。
1.2 信号转导与赤霉病抗性
当受到病原菌侵染时,植物会产生不同的信号分子,这些信号分子通过复杂的信号途径激发抗病相关基因的表达,从而响应病原菌的侵染。在这些信号路径中,植物激素水杨酸(SA)、茉莉酸(JA)、生长素(IAA)、乙烯(ET)、脱落酸(ABA)等都参与了植物抵抗病原菌的侵染,而且有大量的报道指出,不同激素在调节植物抗病过程中存在着相互协同或相互抑制作用[34-35]。例如,在抗病过程中,SA与JA/ET表现出拮抗作用,SA可以通过调控通路关键基因NPR1、WRKY70和WRKY13抑制JA/ET通路。反之,JA/ET可以通过MAPK4和JIN2抑制SA信号路径下游基因的表达[36-38]。Makandar[39]在研究中指出,在禾谷镰孢菌感染早期JA信号抑制SA信号的激活,然而,在感染后期则可促进植物耐病性。JA和ET信号途径之间存在相互协同的作用,通过激活抗病相关基因的表达,以介导植物体对病原菌的抗性。JA信号路径下游基因,像THI2.1、CHIB、PDF1.2和HEL的表达都需要EIN2的存在。通过对coi1和ein2突变体进行组成型表达ERF1,发现其可以恢复突变体抗病表型,这说明ERF1是JA和ET信号途径的共同转录因子[40]。ET在感染早期促进了FHB抗性,但随后ET与DON和活性氧(reactive oxygen species,ROS)一起促进了穗部的衰老,最终引起病原菌在死亡宿主组织中定植[41-42]。在真菌侵染后,小麦生长素的生物合成被激活,但似乎与FHB易感性相关[41]。Su等[13]通过体外生长素处理,发现生长素在小麦抗赤霉病过程中扮演负调控的角色,进一步研究证明沉默生长素受体基因TaTIR1可以显著增强转基因小麦的赤霉病抗性。还有研究指出,IAA通过抑制SA,并促进JA介导的防御反应在植物抗病过程中发挥作用[43-44]。体外ABA处理也可以提高禾谷镰孢菌的侵染能力。有趣的是,一些镰孢菌病原体能够自行产生ABA,从而促进病害的发展[45]。
在抵抗病原菌侵染过程中,水杨酸和茉莉酸处于相对核心的地位。大量的研究表明SA和JA均可以响应禾谷镰孢菌的侵染,相比SA在侵染前期的快速积累,JA的积累则发生在SA之后,这表明在抵御禾谷镰孢菌侵染过程中,SA和JA之间可能存在拮抗关系[46-48]。SA和JA路径基因也被证明参与小麦抗赤霉病的过程,像SA路径基因PAL、EDS1、NPR1、Glu2可以快速响应禾谷镰孢菌的侵染,过表达TaNPR3、TaICS、TaTGA2均可以显著增加转基因小麦的赤霉病抗性。沉默JA合成路径基因TaAOC、TaAOS和TaOPR3可以显著提高小麦赤霉病的感病性。此外,研究还发现TaNPR1也受到禾谷镰孢菌正向调控,但与双子叶植物不同的是,其表达受JA路径调控而不受SA路径调控[15]。一些基因,像EDS1、NPR1、BIK1、ERF1、RGAs,被报道参与植物激素之间交叉调控病原菌侵染的信号通路[40,46,49-53]。虽然关于植物激素在小麦赤霉病抗性中的作用已经有了一个相对清晰的认识,并且一些关键的抗性基因已经被挖掘,然而相比双子叶植物,在抵御病原菌侵染过程中,单子叶植物小麦中似乎存在更为复杂的激素调控机制。在小麦抵抗禾谷镰孢菌侵染过程中,各激素之间通过相互协同或拮抗作用调节植物抗病的机制也将是接下来一个重点的研究方向。
植物细胞第二信使包括钙离子(Ca2+)、过氧化氢(H2O2)、磷脂酸(PA)等,其可以把信号分子传递到细胞内的特定部位及代谢系统,从而引起特定的细胞效应。在植物中,钙离子信号通路已经被确认为是重要的信号转导通路,其可以调控植物响应多种外界刺激[54-55]。钙调蛋白(CaM)被认为是钙离子信号受体中最重要的一种。有报道指出,小麦钙调蛋白TaCaM4-1可以和TaCAMTA4互作参与抵抗叶锈病的过程,TdCaM1.3可以通过调节病程相关蛋白TdPR1.2起到抗菌的作用[56-57],沉默小麦钙调蛋白结合激酶TaCBRLK,可以降低小麦叶片对赤霉病的抗性[32]。ROS参与了植物木质素的聚合过程,被认为是激活和建立植物SA/JA信号所需要的[58]。H2O2则被认为是SA下游信号的传递分子,可以和SA结合从而丧失催化活性。SA可以诱导植物组织中H2O2含量增加,导致细胞死亡,引起植物的过敏性反应,从而抵抗病原菌的侵染[59]。小麦在受到DON毒素诱导时可以产生大量的H2O2,从而促进细胞死亡[60]。此外,磷脂酸合成途径的关键酶甘油二酯激酶(DGK)同样可以被SA类似物BTH诱导表达,进而激发活性氧爆发和超敏反应[61]。由此可见,植物细胞信号路径调控小麦赤霉病抗性是一个非常复杂的过程。到目前为止,关于小麦第二信使在抗赤霉病方面的作用机制研究相对较少,仍需进一步深入研究。
1.3 识别应答与赤霉病抗性
植物在与病原菌长期共同进化的过程中,也逐步形成了一系列复杂而精密的防卫机制来抵御病原菌的侵染。植物的防卫机制主要通过两种识别策略来抵御病原体的侵染。第一种识别发生在宿主细胞的外表面,被称为病原相关分子模式(pathogen associated molecular pattern,PAMPs)。它主要通过细胞表面的模式识别受体PRRs(pattern recognition receptor)识别病原菌或微生物相关分子或者是因病原菌侵染而释放的自我信号,如损伤相关分子模式(damage-associated molecular pattern,DAMP)进而引发模式识别受体免疫反应(PRR-triggered immunity,PTI)。第二种识别则是植物自身进化出了一些抗性蛋白以识别病原菌分泌到宿主细胞内的毒性效应因子,从而引发了效应因子激发免疫(effector-triggered immunity,ETI)。在植物中,模式识别受体分为两类:一类是类受体激酶(receptor-like kinases,RLKs);另一类是类受体蛋白(receptor-like proteins,RLPs)。目前在植物中已经发现多个模式识别受体,像BAK1(BRII-associated kinase1)[62]、BRI1(brassino steroid-insensitivel 1)[63]、FLS2(flagellin sensitive 2)[64]。这些受体蛋白已经被报道在植物免疫反应中扮演非常重要的功能,然而关于模式识别受体在小麦抗赤霉病方面的研究却鲜有报道。Jiang等[65]首次发现并报道了禾谷镰孢菌孤儿蛋白Osp24通过与小麦孤儿蛋白TaFROG竞争性结合激酶SnRK1,从而引起小麦感病的机制,这为我们了解小麦-禾谷镰孢菌之间的识别机制提供了一个新的视角。未来,小麦-禾谷镰孢菌模式识别受体的发现以及详细的识别机制将是研究的重点,其对于靶向药物研制以及防治小麦赤霉病具有非常重要的意义。
病程相关蛋白是植物应对病原菌侵染的一类水溶性蛋白,其可攻击病原物、降解细胞壁、降解毒素等,在植物的抗病过程中,发挥着重要的作用,像PR1(PR protein1)、PR2(endo-1,3-β-glucosidase)、PR3(chitinase)、PR4(hevein-like protein)、PR5(thaumatin-like protein)等。Pritsch等[66]发 现在禾谷镰孢菌侵染6~12 h,病程相关基因PR1、PR2、PR3、PR4和PR5的表达量开始上升,在侵染36~48 h表达量达到最大。Cheng等[67]利用生防菌木霉几丁质酶基因ECH42构建抗体融合蛋白基因ECH42-CWP2,并将其转入小麦栽培品种郑麦9023,结果发现可以显著提高转基因小麦赤霉病抗性。Shin等[68]将一个大麦几丁质酶基因转入小麦,发现可以显著提高转基因小麦赤霉病抗性。Mackintosh等[69]将类甜蛋白基因tlp-1和β-1,3-葡聚糖酶基因导入小麦,发现转基因植株提高了对赤霉病的抗性。此外,像ABC转运蛋白基因(TaPDR7、TaABCC3)、抗菌蛋白类基因(lactofer-rin、TaLTP5)、抗 病 相 关 转 录 因 子(TaPIEP1、TaNACL-D1、TaWRKY45、TaWRKY70)等都参与了小麦响应禾谷镰孢菌的过程,并在这个过程中发挥着重要的作用[32,70-76]。
1.4 次生代谢物合成与赤霉病抗性
植物次级代谢是植物合成生命非必需物质的过程。次级代谢产物种类繁多,像酚类、萜类及含氮化合物等。次级代谢物在植物的生命活动中扮演着非常重要的作用,如抵抗逆境胁迫、抵御病原菌侵染以及调控生长发育等。在禾谷镰孢菌侵染小麦的过程中,双方都会产生一系列的次级代谢产物,如单端孢霉烯类毒素、黄酮类代谢物、胆碱类物质、酚胺类代谢物、苯丙氨酸解氨酶(PAL)、谷胱甘肽S-转移酶等,进而影响小麦赤霉病的发生和发展[11,13]。
单端孢霉烯类毒素是禾谷镰孢菌在侵染小麦过程中产生的一种次级代谢物,可以促进禾谷镰孢菌在小麦组织中的扩展,加剧小麦赤霉病的发生。降低或减缓禾谷镰孢菌侵染过程中DON毒素的产生水平和积累,可以帮助寄主有效阻止禾谷镰孢菌在组织内的延展。目前,与DON毒素积累相关的QTL已经被大量报道,其主要分布在染色体1B、2B、2D、3B、3D、4B、5A、5B和6A[77-79]。一些参与抗或降解DON毒素的基因也被挖掘,其中主要为UDP-葡萄糖基转移酶,像HvUGT13248、TaUGT4、Traes_2BS_14CA35D5D、Ta-UGT3、TaUGT5,可以显著降低DON毒素的水平,解除DON毒素的毒害作用。此外,将DON毒素合成路径中的乙酰基转移酶FsTRI101转入小麦,也可以提高小麦赤霉病抗性[80-87]。谷胱甘肽转移酶(glutathione S-transferase,GSTs)可以催化谷胱甘肽与有毒化合物或其氧化产物结合,从而引起有毒化合物毒性丧失。Wang等[11]从长穗偃麦草中克隆了抗赤霉病主效基因Fhb7,并揭示其编码一种谷胱甘肽转移酶,该酶不仅可以大大降低DON的毒性,对其他单端孢霉烯族毒素也具有广谱的解毒作用。抗DON毒素积累、解毒基因的发现,以及其在生产上的应用对于提高小麦赤霉病抗性和人类健康具有非常重要的意义。
此外,还有其他的次级代谢产物参与了小麦抵抗禾谷镰孢菌的过程。Kong等[88]通过筛选小麦品种宁7840构建额消减杂交文库,发现几丁质酶、细胞色素P450等次级代谢物的表达水平受到诱导。马璐琳[89]发现苯丙氨酸解氨酶(PAL)、谷胱甘肽S-转移酶等次生代谢物质受到DON毒素的诱导。Su等[13]通过代谢物分析发现黄酮类、酚类以及胆碱类次生代谢物参与了小麦抵抗禾谷镰孢菌的过程。Karre等[90]证明HvWRKY23可以通过调控黄酮和羟基肉桂酸酰胺(HCAA)生物合成基因影响赤霉病抗性。综上,次级代谢产物在小麦赤霉病抗性过程中扮演着非常重要的角色,但是具有抗性的次级代谢产物及其抗性机制仍需进一步的挖掘和研究。其抗性机制的揭示可为小麦抗赤霉病及抗毒素积累的分子育种提供理论和实践指导,并可能开辟出一条新的品种改良途径。
综上所述,虽然对于小麦赤霉病抗性机制还没有非常清晰的了解,然而,在小麦赤霉病研究工作者的努力下,也取得了非常多的进展,挖掘到了一些关键的小麦赤霉病抗性基因及调控路径,并培育了一些小麦抗赤霉病品种。我们对历年来经过验证的小麦抗赤霉病基因进行了总结,具体见表1。在此基础上,我们初步构建了小麦抗赤霉病分子调控网络,具体见图1。希望这可以为在小麦抗赤霉病遗传改良过程中利用优异抗赤霉病基因资源提供理论储备,加深对小麦赤霉病机制的了解以及对未来的研究方向提供参考。

图1 小麦抗赤霉病分子调控网络Fig.1 Molecular network for wheat resistance to FHB

表1 小麦抗赤霉病相关基因Table 1 The genes for wheat resistance to FHB
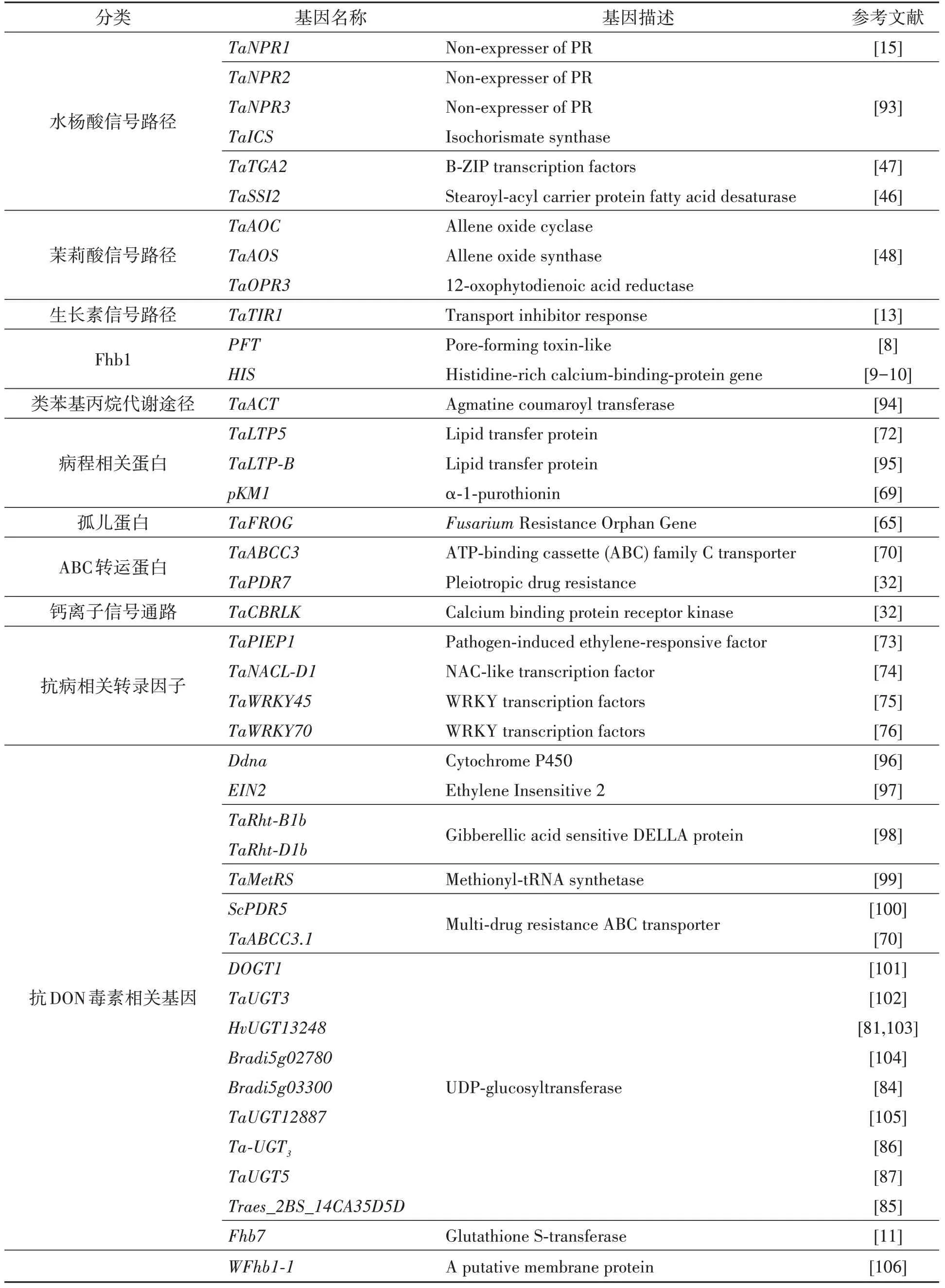
续表
4 展望
赤霉病不仅严重影响小麦产量,而且发病过程中,会产生多种霉菌毒素,严重影响小麦品质。由于小麦赤霉病抗源稀缺,小麦基因组的庞大以及赤霉病抗性机制的复杂,使得小麦赤霉病抗性基因的挖掘相对困难。在过去的几十年,小麦赤霉病研究工作者已经挖掘到了大量与小麦赤霉病抗性相关的QTL位点,分布在小麦所有染色体上。然而,目前我们已经明确的小麦赤霉病抗性基因只有7个(Fhb1~Fhb7)[7],其中,仅有Fhb1和Fhb7基因被克隆。小麦基因组信息的不断完善以及测序技术的飞速发展为图位克隆和全基因组关联分析方法开发抗赤霉病分子功能标记以及主效QTL的精细定位、基因克隆提供了便利,这将极大丰富可用于抗赤霉病分子标记辅助选择育种的功能标记,并对进一步揭示小麦赤霉病抗性机制提供重要线索。与此同时,随着多组学联合分析、小麦遗传转化以及基因编辑等生物技术的发展,使得研究小麦赤霉病抗性机制可借助的手段越来越多。借助转录组及蛋白组分析,挖掘出响应禾谷镰孢菌侵染的多种代谢通路及调控基因;借助代谢组学技术,鉴定多种具有抗赤霉病功能的天然代谢产物;小麦遗传转化体系以及基因编辑技术的成熟,加快了小麦抗赤霉病关键基因的分子功能验证和优异抗性基因在育种中的应用。
综上所述,在此基础上,利用分子设计辅助育种策略对抗性基因以及代谢通路进行改造,对于绿色、高效防治小麦赤霉病以及活性天然代谢产物的人工合成提供解决方案,并逐步形成小麦抗赤霉病基因的分子调控网络。但是,目前我们对于小麦赤霉病抗性机制的了解还处于相对浅显的层面,还有许多没有深入研究的领域,例如,小麦-禾谷镰孢菌受体模式识别及互作的机制[107],调控小麦赤霉病抗性的miRNA的发现及作用机制,植物激素之间相互作用的协同或拮抗调控机制,ROS参与小麦赤霉病抗性机制等。未来这些方向的研究和探索将为我们进一步揭示赤霉病抗性机制以及将其应用于小麦抗赤霉病品种遗传改良上提供非常重要的信息。
