白肉灵芝水提物对脑缺血后大脑神经元损伤的保护作用
2021-10-18何九军王逸璇
王 昱,秦 序,何九军,王逸璇
(1.陇南师范高等专科学校农林技术学院,甘肃 成县 742500;2.陇南特色农业生物资源研究开发中心,甘肃 成县 742500;3.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
脑缺血性疾病是由于脑血管闭塞、血栓形成、动脉粥样硬化等因素导致部分脑组织的血流减少或中断引起脑细胞损伤坏死和神经功能障碍的疾病,已成为发病率和死亡率极高的多发病和常见病[1].目前,关于脑缺血性疾病的治疗常采用溶栓、脑血管支架植入、抗凝、抗血小板聚集、改善脑循环等方法,来降低脑组织损伤程度和延长脑神经元的寿命,但后续治疗的药物却相对有限.近年来研究发现,神经细胞凋亡是缺血性脑损伤的重要机制[2].B淋巴细胞瘤-2(B-cell lymphoma-2,BCL2)是目前研究明确的抗凋亡基因[3].基于抗凋亡因子在神经元损伤发挥保护作用的重要性,抗凋亡治疗已成为目前研究治疗脑缺血疾病的热点.碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)在脑缺血后促进细胞增生分化和血管再生,阻止细胞凋亡,营养神经元,修复受损的脑组织[4].磷酸化糖原合酶激酶3β(phospho-glycogen synthase kinase 3β,p-GSK-3β)是一种丝氨酸/苏氨酸蛋白激酶,在脑缺血中发挥着促细胞凋亡作用[5].因此,开发一些有效预防脑缺血性疾病的功能性生物食品对神经功能退行性疾病的防治有十分重要的作用.
白肉灵芝是我国灵芝属中的一个重要种类,其菌肉洁白,多糖和三萜等活性成分含量较高,被视为高品质的灵芝种类[6].白肉灵芝在过去很长时间内被认为是亮盖灵芝或漆光灵芝,至到2015年才被李泰辉等[7]鉴定为灵芝属的新种,因此有关白肉灵芝的研究资料不多.目前,白肉灵芝活性成分的研究主要集中在其水提化合物和三萜类化合物的功能方面.熊川等[8-9]研究发现,白肉灵芝水提物能有效促进PC-12细胞分化,对H2O2诱导的PC-12细胞凋亡有保护作用.本课题组前期研究表明,白肉灵芝水提物(Ganodermaleucocontextumaqueous extracts,GLAE)在增加皮肤弹性和减少皮肤皱纹形成方面有着重要作用[10].为了进一步探讨GLAE的生物学作用,本研究利用大鼠双侧颈总动脉夹闭法建立脑缺血模型,运用免疫组化方法、Western blot及PCR等技术研究GLAE对脑缺血后大脑神经元的保护作用,以期为GLAE的临床应用提供实验依据.
1 材料和方法
1.1 试剂及仪器
白肉灵芝为本实验室培养,根据文献[10]制备为白肉灵芝水提物.鼠单克隆抗体p-GSK-3β(购自Abcam公司,批号为ab93926);β-actin(Cell signaling 公司,批号4970L);HRP 标记山羊抗兔IgG(Servicebio公司,批号 GB23303);RNA抽提试剂盒、反转录试剂、实时荧光定量PCR试剂(Taka Ra公司);引物(北京赛百盛基因技术有限公司).
主要仪器设备:DYCPZ 型电泳槽、DYY-IB 型电泳仪(北京市六一仪器厂);DKZ系列恒温水浴箱(上海一恒科技有限公司);TGL-16M高速台式冷冻离心机(美国Beckman-coulter公司);Nikon FX-35WA显微镜(日本Nikon公司);7900 HT Sequence Detection System定量PCR仪(美国ABI公司).
1.2 动物模型建立与给药
健康SD大鼠50只,雌雄各半,体质量200~250 g,由兰州大学实验动物中心提供,生产许可证:SCXK (甘) 2005-0007.在恒温(21 ~23 ℃)、恒湿( 45%~ 65% )、12 h明暗周期的饲养室,全价颗粒饲料喂养,自由进食和饮水.正常饲养7 d 后随机分为5组,每组10只:对照组、模型组、GLAE低、中、高剂量组[50、100、200 mg/(kg·bw)].模型组和GLAE组大鼠腹腔注射3.5%水合氯醛(0.1 mL/kg),分离左、右颈总动脉,用动脉夹夹闭 20 min,然后打开动脉夹,缝合切口.对照组仅分离双侧颈总动脉,不进行夹闭.24 h 后,GLAE低、中、高剂量组分别均按10 mL/(kg·bw)灌胃(以体质量计)GLAE[10],1 次/d,连续处理2周.对照组与模型组给予等体积生理盐水.
1.3 免疫组织化学法观察大脑组织p-GSK-3β蛋白的表达
采用免疫组化SP法(链霉菌抗生物素蛋白—过氧化物酶连结法):末次给药后,取大鼠大脑额叶数块,用4%多聚甲醛-PBS 固定,经石蜡包埋后冠状位切片,厚6 μm,常规脱水、抗原修复后,室温封闭 30 min.然后滴加p-GSK-3β抗体(1︰200),4 ℃过夜,次日PBS 洗涤3次.同法滴加生物素化羊抗兔IgG(1∶2 000)37 ℃ 孵育30 min,常规DAB显色.苏木素复染后用中性树胶封片,空白对照以PBS代替一抗.用美国Image-proplus 5.0专业图像分析软件进行p-GSK-3β阳性反应图像分析,取平均光密度和积分光密度两个指标进行测量,测量值的平均值为最终灰度值.
1.4 Western blot 检测BCL2蛋白的表达
取大脑额叶组织,加入RIPA 裂解液制成 10%的组织匀浆,4 ℃ 1 200 r/min离心15 min,提取大脑皮层组织总蛋白,BCA法测定蛋白质浓度.聚丙烯胺凝胶电泳(SDS-PAGE)、转膜并封闭.按抗体说明书加入兔抗鼠一抗 β-actin(1∶2 000)、BCL2(1∶2 000),4 ℃过夜,充分洗涤,加偶联辣根过氧化物酶(HRP)的二抗IgG(1∶2 000),ECL显色.运用Image Lab4.1 图像分析,以BCL2蛋白与β-actin 条带灰度比值表示BCL2蛋白的相对表达水平.
1.5 PCR检测bFGF mRNA的表达
取大脑额叶皮层组织,加入Trizol后在冰浴中匀浆,4 ℃ 12 000 r/min离心 15 min,取上清液通过酚-氯仿抽提RNA.将抽提的RNA 进行逆转录反应,实时荧光定量PCR扩增.PCR按照试剂盒说明书进行操作.反应完毕采用 ABI 7500 软件分析,用公式 2-△△Ct方法进行相对定量.目的基因引物序列见表1.

表1 目的基因引物序列
1.6 数据处理
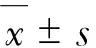
2 结果
2.1 GLAE对脑缺血大鼠大脑组织p-GSK-3β蛋白表达的影响
由图1可知,p-GSK-3β蛋白表达在大鼠大脑皮质神经元的细胞核和细胞浆中,阳性部位被染成棕黄色.由表2可知,模型组大鼠大脑组织p-GSK-3β蛋白表达的细胞数量显著增加,与对照组比较差异极显著(P<0.01),与GLAE低、中、高剂量组比较差异也极显著(P<0.01).GLAE低、中剂量组大鼠大脑组织p-GSK-3β表达的细胞数量显著降低,但与对照组比较差异显著(P<0.05,P<0.01).GLAE高剂量组大鼠大脑组织p-GSK-3β蛋白表达的细胞数量显著降低,与对照组比较无显著差异(P>0.05).阴性对照组无p-GSK-3β蛋白阳性表达.

注:A.对照组;B.模型组;C.GLAE低剂量组;D.GLAE中剂量组;E.GLAE高剂量组;F.阴性对照组;“→”表示阳性细胞.
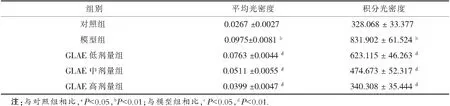
表2 各组大脑皮层p-GSK-3β表达的比较
2.2 GLAE对脑缺血后大脑组织BCL2蛋白表达的影响
由图2可知,与对照组相比,模型组大鼠大脑组织BCL2蛋白表达水平显著降低,差异极显著(P<0.01).与模型组相比,GLAE低、中、高剂量组大鼠大脑组织BCL2蛋白表达水平显著升高(P<0.05,P<0.01).
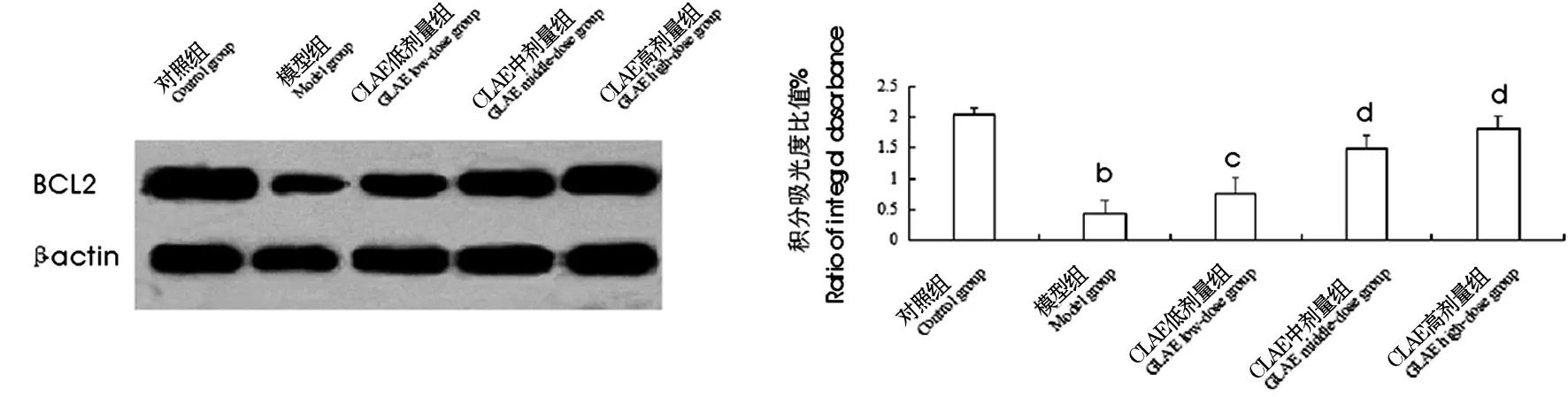
注:与对照组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01.
2.3 GLAE对脑缺血后大脑组织bFGF mRNA表达的影响
由图3可知,与对照组相比,模型组大鼠大脑组织bFGF mRNA表达量有所升高,但无统计学差异(P>0.05);与模型组比较,GLAE低、中、高剂量组大脑组织bFGF mRNA的表达水平显著上调(P<0.05,P<0.01).

注:与对照组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01.
3 讨论
脑缺血性疾病是多种机制、多种因素参与的一种复杂病理生理过程.脑缺血损伤后,如何促进局灶性脑缺血区的血管新生及侧支循环形成,对治疗缺血性脑血管病具有重要意义.目前,治疗采用的主要措施有抗血栓、改善脑组织血流量及能量代谢、减轻自由基损伤、抑制炎症反应和细胞凋亡等,而抗凋亡治疗已成为治疗脑缺血疾病的重要途径.研究发现,在脑缺血过程中,抗凋亡基因BCL2可阻断Caspase凋亡级联反应,从而发挥抗凋亡的作用[11].本实验研究显示,模型组大鼠大脑组织BCL2蛋白表达极显著降低,表明其抑制神经元凋亡的作用下降,加速了神经元的凋亡,这与以往研究结果一致[11].GLAE干预后,大脑组织BCL2蛋白的表达水平显著增加,Sun等[2]研究也发现,上调BCL2基因的表达,可减少神经细胞的凋亡,这表明通过调节BCL2蛋白的高表达可发挥其保护脑组织的作用.这种作用可以作为一种后期治疗脑缺血损伤的途径和方法.
GSK-3β是一种丝氨酸/苏氨酸蛋白激酶(Akt),在进化过程中它非常保守,普遍存在于真核细胞[12].当GSK-3β被磷酸化成p-GSK-3β后,参与调节细胞分化、增殖以及凋亡等生理反应[5].近年来的脑缺血研究显示,脑源性神经生长因子和胰岛素样生长因子能激活GSK-3β活性,影响下游β-连环蛋白和BCL2等底物的表达[13].bFGF具有多种生物学活性,正常生理状态下,脑内的表达量较少.在脑缺血时,随着bFGF表达量升高,神经元突起生长[4],血管内皮细胞分化、分裂,组织再生修复,毛细血管形成,凋亡的神经细胞数量减少,受损中枢神经系统的功能逐渐恢复[14-16].而有研究认为,bFGF在脑缺血时的保护机制与BCL2基因表达、抑制细胞凋亡有关[17-18].因此,GSK-3β和BCL2是缺血性脑损伤中重要的蛋白因子,其生理效应主要与生长因子信号通路密切相关[19].本实验研究显示,大鼠在受到缺血损伤刺激后,大脑组织内的bFGF表达应激性增加,能够发挥其修复神经元的作用.大脑组织p-GSK-3β蛋白表达的细胞数量显著增加,而BCL2蛋白表达量显著降低,可抑制缺血性脑损伤的保护效应[20].给予GLAE干预后,大鼠大脑组织内bFGF mRNA的表达进一步增强.结合大脑组织BCL2蛋白表达水平升高及p-GSK-3β表达的细胞数量显著降低,说明GLAE改善脑缺血造成的损伤并对受损脑组织起到的保护作用与bFGF、p-GSK-3β和BCL2有关联性.
4 结论
综上所述,GLAE对脑缺血后大脑神经元损伤有一定的保护作用,其机理可能与促进大脑组织BCL2蛋白和bFGF mRNA表达及抑制p-GSK-3β蛋白表达有关.此研究有助于脑神经修复和再生,可为GLAE的临床应用提供实验依据.
