可可茶及其优势化学成分的健康功效研究进展
2021-10-16吴文亮童彤胡瑶周浩银霞张曙光
吴文亮,童彤,胡瑶,周浩,银霞,张曙光*
可可茶及其优势化学成分的健康功效研究进展
吴文亮1,童彤1,胡瑶2,周浩1,银霞1,张曙光1*
1. 湖南省农业科学院茶叶研究所,湖南 长沙 410125;2. 湖南省农业科学院核农学与航天育种研究所,湖南 长沙 410125
可可茶为我国特异的茶树资源,可可茶及其优势化学成分可可碱(TB)与没食子儿茶素没食子酸酯(GCG)具有多种健康功效。综述了可可茶、TB和GCG对心血管疾病、癌症、肥胖症、糖尿病、神经退行性疾病、牙科疾病、呼吸疾病和肾病等的干预作用,并简要分析了其作用机制,旨在为可可茶相关功能产品研发提供理论参考。
可可茶;可可碱;没食子儿茶素没食子酸酯;健康功效
可可茶(Chang)原名为南昆山毛叶茶,原始分布区在广东的龙门、从化、增城三县市交汇处的南昆山。可可茶茶树资源由植物分类学家张宏达教授发现,并在1981年根据曾沛先生采集提供的标本,发表了这个茶组植物新种,认为可可茶在系统分类上属于山茶科山茶属茶亚属茶组茶系,它和传统的栽培茶树有密切的亲缘关系,均同属于茶系的种[1-2]。自20世纪80年代末,张宏达、叶创兴等研究团队对可可茶进行了跟踪研究,发现可可茶是我国一种特异的茶树资源,其生物碱组分由可可碱(Theobromine,TB)占主导,含量最高可达6.8%,约为传统茶树资源的18倍;儿茶素组分由没食子儿茶素没食子酸酯(Gallocatechin gallate,GCG)占主导,含量最高可达9.88%,约为传统茶树资源的7倍[3]。可可茶具有一些健康功效,在整理前人研究成果的基础上,本文综述了可可茶及其优势化学成分TB与GCG健康功效的研究进展及主要作用机制,为可可茶资源的创新利用或相关功能产品的研制提供一定的参考。
1 可可茶的健康功效
长期以来,可可茶原产地百姓认为其具有消炎、助消化、预防感冒等作用,目前大量研究证实了可可茶在抗癌、降脂减肥、抗氧化和消炎等方面的功效[4-17](表1)。
1.1 可可茶的抗癌作用
可可茶提取物具有抗癌作用。Peng等[4]通过体外试验发现,可可茶能下调人前列腺癌细胞(PC-3)的肿瘤抑制基因(p21和p27)表达,上调细胞凋亡途径的Bax/Bcl-2基因比率,并抑制NF-κB活化,将癌细胞周期阻滞于G2/M期引起凋亡,从而显著地抑制癌细胞生长;体内试验发现,可可茶处理组的裸鼠PC-3肿瘤的重量和体积均显著低于对照组,表明可可茶在抗前列腺癌方面具有一定作用。Yang等[5]研究发现,可可绿茶能下调人肝癌细胞(HepG2)细胞的肿瘤抑制基因(p53、p21和p27)表达和上调细胞凋亡途径的Bax/Bcl-2基因比率,促使癌细胞凋亡和抑制癌细胞生长;体内HepG2移植裸鼠模型试验发现,可可绿茶处理组的裸鼠肿瘤的重量和体积以剂量依赖性方式显著降低,表明可可茶具有一定的抗肝癌作用。Gao等[6]研究可可绿茶水提物对人结肠癌细胞(HCT116)和HCT116移植裸鼠的影响,发现与云南大叶种绿茶提取物相比,可可茶表现出更强的抗增殖和诱导细胞凋亡作用,且能显著抑制HCT116肿瘤小鼠的肿瘤生长,其抗结肠癌的机制可能是上调细胞凋亡途径的Bax/Bcl-2基因比率和下调PI3K/Akt信号通路,引起线粒体功能紊乱致使细胞凋亡。此外,可可茶对其他肿瘤也有抑制作用[7],如小鼠艾氏腹水癌细胞(EAC)、人宫颈癌细胞(HeLa)、人鼻咽癌细胞(CNE2)和艾氏腹水癌实体瘤(ESC)。
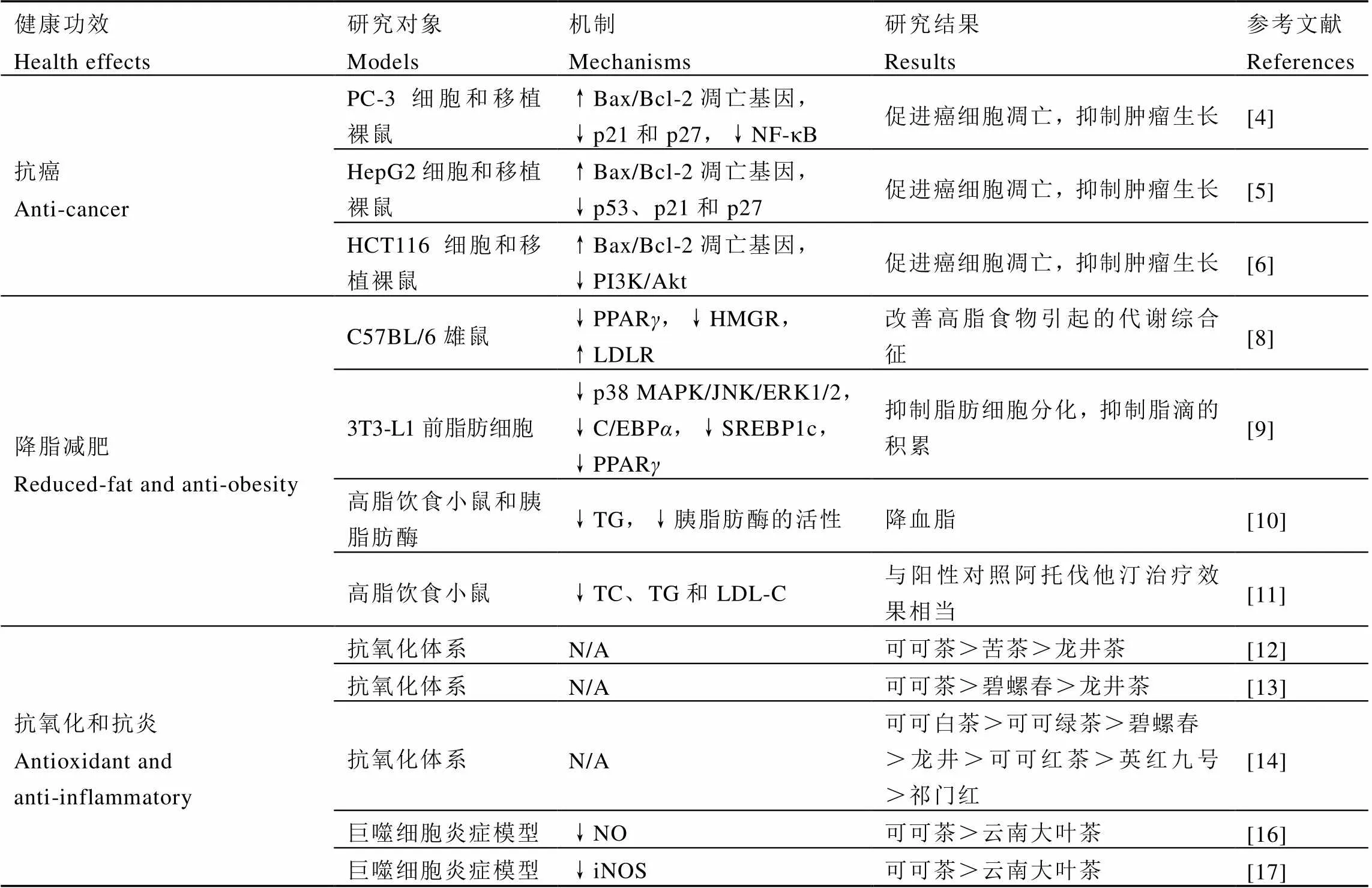
表1 可可茶的健康功效
注:“↑”表示上调,“↓”表示下调,“N/A”表示未明确。下同
Note: “↑” and “↓” indicate up-regulation and down-regulation, respectively. “N/A” means that there is not available. The same below
1.2 可可茶的降脂减肥作用
可可茶具有降脂减肥效果。Yang等[8]以C57BL/6雄鼠为研究对象,将不同剂量的可可绿茶提取物添加到高脂食物中,研究可可茶对高脂饮食引起的代谢综合征影响。结果表明,可可茶对小鼠的肥胖、肝脂肪变性和高脂血症等均有改善效果,与高脂饮食组相比,高剂量可可茶能显著降低过氧化物酶体增殖物激活受体(Peroxisome proliferators-activated receptors,PPAR)和3-羟基-3-甲基戊二单酰辅酶A还原酶(3-Hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)的mRNA水平,同时显著升高低密度脂蛋白受体(Low-density lipoprotein receptor,LDLR)的mRNA水平。肥胖发生的典型特征是脂肪组织的增加,而脂肪组织增加是由脂肪细胞分化和增生引起的,因此,抑制脂肪细胞分化是控制肥胖的关键。Li等[9]采用3T3-L1前脂肪细胞探究可可茶对脂肪形成的抑制作用,结果发现可可茶可以显著抑制细胞的脂滴积累和甘油三酯(Triglyceride,TG)产生,其机制是通过抑制p38分裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、c-Jun氨基末端激酶(C-Jun N-terminal kinase,JNK)和细胞外信号调节激酶(Extracellular signal-regulated kinase1/2,ERK1/2)磷酸化来降低关键脂肪形成转录因子CAAT区/增强子结合蛋白(C/EBPα)、固醇调节元素结合蛋白1c(SREBP1c)和PPAR的mRNA水平,从而抑制脂肪形成。Kurihara等[10]认为500 mg·kg-1的可可茶提取物可以明显抑制小鼠高脂饮食后的血浆中TG水平,并通过体外试验证实可可茶提取物能抑制胰脂肪酶的活性。而Li等[11]研究发现,400 mg·kg-1可可茶提取物在1个月内能明显降低高脂饮食诱导的肥胖小鼠的TC、TG和LDL-C水平,与阳性对照组阿托伐他汀(Atorvastatin)治疗效果相当。
1.3 可可茶的抗氧化和抗炎症作用
氧化应激和炎症都与一些慢性疾病有关,如癌症和肥胖症等。因此,研究可可茶的抗氧化和抗炎特性有助于了解其抗肥胖和抗癌的作用。Li等[12]采用两种抗氧化体系(FRAP法和DPPH法)评价可可茶与龙井茶、苦茶水提物的体外抗氧化活性,两种测定方法均表明可可茶具有更强的抗氧化活性,抗氧化活性大小依次为可可茶>苦茶>龙井茶,与这3种茶的茶多酚含量多少规律一致,说明茶叶的抗氧化能力与茶多酚含量有一定的正相关。而彭力[13]采用3种抗氧化体系,即清除自由基能力(ABTS法和DPPH法)和抑制脂质过氧化法(FTC法)评价可可茶与普通绿茶水提物的体外抗氧化活性,结果显示抗氧化活性大小依次为可可茶>碧螺春>龙井茶。同样,Peng等[14]也采用了ABTS法、DPPH法和FTC法测定了7种茶的抗氧化活性,3种测定方法结果均为可可白茶>可可绿茶>碧螺春>龙井>可可红茶>英红九号>祁门红,HPLC检测结果显示,可可白茶的茶多酚含量最高。
一氧化氮(Nitric oxide,NO)是炎症反应过程中的重要介质和调节因子,能够杀灭侵入机体的病原微生物,维持机体正常的免疫防御功能,但过量NO对宿主细胞也会产生损伤作用[15]。Lin等[16]通过脂多糖(LPS)诱导的巨噬细胞(RAW 264.7)建立炎症细胞模型,比较可可茶与云南大叶茶的体外抗炎活性,发现可可茶比云南大叶茶更能抑制NO的产生,说明可可茶的抗炎活性强。研究已证实生物体内NO生成的唯一途径是由一氧化氮合酶(iNOS)催化-精氨酸合成,因此抑制iNOS的过量表达可以控制NO的水平[15]。Gao等[17]研究发现,可可茶与云南大叶茶均能以剂量依赖性的方式抑制iNOS的表达水平,而且可可茶对iNOS的抑制效果比云南大叶茶更突出,说明可可茶能够通过抑制iNOS表达来降低NO水平,从而起到抗炎的功效。
2 可可茶优势化学成分的健康功效
可可茶有着突出的健康功效,这不仅与其茶多酚含量高有关,也与其独特的生物碱组成模式(以TB为代表)和儿茶素组成模式(以GCG为代表)有很大关系,现有研究均表明TB和GCG具有一定的保健功效。
2.1 TB的健康功效
大量研究表明,TB对心血管疾病、癌症、肥胖症、神经退行性疾病、牙科疾病、呼吸疾病和肾病等有积极干预与治疗作用[18-60](表2)。
2.1.1 TB的保护心脏作用
TB是一种血管舒张剂,能够缓解由心绞痛引起的疼痛,在1959年就用于治疗充血性心力衰竭和心绞痛综合征[18]。在大规模的流行病学研究中发现血液中高密度脂蛋白胆固醇(HDL-C)浓度与患冠心病风险成反比[19],HDL-C具有胆固醇逆向运输作用[20],胆固醇逆向运输可以将过量的胆固醇从动脉血管壁细胞排出体外来阻止泡沫细胞的形成,从而抑制动脉粥样硬化的发生(动脉粥样硬化主要发生在心脏部位)。血液中HDL-C含量的减少会带来心血管疾病风险,而研究发现TB有增加HDL-C水平的作用,其机制是TB通过抑制磷酸二酯酶(Phosphodiesterase,PDE)增加cAMP(Cyclic nucleotide phosphodiesterases)水平,细胞的cAMP会加强ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)的活性,ABCA1将磷脂和胆固醇在内的脂类向细胞外运输,然后与细胞外的脂类受体载脂蛋白A-I(Apolipoprotein A-I,apoA-I)结合形成初生高密度脂蛋白(Nascent HDL)[21],通过这种方式,TB促使HDL-C水平升高发挥保护心脏的作用。Neufingerl等[22]研究表明,每天摄入850 mg的TB可使健康受试者的HDL-C浓度显著增加0.16 mmol·L-1。
2.1.2 TB的抗癌作用
在抗癌方面,TB主要是干扰肿瘤的血管生成,减少新血管的形成,抑制肿瘤细胞转移。血管生成在癌细胞的生长和转移中起着主要作用,Barcz等[23]研究结果显示,TB对卵巢癌的血管生成活性有明显的抑制作用,并减少了血管内皮生长因子(Vascular endothelial growth factor,VEGF)的产生,但对碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)和白细胞介素-8(Interleukin-8,IL-8)的产生无影响,认为TB可能是卵巢癌血管生成的有效抑制剂,其作用机制与抑制VEGF的产生有关。Skopińska-Rózewska等[24]在无免疫抑制的小鼠体内接种人类肺癌细胞,发现TB明显抑制了人类肺癌细胞VEGF和bFGF的生成。
Gil等[25]通过研究腺苷受体拮抗剂苏拉明(Suramin,SN)和TB在BALB/c小鼠皮内接种E14/W肺癌细胞后的抗血管生成活性发现,SN和TB都能抑制与肿瘤有关的血管生成,因此认为TB可能是腺苷受体拮抗剂。Barcz等[26]研究发现,TB作为腺苷受体拮抗剂,能抑制卵巢癌细胞以及从卵巢癌患者腹腔腹水中分离的CD45阳性淋巴细胞的血管生成活性,通过使用合成的腺苷受体拮抗剂(8-苯基茶碱和8-环戊基-1,3-二丙基香碱),发现TB的抗血管生成特性依赖于与腺苷受体A2(Adenosine receptor A2,AR2)的相互作用。
另外,TB在恶性胶质母细胞瘤的增殖中显示出抗肿瘤潜力,这种作用由磷酸二酯酶4(PDE4)的负调控引起,促进cAMP水平升高,降低p38 MAPK和JNK活性,同时减弱p44/42细胞外信号调节激酶(p44/42-ERK)活性和抑制蛋白激酶B(Protein kinase B,PKB)/雷帕霉素靶蛋白(Mammalian target ofrapamycin,mTOR)/核因子-κB(NF-κB)信号途径[27]。TB也可以通过调控与生长途径有关的凋亡基因来控制肿瘤细胞的增殖,Bcl-2(B-cell lymphoma-2)基因是细胞凋亡抑制基因,而Bax(BCL2-Associated X)基因是促进细胞凋亡的功能基因。Carla-Cadoná等[28]发现TB对人结肠癌细胞(HT-29)具有抗增殖活性,在暴露于TB的HT-29细胞中,癌细胞的增殖速率降低,细胞凋亡途径的基因Bax/Bcl-2上调。
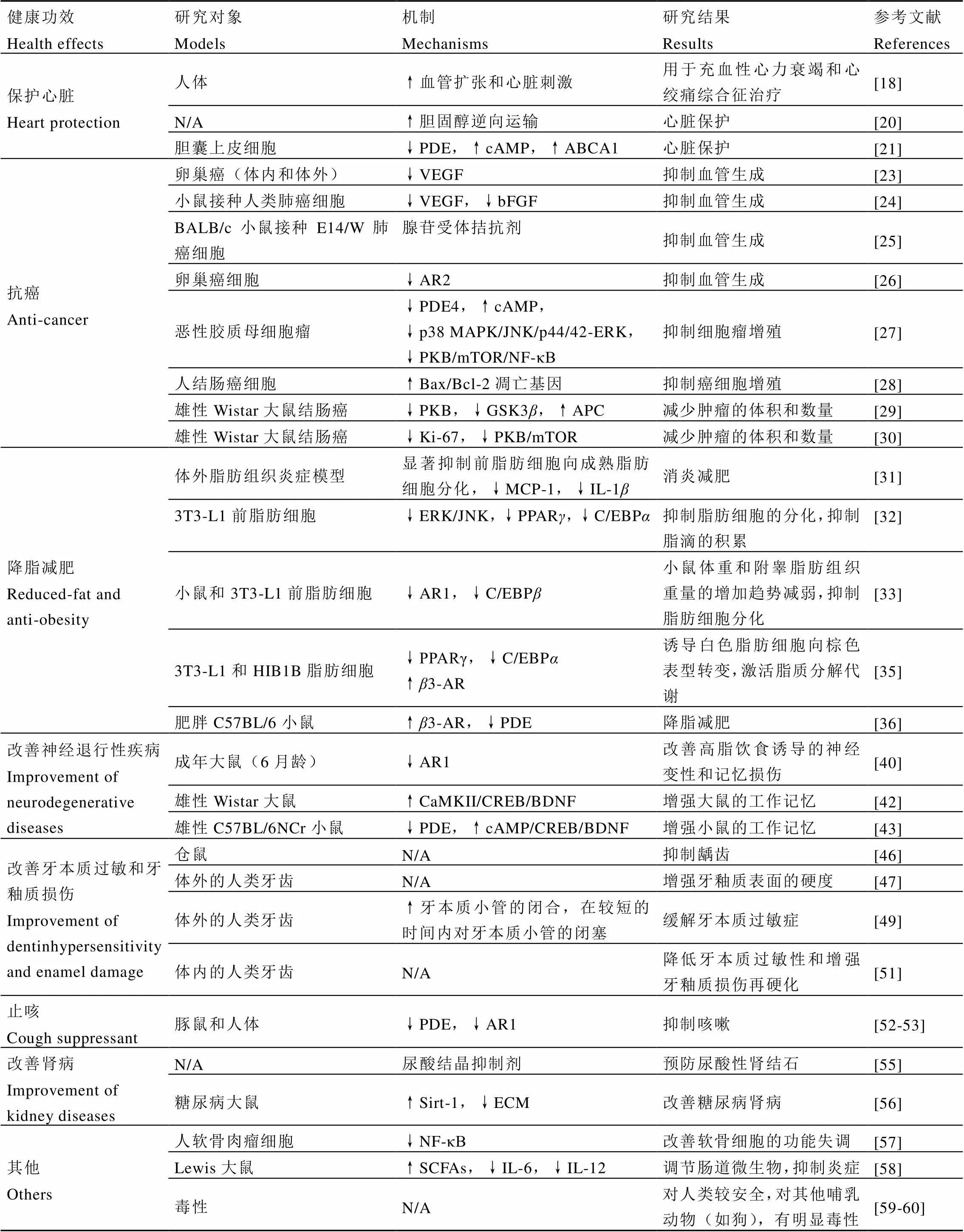
表2 可可碱的健康功效
TB对大肠肿瘤的化学预防也有效果。Shojaei-Zarghani等[29]研究了TB对二甲基肼(Dimethylhydrazine,DMH)诱发的雄性Wistar大鼠结肠癌的影响,发现TB在200 mg·kg-1的剂量下,能减少肿瘤的体积和数量,抑制蛋白激酶B(PKB)和糖原合成酶激酶-3(Glycogen synthase kinase-3,GSK3)的磷酸化,同时增加腺瘤性结肠息肉病(Adenomatous polyposis coli,APC)肿瘤抑制因子的表达。随后该研究团队评估了单独使用和联合使用茶氨酸、TB对DMH诱导的雄性Wistar大鼠结肠癌的化学预防作用,结果表明,茶氨酸、TB以及联合给药都可以预防DMH诱导的结肠癌发生,与单独服用茶氨酸或TB相比,同时服用茶氨酸和TB后,PKB和mTOR的mRNA及蛋白表达水平明显降低;与茶氨酸相比,TB处理对细胞增殖标记蛋白(Ki-67)和PKB/mTOR抑制表达效果更好[30]。
2.1.3 TB的降脂减肥作用
肥胖症被认为是慢性炎症状态。巨噬细胞和促炎性细胞因子在脂肪组织炎症中的作用受到越来越多的关注。Fuggetta等[31]在体外脂肪组织炎症模型中分析TB对脂肪生成和促炎性细胞因子的影响,结果显示,TB能显著抑制前脂肪细胞向成熟脂肪细胞分化,并降低单核细胞趋化蛋白-1(Monocyte chemotactic protein 1,MCP-1)和白细胞介素-1(Interleukin-1,IL-1)等促炎性细胞因子水平;MCP-1可以激活巨噬细胞,TB则通过降低MCP-1水平来控制巨噬细胞在脂肪组织中的浸润,对治疗肥胖症有潜在的作用。
另外,TB能够通过抑制脂肪生成等相关因素来抑制3T3-L1小鼠细胞的脂肪生成和分化。Jang等[32]研究了TB抑制3T3-L1前脂肪细胞分化的作用机制,发现TB通过细胞外信号调节激酶/c-Jun氨基末端激酶(ERK/JNK)信号途径抑制3T3-L1前脂肪细胞中的PPAR活性和C/EBP的表达,从而在脂肪生成的早期阶段抑制脂肪细胞的分化。Mitani等[33]研究表明,TB能减弱小鼠体重和附睾脂肪组织重量的增加趋势,并抑制小鼠脂肪组织中脂肪生成相关基因的表达;在3T3-L1前脂肪细胞中,TB通过腺苷受体A1(AR1)途径引起C/EBP蛋白降解,TB选择性地与AR1相互作用,AR1的敲除可解除TB引起的C/EBP降解。
肥胖通常被认为是脂肪细胞(白色脂肪细胞)在体内积聚过多而形成的一种慢性疾病,哺乳动物体内主要存在3种类型的脂肪细胞,即白色脂肪细胞、棕色脂肪细胞和米色脂肪细胞。研究显示白色脂肪细胞向棕色脂肪细胞转变会增加脂肪产热和促进能量消耗,同时激活棕色脂肪细胞和米色脂肪细胞产热耗能,进而抵抗肥胖[34]。Jang等[35]通过3T3-L1白色脂肪细胞和HIB1B棕色脂肪细胞模型研究表明,TB可诱导白色脂肪细胞向棕色脂肪细胞转变,抑制白色脂肪细胞中关键的脂肪生成转录因子C/EBP和PPAR的表达,并在这两种类型脂肪细胞中通过-肾上腺素受体(-Adrenergic receptor,3-AR)和AMPK途径进行脂质分解代谢。随后Jang等[36]在肥胖C57BL/6小鼠模型中发现,TB可以通过3-AR靶点来抑制PDE活性,调节相关生化反应,诱导白色脂肪细胞的棕色化,并激活了棕色脂肪细胞的脂肪分解和产热,抵抗肥胖。
2.1.4 TB改善神经退行性疾病作用
TB具有穿越血脑屏障的能力,对神经元功能会产生明显的影响。阿尔茨海默病(Alzheimer’s disease,AD)引起痴呆的主要病理学特征是脑内和脑外淀粉样蛋白(A)和tau蛋白的累积,AD可分为散发性和家族性两类,散发性AD主要是由脂蛋白E的增加引起,脂蛋白E作为乳糜微粒的组成部分,是大脑中胆固醇的运输工具[37]。研究表明,高脂质水平,特别是胆固醇水平,与AD形成有关,AR1可能参与了对神经递质释放的抑制[38-39]。Mendiola-Precoma[40]等研究富含猪油的饮食(Lard-enriched diet,LED)对成年大鼠(6月龄)认知和记忆过程的影响,结果表明,长期富含脂肪的饮食会降低成年大鼠的认知和记忆功能,生化与基因方面表现为A、IL-1蛋白水平增加和AR1基因表达水平上升;而饲喂TB能改善LED诱导的神经变性和记忆损伤,回调AR1基因水平。
cAMP-反应元件结合蛋白(cAMP-response element-binding protein,CREB)是一种转录因子,可以被细胞质中增加的cAMP和Ca2+激活,参与不同的大脑神经过程,包括诱导脑源性神经营养因子(Brain-derived neurotropic factor,BDNF)的产生;钙调素依赖型蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)是一种在学习和记忆形成机制中具有重要作用的蛋白激酶[41]。Islam等[42]研究发现TB通过上调CaMKII/CREB/BDNF途径增强了大鼠认知和学习功能;而Yoneda等[43]发现了另一条TB增强工作记忆的途径——cAMP/CREB/BDNF途径,TB作为PDE抑制剂,可以使细胞内的cAMP水平升高,cAMP激活CREB产生BDNF,从而增强小鼠的工作记忆。
2.1.5 TB改善牙本质过敏和牙釉质损伤作用
龋病是一种多因素、呈动态变化的疾病过程,可引起脱矿与再矿化失衡,导致牙体硬组织脱矿[44]。据报道,在仓鼠的饮食中添加TB能抑制仓鼠的龋齿[45]。与氟化钠相比,TB可以提高牙釉质表面微硬度,并有助于表面再结晶[46]。Kargul等[47]收集24颗新拔出的人类第三磨牙,并用一定浓度的TB进行处理,结果显示,未经TB处理的对照组牙釉质表面总体上呈现光滑和稍有凹陷,并有小坑线,而TB处理组则表现在牙釉质的表面形成沉淀物,起到更好的保护作用,牙釉质的表面有硬度。
牙本质过敏(Dentin hypersensitivity,DH)是指牙齿在受到外界的刺激,如温度(冷、热)、化学物质(酸、甜)以及机械作用(磨擦或咬硬物)等所引起的牙齿酸、软、痛等症状[48]。牙本质过敏症的治疗方法一般是闭塞牙本质小管或进行神经脱敏,Amaechi等[49]发现与Novamin牙膏相比,含TB的牙膏促进了牙本质小管的闭合,缓解了DH。A·赛之霍普尔等[50]申请了含有TB的组合物用于治疗牙齿过敏症的专利(CN201380032101.0),提供了用于减轻哺乳动物口腔敏感性,堵塞哺乳动物牙齿中的牙本质小管的方法。Nassar等[51]研究发现TB具有降低牙本质过敏性和增强牙釉质损伤再硬化的潜力。
2.1.6 TB的止咳作用
TB是一种支气管扩张剂,可以改善哮喘病人的支气管扩张。Usmani等[52]研究显示,TB能有效地抑制由柠檬酸引起的豚鼠咳嗽和辣椒素引起的人体咳嗽,且没有不良反应,这是由于TB对外源诱导的传入神经激活有抑制作用。TB通过抑制传入神经通路来抑制咳嗽,这种作用可能是通过抑制支气管的PDE和AR1的活性而引起的,但也可能涉及其他作用方式(如激活Ca2-K+通道)[52-53]。另外,TB的止咳作用不会引起像其他止咳药所显示的副作用,可作为一类新止咳药[52]。
2.1.7 TB改善肾病作用
肾结石是一种高发疾病,一部分肾结石由尿酸结晶组成,血液中的尿酸盐含量高是一种病理状况,可导致尿酸结晶体产生[54]。Grases等[55]研究了甲基黄嘌呤(咖啡因、茶碱、TB和副黄嘌呤)抑制尿酸结晶的能力,并评估它们在治疗尿酸性肾结石中的应用潜力,结果显示在所研究的甲基黄嘌呤中,TB能明显地抑制尿酸结晶成核,可作为尿酸结晶抑制剂,在治疗和预防尿酸性肾结石方面具有很高的临床潜力。糖尿病肾病被认为是慢性肾衰竭的主要原因,糖尿病中过量的活性氧(Reactive oxygen species,ROS)可导致细胞外基质(Extracellular matrix,ECM)基因的表达增加,并逐渐发展为肾脏纤维化和终末期肾病。据报道,TB在糖尿病肾病方面具有治疗潜力,可通过对沉默信息调节因子2相关酶1(Sirtuin1,Sirt-1)的激活,减少糖尿病大鼠肾脏中ECM的积累,降低ROS水平[56]。
2.1.8 TB的其他作用
TB还可以预防骨关节炎,软骨细胞的功能失调是骨关节炎发生的一个重要因素,TB对白细胞介素-1(IL-1)引起的软骨细胞功能障碍具有预防作用,其机制是TB通过下调NF-κB途径抑制IL-1诱导的IκB激活、NF-κB蛋白p65的积累和NF-κB启动子活性[57]。在肠道微生物与炎症关联方面,TB能显著调节肠道微生物的组成和丰度,降低双歧杆菌(spp.)、链球菌(spp.)的菌落丰度;另外TB增加短链脂肪酸(SCFAs)的产量,SCFAs具有下调某些促炎因子(IL-6、IL-12)的表达,抑制炎症的产生[58]。也有报道称过量的可可碱有一定毒性,狗、马和新西兰海雀等动物代谢可可碱的能力非常有限,体内可可碱的累积会成为潜在致命毒物,100~200 mg的可可碱就可以使狗致命[59];而对于人类,可可碱似乎比咖啡碱更安全,其口服致死剂量更高[60]。
2.2 GCG的健康功效
EGCG是茶树()资源儿茶素的主要成分,而GCG是可可茶树资源儿茶素的主要成分,GCG在市场上的价格是EGCG的10~100倍。已有研究证实GCG具有多种生物活性[61],包括降血糖、抗氧化、抑菌消炎、抗脂和抗肿瘤[62-80](表3),GCG在某些方面作用效果甚强于EGCG。
2.2.1 GCG的降脂、降血糖作用
儿茶素可以加速胆固醇代谢,促进胆固醇排泄。Ikeda等[62]通过体外试验比较了GCG与EGCG在胆固醇胶束中的溶解度,结果显示GCG降低胆汁胶束中胆固醇的作用明显。随后该研究团队通过大鼠试验比较GCG与EGCG对血清胆固醇浓度的影响,结果表明,GCG与EGCG都是通过抑制肠道对胆固醇的吸收来降低血清胆固醇浓度,并且效果差异不显著[63]。Lee等[64]用富含GCG的儿茶素混合物(∶=1∶1)饲喂高糖饮食诱导的高脂血症大鼠,发现大鼠肝脏中的胆固醇(TC)和TG浓度显著下降,表明富含GCG的儿茶素混合物具有降血脂作用;随后在HepG2细胞水平上比较纯化的GCG与EGCG单体对LDLR活性的作用(LDLR是调节胆固醇浓度的关键因素),结果显示,与EGCG相比,纯化的GCG更能提高LDLR蛋白水平和活性。Lu等[65]发现儿茶素单体组分对HepG2细胞模型中胆固醇生物合成的抑制能力依次为GCG>EGCG>ECG(Epicatechin gallate)>GA(Gallic acid)>EGC(Epigallocatechin)>C(Catechin)>EC(Epicatechin)。

表3 没食子儿茶素没食子酸酯的健康功效
茶叶中的儿茶素对与高血糖症有关的-淀粉酶(-Amylase)和-葡萄糖苷酶(-Glucosidase)有抑制作用[66]。Wu等[67]研究发现,糖尿病患者的餐后高血糖水平与碳水化合物消化酶(-淀粉酶和-葡萄糖苷酶)有关,GCG能对-淀粉酶和-葡萄糖苷酶有强抑制作用,可有效地控制餐后的血糖水平,其机制是GCG与-淀粉酶和-葡萄糖苷酶结合形成复合物,从而诱发这两种消化酶的构象变化,导致酶活性下降。此外,GCG在-淀粉酶和-葡萄糖苷酶上的结合部位不同,氢键和范德华力主导GCG与-淀粉酶的相互作用,而氢键和疏水作用则促进GCG--葡萄糖苷酶复合物的稳定性。Xie等[68]使用链脲霉素诱导的糖尿病大鼠模型,通过葡萄糖耐量试验和测定血浆中的葡萄糖、胰岛素、甘油三酯、游离脂肪酸水平来评估GCG和EGCG的抗糖尿病活性,发现GCG作用效果比EGCG好。
2.2.2 GCG的抗氧化作用
儿茶素被认为是有效的抗氧化剂,因为它们具有清除活性氧和自由基等能力。Wu等[69]研究发现,GCG对蛋白质的氧化和羰基化具有保护作用,能改善甲基乙二醛(Methylglyoxal,MGO)介导的晚期糖基化终末产物(Advanced glycation end products,AGEs),AGEs的形成和积累被认为是糖尿病并发症发生和发展的致病因素,GCG对MGO引起的蛋白质羰基化的分子机制可能是由于其对羟自由基(Hydroxyl radical,·OH)和超氧自由基(Superoxide free radicals,·O2-)的清除。谷氨酸盐(Glutamate)是一种神经递质,神经细胞用它来发送信号,然而谷氨酸盐的过度积累会导致中枢神经系统的兴奋性中毒,发生氧化应激。Park等[70]发现儿茶素对谷氨酸盐诱导的小鼠海马神经元细胞株(HT22)氧化应激有保护作用,5种儿茶素(EGCG、GCG、GC、ECG和EC)都显示出强烈的抗氧化作用,GCG表现最好,其作用机制可能是通过调节ERK/JNK信号途径,同时降低活性氧(ROS)水平,从而有效地抑制谷氨酸盐引起的HT22细胞的氧化应激。另一些研究也表明,基于GCG与EGCG的化学结构、酶结合亲和力等因素,GCG的抗氧化活性高于EGCG[71-72]。
2.2.3 GCG的抑菌、消炎、抗脂作用
GCG具有抗细菌作用。GCG与EGCG都能抑制肉毒杆菌()和蜡样芽孢杆菌()的无性生长,但与EGCG相比,GCG对蜡样芽孢杆菌显示出更好的抑制活性[73]。Sugita-Konishi等[74]研究EGCG、GCG、EGC、ECG、EC和C等6种儿茶素单体对肠出血性大肠杆菌(,EHEC)产生Vero毒素的影响,结果发现培养基中的EGCG和GCG能明显地抑制EHEC向培养上清液中释放Vero毒素,GCG在0.05 mg·mL-1浓度时可抑制EHEC释放Vero毒素。
2--甲基--赤藓糖醇4-磷酸(2--methyl--erythritol 4-phosphate,MEP)途径是萜类生物合成途径,这种途径只在微生物中起作用。因此,阻断MEP途径已被视为筛选抗菌剂的目标,而1-脱氧--木酮糖-5-磷酸还原异构化酶(1-deoxy--xylulose 5-phosphate reductoisomerase,DXR)是MEP途径中萜类生物合成的第一个关键酶。Hui等[75]发现GCG是DXR的抑制剂,可以作用在DXR上,有效抑制细菌生长。GCG还能抑制炎症,Li等[76]研究发现GCG可以降低3T3-L1前脂肪细胞内ROS的积累,并下调3T3-L1前脂肪细胞分化中NF-κB途径,降低LPS诱导的IL-6和MCP-1产生,抑制脂肪细胞的炎症反应。
2.2.4 GCG的抗肿瘤作用
据报道,基质金属蛋白酶(Matrix metalloproteinases,MMPs)的过度表达会导致细胞外基质破坏,容易发生如癌细胞的入侵和转移等病理情况[77]。而GCG可以通过调节NF-κB途径降低基质金属蛋白酶-9(MMP-9)的启动子活性和其mRNA表达水平来减少MMP-9的分泌,预防肿瘤发生[78]。cAMP介导的cAMP-反应元件结合蛋白(CREB)等信号通路参与了黑色素细胞中黑色素的合成,小眼球相关转录因子(Microphthalmia-associated transcription factor,MITF)是这些途径中最重要的分子靶点[79]。Zhang等[80]发现GCG作为抗黑色素生成剂,保护细胞免受异常黑色素生成的影响,通过抑制cAMP下调CREB磷酸化水平,减少MITF表达,随后黑色素细胞的酪氨酸酶水平也降低,减少了黑色素的合成。
3 总结与展望
本文归纳了国内外学者研究可可茶及其优势化学成分TB与GCG的多种健康功效,其主要作用机制如图1所示。
TB作为一种腺苷受体(AR1和AR2)拮抗剂,在抑制血管生成、抑制脂肪分化和增强记忆方面发挥重要作用。GCG下调cAMP浓度,抑制CREB磷酸化水平,进而减少MITF的表达,保护细胞免受异常黑色素生成的影响。TB和GCG的部分作用机理具有相似性,比如都可抑制JNK/ERK/P38MAPK途径及下游的PKB/mTOR/NF-κB信号通路,下调IL-6、IL-1、MCP-1和MMP-9的表达,发挥抗炎和抗肿瘤作用,同样可可茶、TB和GCG部分作用机理也具有相似性(图1)。目前,可可茶、TB和GCG的保健功效研究还处在细胞和动物试验阶段,鲜有临床干预试验和流行病学调查,其功效机理的系统性研究还有待进一步拓展。
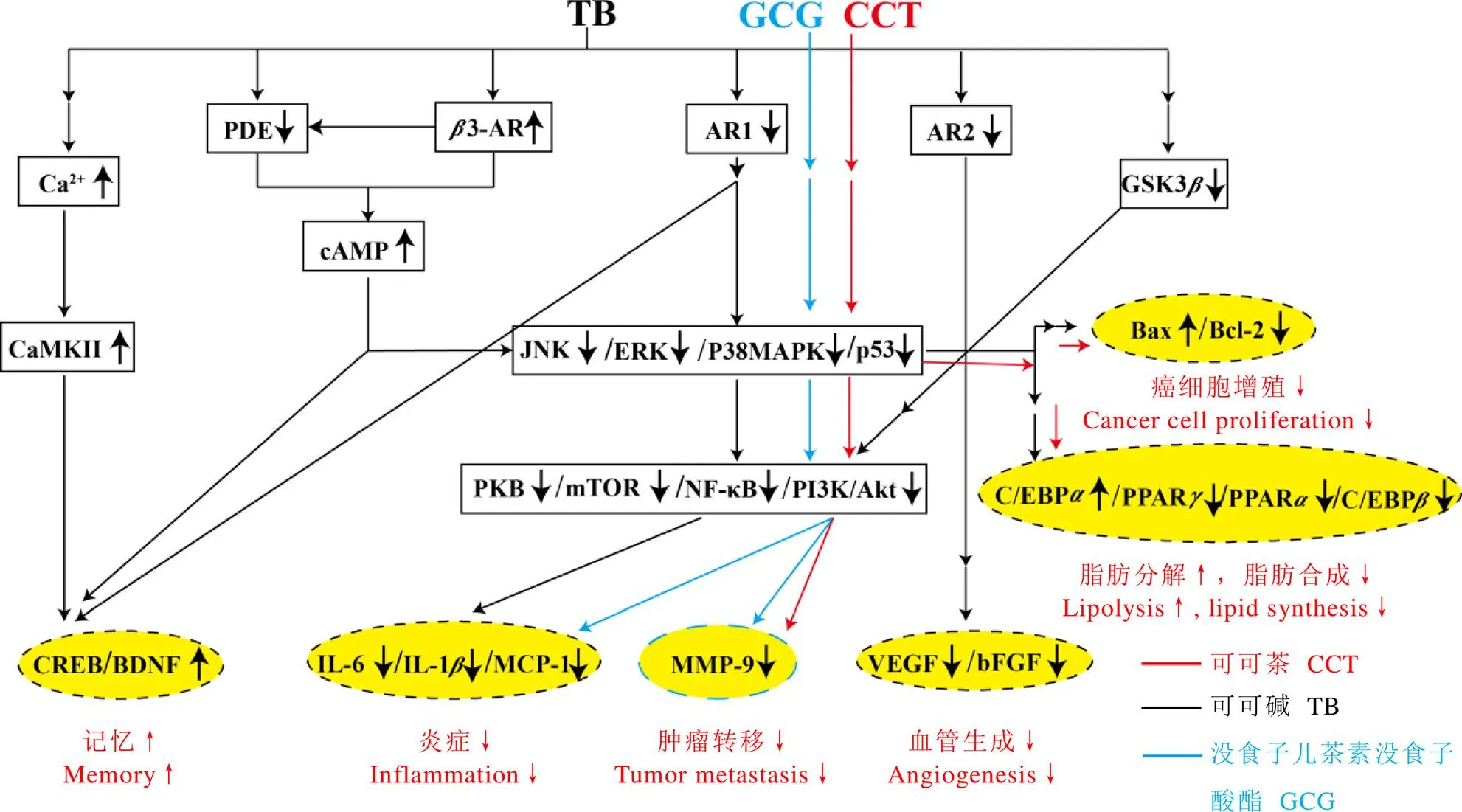
图1 可可茶、TB与GCG的保健功效的主要作用机制
另外,TB与咖啡碱(CAF)的化学结构相似,因此它们的生理活性也有很大的相似性,吴命燕等[81]综述报道,CAF对心血管疾病、癌症、神经疾病和呼吸疾病也有干预治疗作用。而TB具有CAF没有的生理功能是抗牙本质过敏、修复牙釉质损伤作用。GCG是EGCG表型异构体,两者的生物利用度有差异,张梁等[82]分析发现,小鼠体内的EGCG相对生物利用度明显高于大鼠,并通过推算EGCG在人体内的相对生物利用度并不低于小鼠。Xie等[83]通过建立体外胃肠道消化模型试验,发现EGCG的降解明显大于GCG,说明GCG比EGCG的生物利用度还低。通过整理分析发现,目前可可茶的优势化学成分TB、GCG的健康功能相关研究较多,而可可茶的健康功效报道较少,主要体现在抗肿瘤、降脂和抗氧化抗炎3个方面,其他方面功效研究有待深入挖掘,因此TB和GCG的现有功效研究成果可以为可可茶尚未开展的功效试验提供理论依据,也为可可茶相关功能产品的研制提供一定的参考。
[1] 叶创兴, 郑新强, 袁长春, 等. 无咖啡因茶树新资源可可茶研究综述[J]. 广东农业科学, 2001(2): 12-15.
Ye C X, Zheng X Q, Yuan C C, et al. Research on cocoa tea, a new source of decaffeinated tea tree [J]. Journal of Guangdong Agriculture Science, 2001(2): 12-15.
[2] 张娅楠, 陶琳琳, 高路, 等. 可可茶化学成分及药理功能的研究进展[J]. 食品科技, 2020, 45(7): 102-107.
Zhang Y N, Tao L L, Gao L, et al. Research advance on[J]. Food Science and Technology, 2020, 45(7): 102-107.
[3] 何玉媚, 彭力, 李成仁, 等. 可可茶无性系品种的生化成分研究[J]. 广东农业科学, 2011, 38(6): 10-13.
He Y M, Peng L, Li C R, et al. Research on the biochemical ingredients of cultivated varieties of cocoa tea [J]. Journal of Guangdong Agriculture Science, 2011, 38(6): 10-13.
[4] Peng L, Khan N, Afaq F, et al.andeffects of water extract of white cocoa tea () against human prostate cancer [J]. Pharmaceutical Research, 2010, 27(6): 1128-1137.
[5] Yang X, Wang Y, La K, et al. Inhibitory effects of cocoa tea () in human hepatocellular carcinoma HepG2andthrough apoptosis [J]. The Journal of Nutritional Biochemistry, 2012, 23(9): 1051-1057.
[6] Gao X, Li X, Ho C, et al. Cocoa tea () induces mitochondria-dependent apoptosis in HCT116 cells via ROS generation and PI3K/Akt signaling pathway [J]. Food Research International, 2020, 129: 108854. doi: 10.1016/j.foodres.2019.108854.
[7] Xie B F, Liu Z C, Pan Q C, et al. The anticancer effect and anti-DNA topoisomerase II effect of extracts ofchang and[J]. Chinese Journal of Cancer Research, 1994, 6(3): 184-190.
[8] Yang X R, Wat E, Wang Y P, et al. Effect of dietary cocoa tea () supplementation on high-fat diet-induced obesity, hepatic steatosis, and hyperlipidemia in mice [J]. Evidence-Based Complementary and Alternative Medicine, 2013, 2013: 783860. doi: 10.1155/2013/783576.
[9] Li K K, Liu C L, Shiu H T, et al. Cocoa tea () water extract inhibits adipocyte differentiation in mouse 3T3-L1 preadipocytes [J]. Scientific Reports, 2016, 6(1): 20172. doi: 10.1038/srep20172.
[10] Kurihara H, Shibata H, Fukui Y, et al. Evaluation of the hypolipemic property ofvar.on postprandial hypertriglyceridemia [J]. Journal of Agricultural and Food Chemistry, 2006, 54(14): 4977-4981.
[11] Li J, Yuan Y Q, Wang R M, et al. Herbal antihyperlipidemic formulation of cocoa tea: preparation andcomparison with atorvastatin [J]. Tropical Journal of Pharmaceutical Research, 2016, 15(12): 2543-2547.
[12] Li K K, Shi X G, Yang X R, et al. Antioxidative activities and the chemical constituents of two Chinese teas,and[J]. International Journal of Food Science & Technology, 2012, 47(5): 1063-1071.
[13] 彭力. 可可茶驯化选育中特征生化成分和抗癌活性的研究[D]. 广州: 中山大学, 2010.
Peng L. Characterization of biochemical components and anticancer activity in the domestication and selection of cocoa tea [D]. Guangzhou: Sun Yat-sen University, 2010.
[14] Peng L, Wang X, Shi X, et al. Characterization of the constituents and antioxidative activity of cocoa tea () [J]. Food Chemistry, 2011, 129(4): 1475-1482.
[15] 娄远蕾. 镧抑制脂多糖诱导小鼠巨噬细胞产生一氧化氮的机制[D]. 南昌: 南昌大学, 2007.
Lou Y L. Mechanisms of lanthanum inhibitting the production of nitric oxide in macrophages of mice induced by lipopolysaccharide [D]. Nanchang: Nanchang University, 2007.
[16] Lin X, Chen Z, Zhang Y, et al. Interactions among chemical components of cocoa tea (Chang), a naturally low caffeine-containing tea species [J]. Food & Function, 2014, 5(6): 1175-1185.
[17] Gao X, Lin X, Li X, et al. Cellular antioxidant, methylglyoxal trapping, and anti-inflammatory activities of cocoa tea (Chang) [J]. Food & Function, 2017, 8(8): 2836-2846.
[18] Batterman R C, Grossman A J, Duninsky J, et al. Reevaluation of the usefulness of theobromine calcium gluconate for the management of congestive heart failure and anginal syndrome [J]. International Record of Medicine and General Practice Clinics, 1959, 172(6): 318-323.
[19] Boden W E. High-density lipoprotein cholesterol as an independent risk factor in cardiovascular disease: assessing the data from framingham to the veterans affairs high-density lipoprotein intervention trial [J]. The American Journal of Cardiology, 2000, 86(12): 19-22.
[20] Assmann G, Gotto A M. HDL cholesterol and protective factors in atherosclerosis [J]. Circulation, 2004, 109(23): 8-14.
[21] Lee J, Shirk A, Oram J F, et al. Polarized cholesterol and phospholipid efflux in cultured gall-bladder epithelial cells: evidence for an ABCA1-mediated pathway [J]. Biochemical Journal, 2002, 364(2): 475-484.
[22] Neufingerl N, Zebregs Y E, Schuring E A, et al. Effect of cocoa and theobromine consumption on serum HDL-cholesterol concentrations: a randomized controlled trial [J]. The American Journal of Clinical Nutrition, 2013, 97(6): 1201-1209.
[23] Barcz E, Sommer E, Sokolnicka I, et al. The influence of theobromine on angiogenic activity and proangiogenic cytokines production of human ovarian cancer cells [J]. Oncology Reports, 1998, 5(2): 517-537.
[24] Skopińska-Rózewska E, Sommer E, Demkow U, et al. Screening of angiogenesis inhibitors by modified tumor-induced angiogenesis (TIA) test in lung cancer [J]. Roczniki Akademii Medycznej W Białymstoku, 1997, 42(1): 287-296.
[25] Gil M, Skopińska-Rózewska E, Radomska D, et al. Effect of purinergic receptor antagonists suramin and theobromine on tumor-induced angiogenesis in BALB/c mice [J]. Folia Biologica, 1993, 39(2): 63-68.
[26] Barcz E, Sommer E, Janik P, et al. Adenosine receptor antagonism causes inhibition of angiogenic activity of human ovarian cancer cells [J]. Oncology Reports, 2000, 7(6): 1285-1376.
[27] Sugimoto N, Miwa S, Hitomi Y, et al. Theobromine, the primary methylxanthine found in, prevents malignant glioblastoma proliferation by negatively regulating phosphodiesterase-4, extracellular signal-regulated kinase, Akt/mammalian target of rapamycin kinase, and nuclear factor-kappa B [J]. Nutrition and Cancer, 2014, 66(3): 419-423.
[28] Carla-Cadoná F, Kolinski-Machado A, Farina-Azzolin V, et al. Guaraná a caffeine-rich food increases oxaliplatin sensitivity of colorectal HT-29 cells by apoptosis pathway modulation [J]. Anti-Cancer Agents in Medicinal Chemistry, 2016, 16(8): 1055-1065.
[29] Shojaei-Zarghani S, Rafraf M, Khosroushahi A Y, et al. Effectiveness of theobromine on inhibition of 1, 2-dimethylhydrazine-induced rat colon cancer by suppression of the Akt/GSK3β/β-catenin signaling pathway [J]. Journal of Functional Foods, 2020, 75: 104293. doi: 10.1016/j.jff.2020.104293.
[30] Shojaei-Zarghani S, Khosroushahi A Y, Rafraf M. Oncopreventive effects of theanine and theobromine on dimethylhydrazine-induced colon cancer model [J]. Biomedicine & Pharmacotherapy, 2021, 134: 111140. doi: 10.1016/j.biopha.2020.111140.
[31] Fuggetta M P, Zonfrillo M, Villivà C, et al. Inflammatory microenvironment and adipogenic differentiation in obesity: the inhibitory effect of theobromine in a model of human obesity in vitro [J]. Mediators of Inflammation, 2019, 2019: 1515621. doi: 10.1155/2019/1515621.
[32] Jang Y J, Koo H J, Sohn E, et al. Theobromine inhibits differentiation of 3T3-L1 cells during the early stage of adipogenesisAMPK and MAPK signaling pathways [J]. Food & Function, 2015, 6(7): 2365-2374.
[33] Mitani T, Watanabe S, Yoshioka Y, et al. Theobromine suppresses adipogenesis through enhancement of CCAAT-enhancer-binding protein β degradation by adenosine receptor A1 [J]. Biochimica Et Biophysica Acta, 2017, 1864(12): 2438-2448.
[34] Ikeda K, Yamada T. UCP1 dependent and independent thermogenesis in brown and beige adipocytes [J]. Frontiers in Endocrinology, 2020, 11: 498. doi: 10.3389/fendo.2020.00498.
[35] Jang M H, Kang N H, Mukherjee S, et al. Theobromine, a methylxanthine in cocoa bean, stimulates thermogenesis by inducing white fat browning and activating brown adipocytes [J]. Biotechnology and Bioprocess Engineering, 2018, 23(6): 617-626.
[36] Jang M H, Mukherjee S, Choi M J, et al. Theobromine alleviates diet-induced obesity in mice via phosphodiesterase-4 inhibition [J]. European Journal of Nutrition, 2020, 59: 3503-3516.
[37] 程青格, 龚其海. 阿尔茨海默病的发病机制及治疗研究进展[J]. 遵义医学院学报, 2013, 36(6): 586-589.
Cheng Q G, Gong Q H. Research advances on the pathogenesis and treatment of Alzheimer's disease [J]. Acta Academiae Medicine Zunyi, 2013, 36(6): 586-589.
[38] Liu C, Kanekiyo T, Xu H, et al. Apolipoprotein E and Alzheimer disease: risk, mechanisms and therapy [J]. Nature Reviews Neurology, 2013, 9(2): 106-118.
[39] Holtzman D M, Herz J, Bu G. Apolipoprotein E and apolipoprotein E receptors: normal biology and roles in Alzheimer disease [J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(3): a006312. doi: 10.1101/cshperspect.a006312.
[40] Mendiola-Precoma J, Padilla K, Rodríguez-Cruz A, et al. Theobromine-induced changes in A1 Purinergic receptor gene expression and distribution in a rat brain Alzheimer’s disease model [J]. Journal of Alzheimer's Disease, 2017, 55(3): 1273-1283.
[41] Chen D Y, Bambah-Mukku D, Pollonini G, et al. Glucocorticoid receptors recruit the CaMKIIα-BDNF-CREB pathways to mediate memory consolidation [J]. Nature Neuroscience, 2012, 15(12): 1707-1714.
[42] Islam R, Matsuzaki K, Sumiyoshi E, et al. Theobromine improves working memory by activating the CaMKII/CREB/BDNF pathway in rats [J]. Nutrients, 2019, 11(4): 888. doi: 10.3390/nu11040888.
[43] Yoneda M, Sugimoto N, Katakura M, et al. Theobromine up-regulates cerebral brain-derived neurotrophic factor and facilitates motor learning in mice [J]. The Journal of Nutritional Biochemistry, 2017, 39: 110-116.
[44] 陈智, 张露. 基于龋风险评估的龋病治疗计划[J]. 中华口腔医学杂志, 2021, 56(1): 45-50.
Chen Z, Zhang L. Caries treatment planning based on caries risk assessment [J].Chinese Journal of Stomatology, 2021, 56(1): 45-50.
[45] Strålfors A. Effect on hamster caries by purine derivatives vanillin and some tannin-containing materials caries in relation to food consumption and animal growth [J]. Archives of Oral Biology, 1967, 12(3): 321-332.
[46] Sadeghpour A. A neural network analysis of theobromine vs. fluoride on the enamel surface of human teeth: an experimental case study with strong implications for the production of a new line of revolutionary and natural non-fluoride based dentifrices [J]. Dissertation Abstracts International, 2007, 68(7): 150.
[47] Kargul B, Özcan M, Peker S, et al. Evaluation of human enamel surfaces treated with theobromine: a pilot study [J]. Oral Health and Preventive Dentistry, 2012, 10(3): 275-282.
[48] Shiau H J. Dentin hypersensitivity [J]. Journal of Evidence Based Dental Practice, 2012, 12(3): 220-228.
[49] Amaechi B T, Mathews S M, Mensinkai P K. Effect of theobromine-containing toothpaste on dentin tubule occlusion in situ [J]. Clinical Oral Investigations, 2015, 19: 109-116.
[50] A·赛之霍普尔, 中本哲夫. 含有可可碱的组合物和它们在治疗牙齿过敏症中的用途: CN201380032101.0[P]. 2019-7-30.
A. Saizhope, Tetsuo N. Compositions containing theobromine and their use in the treatment of dental hypersensitivity: CN201380032101.0 [P]. 2019-7-30.
[51] Nassar H M, Lippert F. Artificial caries lesion characteristics after secondary demineralization with theobromine-containing protocol [J]. Molecules, 2021, 26(2): 300. doi: 10.3390/molecules26020300.
[52] Usmani O S, Belvisi M G, Patel H J, et al. Theobromine inhibits sensory nerve activation and cough [J]. The FASEB Journal, 2005, 19(2): 1-16.
[53] Smit H J. Theobromine and the pharmacology of cocoa [J]. Methylxanthines, 2011, 200: 201-234.
[54] Becker M A. Clinical aspects of monosodium urate monohydrate crystal deposition disease (gout) [J]. Rheumatic Disease Clinics of North America, 1988, 14(2): 377-394.
[55] Grases F, Rodriguez A, Costa-Bauza A. Theobromine inhibits uric acid crystallization. A potential application in the treatment of uric acid nephrolithiasis [J]. PLoS One, 2014, 9(10): e111184. doi: 10.1371/journal.pone.0111184.
[56] Papadimitriou A, Silva K C, Peixoto E B, et al. Theobromine increases NAD+/Sirt-1 activity and protects the kidney under diabetic conditions [J]. American Journal of Physiology-Renal Physiology, 2015, 308(3): 209-225.
[57] Gu R, Shi Y, Huang W, et al. Theobromine mitigates IL-1β-induced oxidative stress, inflammatory response, and degradation of type II collagen in human chondrocytes [J]. International Immunopharmacology, 2020, 82: 106226. doi: 10.1016/j.intimp.2020.106226.
[58] Martín-Peláez S, Camps-Bossacoma M, Massot-Cladera M, et al. Effect of cocoa's theobromine on intestinal microbiota of rats [J]. Molecular Nutrition &Food Research, 2017, 61(10): 1700238. doi: 10.1002/mnfr.201700238.
[59] Ashihara H, Ludwig I A, Crozier A. Plant nucleotide metabolism biosynthesis, degradation, and alkaloid formation [M]. Chichester: John Wiley & Sons Ltd, 2020: 399-404.
[60] Monteiro J, Alves M G, Oliveira P F, et al. Pharmacological potential of methylxanthines: retrospective analysis and future expectations [J]. Critical Reviews in Food Science and Nutrition, 2019, 59(16): 2597-2625.
[61] Xie L, Guo Y, Cai B, et al. Epimerization of epigallocatechin gallate to gallocatechin gallate and its anti-diabetic activity [J]. Medicinal Chemistry Research, 2013, 22(7): 3372-3378.
[62] Ikeda I, Kobayashi M, Hamada T, et al. Heat-epimerized tea catechins rich in gallocatechin gallate and catechin gallate are more effective to inhibit cholesterol absorption than tea catechins rich in epigallocatechin gallate and epicatechin gallate [J]. Journal of Agricultural and Food Chemistry, 2003, 51(25): 7303-7307.
[63] Kobayashi M, Unno T, Suzuki Y, et al. Heat-epimerized tea catechins have the same cholesterol-lowering activity as green tea catechins in cholesterol-fed rats [J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(12): 2455-2458.
[64] Lee S M, Kim C W, Kim J K, et al. GCG-rich tea catechins are effective in lowering cholesterol and triglyceride concentrations in hyperlipidemic rats [J]. Lipids, 2008, 43(5): 419-429.
[65] Lu C, Hwang L S. Polyphenol contents of Pu-erh teas and their abilities to inhibit cholesterol biosynthesis in Hep G2 cell line [J]. Food Chemistry, 2008, 111(1): 67-71.
[66] Yilmazer-Musa M, Griffith A M, Michels A J, et al. Grape seed and tea extracts and catechin 3-gallates are potent inhibitors of-amylase and-glucosidase activity [J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 8924-8929.
[67] Wu X Q, Ding H F, Hu X, et al. Exploring inhibitory mechanism of gallocatechin gallate on-amylase and-glucosidase relevant to postprandial hyperglycemia [J]. Journal of Functional Foods, 2018, 48: 200-209.
[68] Xie L W, Guo Y P, Cai B, et al. Epimerization of epigallocatechin gallate to gallocatechin gallate and its anti-diabetic activity [J]. Medicinal Chemistry Research, 2013, 22: 3372-3378.
[69] Wu X Q, Zhang G W, Hu M M, et al. Molecular characteristics of gallocatechin gallate affecting protein glycation [J]. Food Hydrocolloids, 2020, 105: 105782. doi: 10.1016/j.foodhyd.2020.105782.
[70] Park D H, Park J Y, Kang K S, et al. Neuroprotective effect of gallocatechin gallate on glutamate-induced oxidative stress in hippocampal HT22 cells [J]. Molecules, 2021, 26(5): 1387. doi: 10.3390/molecules26051387.
[71] Guo Q, Zhao B L, Shen S R, et al. ESR study on the structure-antioxidant activity relationship of tea catechins and their epimers [J]. Biochimica et Biophysica Acta, 1999, 1427(1): 13-23.
[72] No J K, Kim Y J, Shim K H, et al. Inhibition of tyrosinase by green tea components [J]. Life Sciences, 1999, 65(21): 241-246.
[73] Hara-Kudo Y, Yamasaki A, Sasaki M, et al. Antibacterial action on pathogenic bacterial spore by green tea catechins [J]. Journal of the Science of Food and Agriculture, 2005, 85(14): 2354-2361.
[74] Sugita-Konishi Y, Hara-Kudo Y, Amano F, et al. Epigallocatechin gallate and gallocatechin gallate in green tea catechins inhibit extracellular release of Vero toxin from enterohemorrhagicO157:H7 [J]. Biochimica et Biophysica Acta, 1999,1472(1-2):42-50.
[75] Hui X, Hua S, Wu Q, et al. Antimicrobial mechanism of epigallocatechin gallate and gallocatechin gallate: they target 1-deoxy-D-xylulose 5-phosphate reductoisomerase, the key enzyme of the MEP terpenoid biosynthetic pathway [J]. Archives of Biochemistry and Biophysics, 2017, 622: 1-8.
[76] Li K K, Peng J M, Zhu W, et al. Gallocatechin gallate (GCG) inhibits 3T3-L1 differentiation and lipopolysaccharide induced inflammation through MAPK and NF-κB signaling [J]. Journal of Functional Foods, 2017, 30: 159-167.
[77] Johansson N, Ahonen M, Kähäri V M. Matrix metalloproteinases in tumor invasion [J]. Cellular and Molecular Life Sciences CMLS, 2000, 57(1): 5-15.
[78] Dell’Agli M, Bellosta S, Rizzi L, et al. A structure-activity study for the inhibition of metalloproteinase-9 activity and gene expression by analogues of gallocatechin-3-gallate [J]. Cellular and Molecular Life Sciences CMLS, 2005, 62: 2896-2903.
[79] Shin S, Lee Y. Glyceollins, a novel class of soybean phytoalexins, inhibit SCF-induced melanogenesis through attenuation of SCF/c-kit downstream signaling pathways [J]. Experimental & Molecular Medicine, 2013, 45: e17. doi: 10.1038/emm.2013.20.
[80] Zhang X, Li J, Li Y, et al. Anti-melanogenic effects of epigallocatechin-3-gallate (EGCG), epicatechin-3-gallate (ECG) and gallocatechin-3-gallate (GCG) via down-regulation of cAMP/CREB /MITF signaling pathway in B16F10 melanoma cells [J]. Fitoterapia, 2020, 145: 104634. doi: 10.1016/j.fitote.2020.104634.
[81] 吴命燕, 范方媛, 梁月荣, 等. 咖啡碱的生理功能及其作用机制[J]. 茶叶科学, 2010, 30(4): 235-242.
Wu M Y, Fan F Y, Liang Y R, et al. The physiological functions of caffeine and their related mechanisms [J]. Journal of Tea Science, 2010, 30(4): 235-242.
[82] 张梁, 陈欣, 陈博, 等. 茶多酚体内吸收、分布、代谢和排泄研究进展[J]. 安徽农业大学学报, 2016, 43(5): 667-675.
Zhang L, Chen X, Chen B, et al. Research progress in the absorption, distribution, metabolism and excretion of tea polyphenols[J]. Journal of Anhui Agricultural University, 2016, 43(5): 667-675.
[83] Xie Y L, Kosińska A, Xu H R, et al. Milk enhances intestinal absorption of green tea catechins indigestion/Caco-2 cells model [J]. Food Research International, 2013, 53(2): 793-800.

and Specific Chemical Components, Theirs Health Beneficial Effects
WU Wenliang1, TONG Tong1, HU Yao2, ZHOU Hao1, YIN Xia1, ZHANG Shuguang1*
1. Tea Research Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China; 2. Nuclear Agronomy and Aerospace Breeding Research Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China
Cocoa tea (Chang) is a specific tea resource in China, and theobromine (TB) and gallocatechin gallate (GCG), as the dominant chemical components of cocoa tea, have various health effects. This paper summarized intervention effects and mechanisms of cocoa tea, TB and GCG on cardiovascular diseases, cancers, obesity, diabetes, neurodegenerative diseases, dental diseases, respiratory diseases and kidney diseases, etc. This review would provide a theoretical reference for the development of functional cocoa tea products.
, theobromine, gallocatechin gallate, health effects
S571.1
A
1000-369X(2021)05-593-15
2021-07-30
2021-08-23
湖南省重点领域研发计划(2020NK2047)、湖南省农业科技创新资金(2020CX36)、湖南省自然科学基金(2020JJ5277)
吴文亮,男,博士后,主要从事茶叶品质化学与营养健康的研究。*通信作者:suglezhang@126.com
(责任编辑:黄晨)
