VEGF-C、VEGFR-3在食管癌诊治中的临床价值
2021-10-16卢来顺林雪琼曾芸珠
卢来顺,林雪琼,曾芸珠
(1.汕头市中心医院超声诊断科,广东 汕头 515041;2.汕头大学医学院附属肿瘤医院检验科,广东 汕头 515041;3.汕头大学医学院附属肿瘤医院病理科,广东 汕头 515041)
食管癌是全球常见的恶性肿瘤,我国是全球食管癌发病率和病死率最高的国家之一,每年平均新发病例数约22.3万,死亡人数约15万[1]。转移和复发是导致患者死亡的主要原因,淋巴源性转移是食管癌转移的主要途径和影响其预后因素之一[2]。血管内皮细胞生长因子-C(vascular endothelial growth factor-C,VEGF-C)和血管内皮细胞生长因子受体-3(vascular endothelial growth factor receptor-3,VEGFR-3)是促进淋巴管生成的重要因素[3-4],亦有大量报道VEGF-C、VEGFR-3在食管鳞癌中的表达。然而,暂未查阅到有关VEGF-C、VEGFR-3与多种蛋白表达及其与食管癌患者预后的关系的报道。本文旨在探讨VEGFC、VEGFR-3蛋白表达与食管癌临床病理特征、患者预后的关系及其与凋亡抑制蛋白Survivin等蛋白的关系,进一步明确VEGF-C、VEGFR-3在食管癌诊治中的临床价值。
1 资料与方法
1.1 标本来源
收集2014年5月—2016年4月汕头大学医学院附属肿瘤医院病理科收检的部分食管癌手术标本134例。其中男性108例,女性26例;年龄43~78岁,平均年龄(59.99±7.79)岁,中位年龄60岁。根据第八版食管癌TNM分期标准进行分期:Ⅰ期9例,Ⅱ期11例,Ⅲ期98例,Ⅳ期16例。其中无淋巴结转移50例,有淋巴结转移84例。选取食管癌切除术后恢复良好出院的病例进行跟踪随访,随访时间截止到2018年5月,随访时间7~36个月。本研究经汕头大学医学院附属肿瘤医院医学伦理委员会批准。
1.2 实验试剂
兔抗人VEGF-C多克隆抗体、鼠抗人VEGFR-3单克隆抗体均购于北京中杉金桥生物公司,兔抗人Survivin多克隆抗体、兔抗人EGFR单克隆抗体、兔抗人Ki-67单克隆抗体、鼠抗人p53单克隆抗体、即用型免疫组化MaxVision二抗及DAB显色试剂盒均购于福州迈新生物公司。
1.3 实验方法
标本均经10%中性缓冲福尔马林固定,常规制片、HE染色。免疫组化染色步骤按EnVision两步法进行:石蜡标本3 μm厚连续切片,65℃烤片1 h,二甲苯Ⅰ、Ⅱ、Ⅲ各10 min,无水乙醇、95%乙醇、80%乙醇、70%乙醇、蒸馏水各2 min,PBS洗3次,3 min/次,3%H2O210 min,抗原修复(VEGF-C、Ki-67、p53采用pH=6.0,0.01 mol/L柠檬酸缓冲液高压修复;VEGFR-3、EGFR采用pH=9.0 EDTA高温修复),PBS洗3次,3 min/次,加1滴一抗37℃孵育1 h,PBS洗3次,3 min/次,加1滴二抗室温15 min,PBS洗3次,3 min/次,加1滴DAB显色5 min,流水终止显色,苏木精复染1 min,分化,返蓝,脱水,透明,中性树胶封固。
1.4 结果判断
蛋白表达均以细胞着色情况为标准,阳性染色为棕黄色,凡显色强度与背景无明显差别为阴性。先在低倍镜下选取最强着色区,然后选10个高倍镜视野(400×),分别计数100个细胞,按其出现特异性染色颜色深浅参考文献评分[5-7]:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再按染色细胞所占百分比计分:阴性为0分,阳性细胞数<10%为1分,10%~50%为2分,51%~75%为3分,>75%为4分。将两项得分结果相乘:≥3分为阳性,其中3~4分为(+),5~7分为(++),8~9分为(+++)。
1.5 统计学方法
应用SPSS 19.0统计软件进行分析,计数资料以例数或百分率表示,VEGF-C、VEGFR-3表达与患者临床病理特征的关系采用χ2检验;VEGFC、VEGFR-3表达与4种常见蛋白的关系采用Spearman等级相关检验;VEGF-C、VEGFR-3表达与患者生存时间的关系,单因素生存分析采用Kaplan-Meier法,多因素生存分析采用Cox风险比例回归模型法。以P<0.05为差异有统计学意义。
2 结果
2.1 食管癌组织中的蛋白表达
VEGF-C、VEGFR-3蛋白主要定位于细胞质和癌巢周围间质细胞,呈棕黄色颗粒状,灶性或弥漫性分布,多出现在癌巢的边缘部位(图1A、图1B);Survivin蛋白主要定位于细胞质,在细胞核中也有少量表达(图1C);EGFR蛋白主要在细胞质/膜中表达(图1D);Ki-67、p53蛋白定位于细胞核(图1E、图1F)。
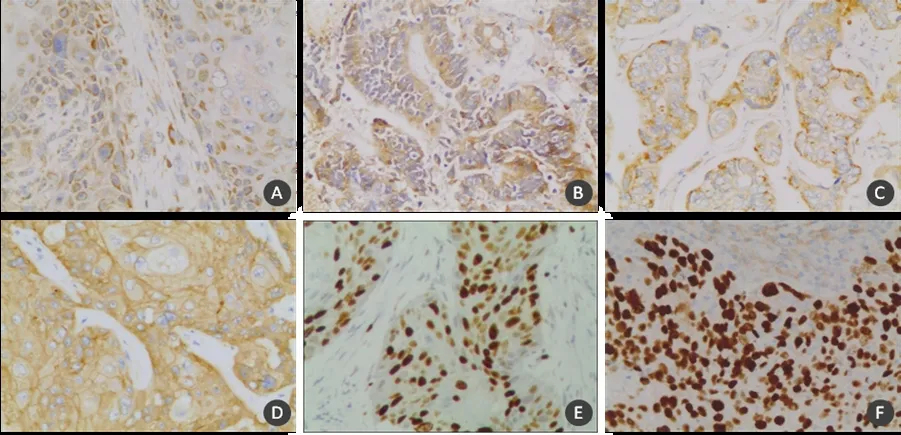
图1 食管癌组织中的蛋白表达 (MaxVisionTM法,×200)
2.2VEGF-C、VEGFR-3表达与食管癌临床病理特征的关系
134例食管癌标本中,VEGF-C蛋白阳性105例(78.36%),VEGFR-3 蛋白阳性 92 例(68.66%)。淋巴结转移组和无淋巴结转移组的VEGF-C阳性率分别为88.10%(74/84)和62.00%(31/50),VEGFR-3阳性率分别为77.40%(65/84)和54.00%(27/50),差异均有统计学意义(P<0.05),且与淋巴结转移个数有关,淋巴结转移个数越多,VEGF-C、VEGFR-3阳性率越高。VEGF-C表达与肿瘤浸润深度有关(P<0.05),VEGFR-3表达与肿瘤浸润深度无关(P>0.05);两者表达与患者性别、年龄、神经束是否浸润、肿瘤分化程度均不相关(P>0.05,表1)。
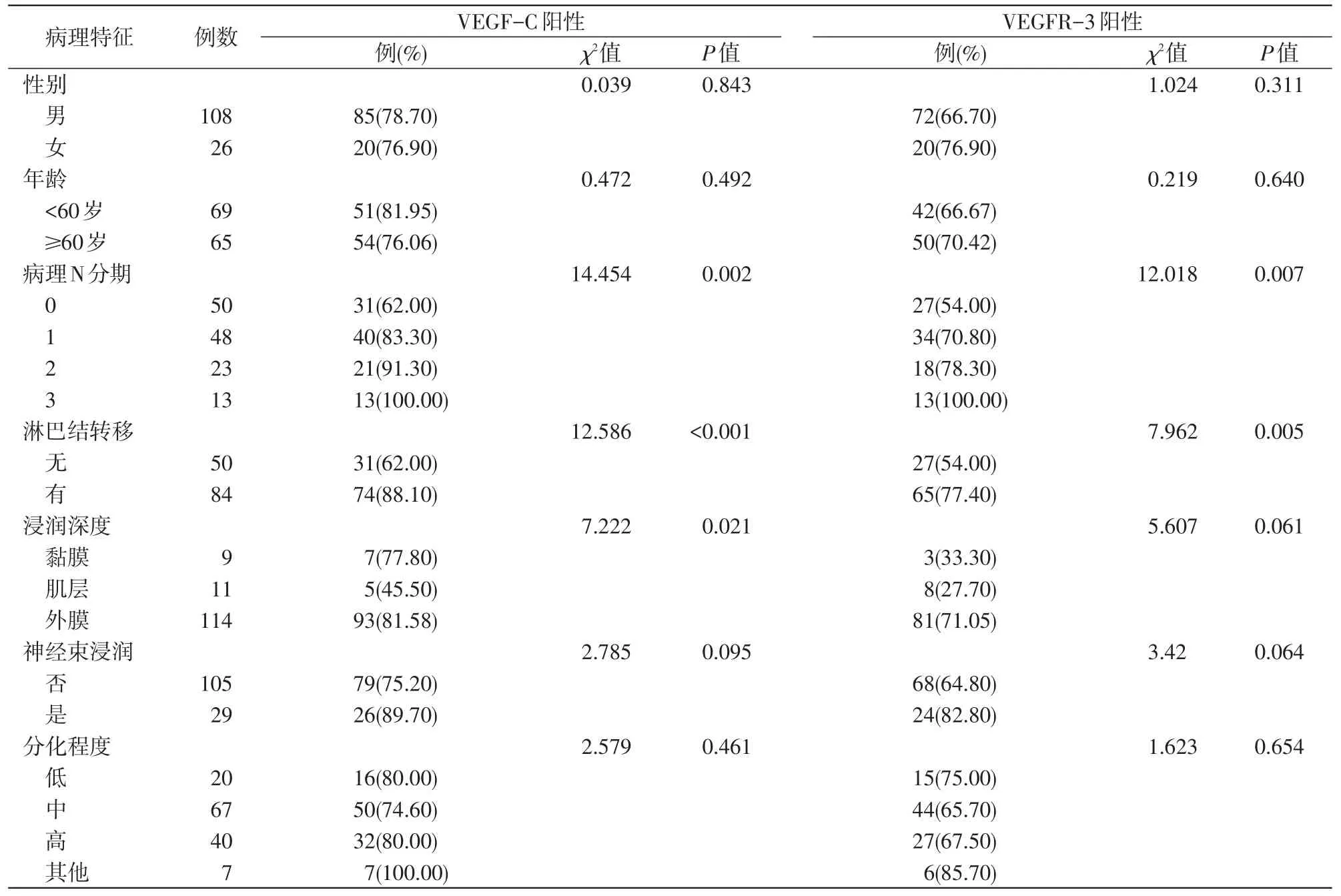
表1 VEGF-C、VEGFR-3表达与食管癌临床病理特征的关系
2.3 食管癌组织中VEGF-C、VEGFR-3与Survivin、EGFR、Ki-67、p53表达的相关性
VEGF-C、VEGFR-3与Survivin的表达呈正相关(P<0.05),而与EGFR、Ki-67、p53的表达无关(P>0.05,表2)。
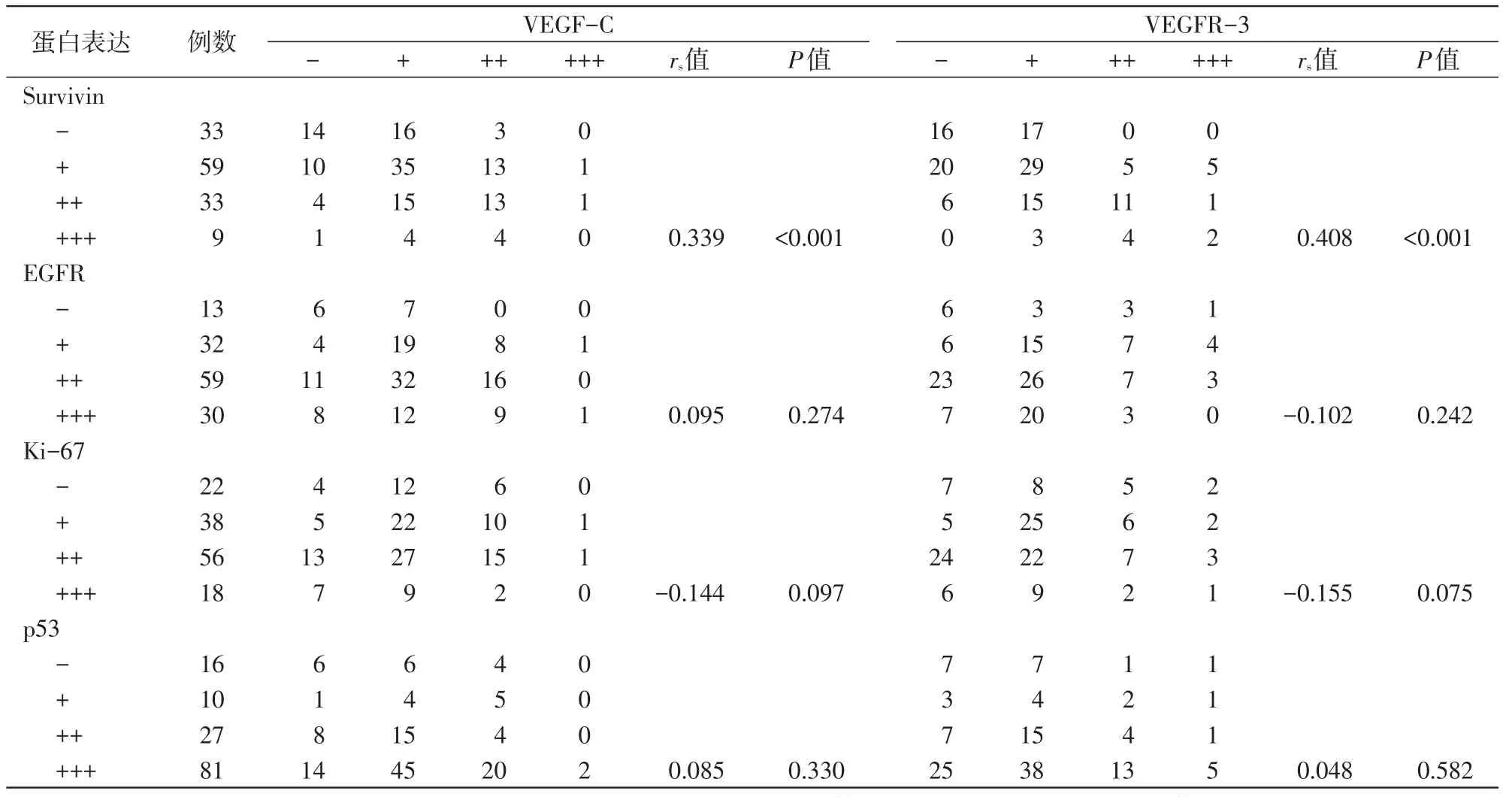
表2 食管癌组织中VEGF-C、VEGFR-3与Survivin、EGFR、Ki-67、p53表达的相关性
2.4VEGF-C、VEGFR-3蛋白表达与食管癌患者生存时间的关系
在134例食管癌患者中,44例患者随访期间死亡,90例患者随访至2018年5月仍生存。单因素分析发现,VEGF-C低表达患者中位生存期长于高表达者(32.670个月vs 28.215个月,P=0.049,图2);VEGFR-3低表达患者中位生存期亦长于高表达者(32.183个月vs 27.630个月,P=0.025,图3);淋巴结转移与食管癌患者的生存时间密切相关,差异有统计学意义(P=0.004,图4)。将VEGF-C、VEGFR-3表达及各临床病理特征导入Cox回归模型进行多因素生存分析,结果表明淋巴结转移是食管癌患者的独立预后预测因子 (OR=2.297,95%CI: 1.031~5.118,P=0.042),但VEGF-C、VEGFR-3不是食管癌患者的独立预后预测因子(OR=1.921,95%CI:0.640~5.764,P=0.244 和 OR=1.515, 95%CI: 0.663~3.462, P=0.325)。

图2 VEGF-C蛋白不同表达的食管癌患者的生存曲线

图3 VEGFR-3蛋白不同表达的食管癌患者的生存曲线
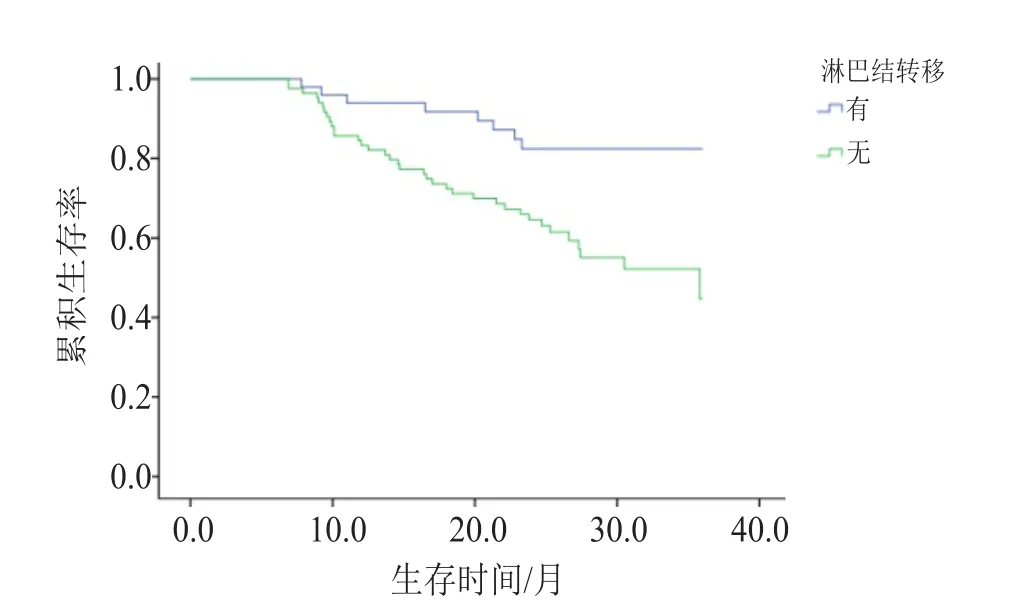
图4 淋巴结有无转移的食管癌患者的生存曲线
3 讨论
肿瘤的扩散和转移是治疗失败的主要原因,而在肿瘤转移这一因素中,区域淋巴结转移是肿瘤复发及远处转移的主要原因[8],淋巴源性转移是食管癌转移的主要途径和影响预后的因素之一。VEGF-C是血管内皮生长因子家族成员之一,通过酪氨酸激酶受体VEGFR-3促使内皮细胞增殖、迁移和淋巴管生成,与肿瘤的淋巴结转移有关,在胃癌[9]和乳腺癌[10-11]等多种肿瘤的研究中已得到证实。本组实验应用免疫组化法对134例食管癌VEGF-C、VEGFR-3的表达进行检测,阳性率分别为78.36%、68.66%,这与既往研究食管鳞癌中表达阳性率比较一致[12]。本研究表明VEGF-C、VEGFR-3的表达与食管癌的淋巴管浸润、淋巴结转移密切相关。
食管癌的发生、发展是多因素综合作用的结果,在分子水平上涉及众多癌基因、抑癌基因及蛋白质的改变。Survivin蛋白是凋亡抑制蛋白家族成员[13],具有抑制肿瘤凋亡、促进肿瘤异常增殖等特点,与肿瘤细胞的分化增殖及浸润转移密切相关[14]。Yan等[15]研究Survivin表达与放化疗后食管鳞状细胞癌患者的临床病理特征及预后的关系,发现Survivin的表达与肿瘤大小、肿瘤浸润深度、肿瘤分化程度、淋巴结转移、临床分期密切相关,高表达Survivin的患者预后不良。乳腺癌中,VEGF-C的表达水平与Survivin的表达水平存在显著相关,且VEGF-C参与了Survivin介导的乳腺癌细胞侵袭过程[14],本研究结果显示VEGF-C、VEGFR-3与Survivin在食管癌组织中的表达呈正相关。
EGFR是原癌基因C-erbB-1的表达产物,是表皮生长因子受体家族成员之一。EGFR广泛分布于上皮细胞、成纤维细胞、胶质细胞、角质细胞等细胞表面,研究表明EGFR在与其配体结合后可以引起细胞生长、增殖和分化,在正常的细胞生理过程中发挥十分重要的调控作用[16]。EGFR蛋白酪氨酸激酶功能缺失或其相关信号通路中关键因子的活性或细胞定位异常可促进肿瘤细胞的增殖、血管生成、浸润和转移,以及抑制细胞凋亡[17]。Ki-67是目前评估肿瘤细胞增殖活性最可靠的指标之一,可判断肿瘤侵袭力及预后[18]。p53基因是迄今发现与人类肿瘤相关性最高的基因,p53基因的功能发生缺陷则可导致人体细胞异常增殖[19]。p53基因好似“基因组卫士”,在G1期检查DNA损伤点,监视基因组的完整性。如果p53基因发生了突变,对细胞的增殖失去控制,则导致细胞癌变[20]。p53蛋白主要分布于细胞核中,在正常细胞中p53蛋白的表达水平通常低于免疫组化方法的检出水平,p53基因突变可导致突变型p53蛋白的积聚和过度表达。既往研究报道,胃癌、卵巢上皮癌中VEGF-C和EGFR的表达呈正相关[21-22],乳腺癌中VEGF、p53、Ki-67的表达呈正相关[23];也有研究显示食管癌中p53蛋白的表达与VEGF表达无密切关系[24],田兴松等[25]研究发现EG-1 mRNA在甲状腺癌组织中的表达与VEGF-C蛋白显著相关,与p53蛋白无相关性。本研究中VEGF-C、VEGFR-3与EGFR、Ki-67、p53的表达不相关。这可能与本研究纳入的食管癌标本大部分为食管鳞状细胞癌有关。此外,更多的研究倾向于将蛋白的表达分为阴性和阳性2个等级,本研究分为4个等级进行分析亦可能是影响因素之一。
此外,本组病例进行了跟踪随访,结果显示VEGF-C、VEGFR-3低表达患者的中位生存期长于高表达者。除了VEGF-C、VEGFR-3表达外,单因素分析数据还提示淋巴结转移与食管癌患者的生存时间密切相关。众所周知,肿瘤的发生发展是多因素、多过程的,影响其预后的因素纷繁复杂,于是我们将VEGF-C、VEGFR-3表达及各临床病理特征导入Cox回归模型进行多因素生存分析,结果表明淋巴结转移是食管癌患者的独立预后预测因子,但VEGF-C、VEGFR-3不是食管癌患者的独立预后预测因子。结果提示VEGFC、VEGFR-3表达水平高的患者其死亡风险较表达低的患者大;有淋巴结转移的患者,其死亡风险也越大;VEGF-C、VEGFR-3表达越高的食管癌患者,其生存时间越短。
综上所述,食管癌组织中VEGF-C、VEGFR-3表达的高低与患者是否伴有淋巴结转移密切相关,与凋亡抑制蛋白Survivin的表达呈正相关。VEGF-C、VEGFR-3表达越高提示食管癌患者伴有淋巴结转移可能性越大且预后越差。可以通过常规检测VEGF-C、VEGFR-3来帮助食管癌的早期诊治和淋巴结转移的判断,评估食管癌患者的预后。
