术前癌胚抗原水平升高对Ⅰ~Ⅲ期结肠癌患者预后的影响:一项基于SEER数据库的回顾性队列研究
2021-10-16杜宁超刘安文廖木春陈小岚
杜 昆,杜宁超,刘安文,廖木春,陈小岚
(1.汕头大学医学院,广东 汕头 515041;2.深圳市第二人民医院肛肠外科,广东 深圳 518035;3.深圳市第二人民医院胃肠外科,广东 深圳 518035)
结直肠癌是常见的恶性肿瘤之一,全球结直肠癌发病率在所有恶性肿瘤中排名第4位,死亡率排名第2位[1]。我国结直肠癌发病率在所有癌症中居第3位,死亡率居第5位,且发病人数与死亡人数呈逐年上升趋势[2-3]。手术是非转移性结直肠癌患者最主要的治疗方式,探究影响手术患者预后的相关指标并在术前和术后进行预后分层有利于制定个体化的治疗策略。TNM分期系统是目前应用最为广泛的肿瘤分期系统,在肿瘤规范化诊断和治疗方面有着极为重要的作用,自其诞生以来便进行不断的完善。美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第 8 版肿瘤分期系统基于一些基础及临床研究做出一系列的更新,如将腹膜转移更新为M1c期,增加了微卫星不稳定和KRAS、NRAS、BRAF基因突变等附加的相关指标[4]。
癌胚抗原(carcinoembryonic antigen,CEA)是一种参与细胞黏附的糖蛋白,目前已成为结直肠癌临床应用最为广泛的肿瘤标志物,在术后随访过程中CEA水平升高应警惕肿瘤的进展、复发或转移的可能[5]。这提示CEA可能是结直肠肿瘤生物学侵袭性的标志物,但是临床中并非所有的结肠癌患者术前CEA水平均会升高,因此术前CEA水平升高的患者相较于术前CEA水平正常的患者预后是否更差?本研究探讨术前CEA水平对Ⅰ~Ⅲ期结肠癌患者术后预后的影响及将术前CEA水平与结肠癌AJCC分期相结合后能否提高对Ⅰ~Ⅲ期结肠癌患者预后的预测能力,并最终也能成为AJCC分期中指导临床实践的附加指标。
1 资料与方法
1.1 研究对象
SEER数据库(https://seer.cancer.gov/)记录了美国部分州县上百万名恶性肿瘤患者的患病情况信息。数据库中相关信息通过SEERStat软件进行统一和规范,并定期更新发布。我们申请获得SEER数据库的授权,从数据库“SEER Research Data,9 Registries,Nov 2019 Sub(1975—2017)”中纳入2010—2015年诊断为结肠癌的患者。排除AJCC分期不明、AJCC分期0期及Ⅳ期、未行结肠癌根治性切除术、术前CEA水平缺失以及结局指标不明确(死因不明)的患者。根据术前CEA水平将患者分为正常组(≤5.0 ng/mL)与升高组(>5.0 ng/mL)。
1.2 收集变量
患者基线指标包括年龄、种族和性别,肿瘤相关指标包括肿瘤位置、分化程度、淋巴结检出数目、神经浸润情况、癌结节及AJCC分期(第7版)。结局指标为患者癌症特异性生存期(cancer specific survival,CSS),定义为患者从明确诊断到观察到因为结肠癌而死亡的时间,死于其他原因或末次随访中仍然存活的患者定义为删失数据,记录末次随访时间。
1.3 统计学分析
利用EmpowerStats、R软件及GraphPad Prism进行统计分析。正态分布的连续变量以xˉ±s表示,组间比较采用t检验,不符合正态分布的连续变量以中位数和四分位数间距[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验。分类变量表示为例数及百分比,组间比较采用χ2检验。P≤0.05认为具有统计学意义。采用Kaplan-Meier法估计CSS,采用Log-rank检验对生存差异进行评估,采用Cox回归模型分别进行单因素及多因素回归分析评估术前CEA水平的预后作用。为了进一步进行敏感性分析,我们分别构建3个回归模型,结果为风险比(hazard ratio,HR)并给出95%置信区间。在模型1中,未校正其他混杂因素;在模型2中,校正协变量的筛选原则为基本模型中引进协变量或在完整模型中剔除协变量对术前CEA水平效应值的影响>10%;在模型3中,校正的协变量的筛选原则为单因素分析中协变量对结局指标的效应值P<0.1。为了探究术前CEA水平对患者CSS的影响在不同层级水平与结局变量之间的效应值(HR)大小及方向是否稳定,进行分层分析并绘制森林图。随后分别绘制患者AJCC分期及AJCC分期联合术前CEA水平的CSS的列线图预测模型,列线图根据回归模型中各个预测变量对结局变量的贡献程度(回归系数的大小)将其按照比例对每个预测变量进行赋分,这些变量的评分相加得到总评分,从而得出结局事件的预测值,最后绘制时间依赖性受试者工作特征(receiver operator characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC)以评估模型的区分度。
2 结果
2.1 研究人群的临床特征
最终纳入患者17 921例,其中男性8 825例(49.24%),女性9 096例(50.76%)。术前CEA水平正常组11 467例(64.0%),CEA水平升高组6 454例(36.0%),两组患者年龄、性别、种族、肿瘤位置、分化程度、淋巴结检出数目、神经浸润情况、癌结节、T分期、N分期及AJCC分期差异均有统计学意义(P≤0.05),见表1。所有患者中位随访时间为45(29,66)个月,末次随访中因结肠癌死亡的患者2 910例(16.24%),患者总体5年癌症特异性生存率为81.48%(95%CI:80.82%~82.14%)。

表1 术前CEA水平正常组与升高组结肠癌患者临床基线资料比较 [例(%)]
2.2 术前CEA水平正常与升高人群预后情况比较
术前CEA水平升高组中AJCC分期更晚的患者、发生周围神经浸润的患者及分化程度更低的患者所占比例更大,差异均有统计学意义(P<0.001),见图1。在所有患者中,术前CEA水平升高组的5年癌症特异性生存率为72.75%(95%CI:71.48% ~74.03%), 正 常 组 为 86.25%(95%CI:85.52%~86.98%);在AJCC分期为Ⅰ期的患者中,术前CEA水平升高组的5年癌症特异性生存率为 89.73%(95%CI:87.40%~92.12%),正常组为95.65%(95%CI:94.81%~96.49%);在AJCC分期为Ⅱ期的患者中,术前CEA升高组的5年癌症特异性生存率为80.22%(95%CI:78.45%~82.02%),正常组为89.49%(95%CI:88.42%~90.58%);在AJCC分期为Ⅲ期的患者中,术前CEA升高组的5年癌症特异性生存率为61.61%(95%CI:59.59%~63.70%),正常组为75.67%(95%CI:74.16%~77.20%),差异均有统计学意义(P<0.001)。

图1 患者术前CEA水平与肿瘤生物学特性的相关性
2.3 患者癌症特异性生存期的单因素及多因素分析
单因素Cox回归分析显示,年龄、种族、肿瘤位置、肿瘤分化程度、淋巴结检出数目、神经浸润情况、癌结节、术前CEA水平及AJCC分期与患者术后CSS相关(P<0.05)。多因素Cox回归分析显示,年龄、种族、肿瘤分化程度、淋巴结检出数目、神经浸润情况、癌结节、术前CEA水平及AJCC分期是患者术后CSS缩短的独立危险因素(P<0.05),见表2。分别构建3个Cox回归模型进行敏感性分析,结果均显示术前CEA水平升高是患者术后CSS缩短的危险因素,在考虑了随访时间后,术前CEA水平升高的患者发生癌症特异性死亡的风险比术前CEA水平正常的患者增加了74%(HR=1.74,95%CI:1.62~1.87),见表 3。同时分层分析显示,在不同亚组中术前CEA升高均为患者术后CSS缩短的危险因素(HR均>1),见图2。
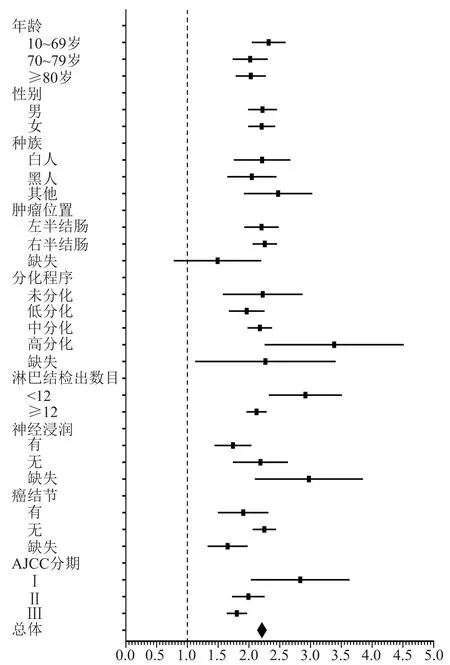
图2 术前CEA水平与患者癌症特异性死亡风险的分层分析
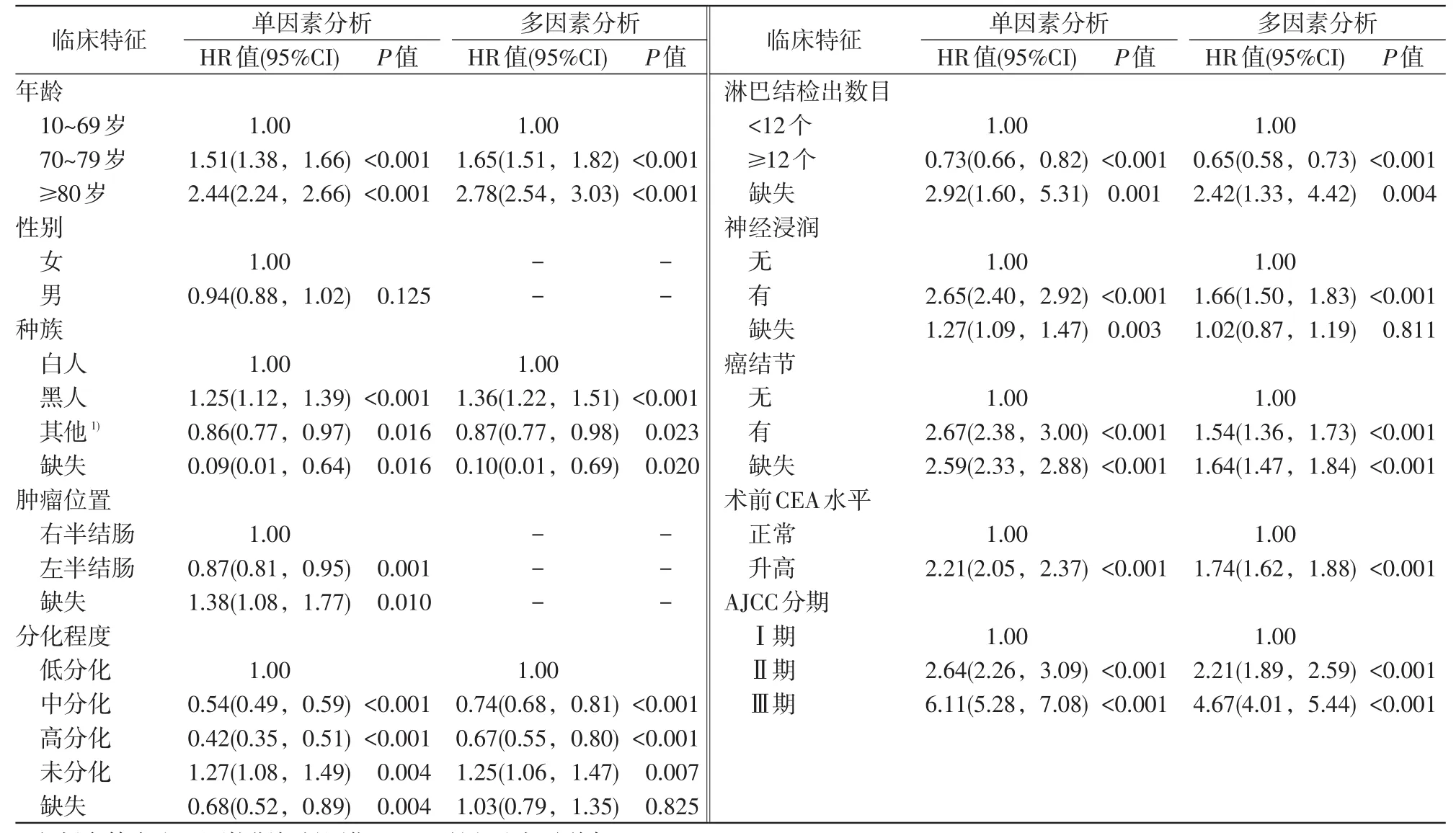
表2 患者癌症特异性生存期的单因素及多因素分析

表3 术前CEA水平与患者癌症特异性生存期的Cox回归模型分析
2.4 预测模型的建立
分别建立AJCC分期及AJCC分期联合术前CEA水平的CSS的列线图预测模型,见图3。AJCC分期联合术前CEA水平预测模型的时间依赖性AUC曲线高于单纯AJCC分期模型,在时间依赖性ROC曲线中,AJCC分期联合术前CEA水平的模型的AUC大于单纯AJCC分期模型的AUC(0.71比0.68,时间为41个月),见图4。

图3 患者癌症特异性生存期的列线图预测模型

图4 时间依赖性AUC曲线及ROC曲线分析
3 讨论
本研究显示术前CEA水平升高与Ⅰ~Ⅲ期结肠癌患者的不良预后独立相关,与既往研究[6-8]结果一致。术前CEA水平升高患者的AJCC分期更晚,分化程度更低,更易发生周围神经浸润,总体的5年癌症特异性生存率比术前CEA正常的患者低13.5%,在AJCC分期Ⅰ~Ⅲ期中的患者也分别得到了相似的结果。多因素Cox回归分析显示术前CEA水平升高为患者术后CSS缩短的独立危险因素,且在随后的亚组分析中显示结果稳定可靠。同时AJCC分期联合术前CEA水平预测模型的区分度比单纯应用AJCC分期的区分度更高,即将术前CEA水平纳入AJCC分期后可部分改善其预后分层作用。
CEA可通过不同的分子生物学机制促进结直肠癌的发生、进展及转移。利用RNA测序对表达CEA的结直肠癌细胞进行全基因组分析结果显示近100个基因的表达水平出现过表达或下调,结肠癌细胞产生的CEA可通过诱导上皮—间质细胞转化、增加肿瘤细胞对周围组织的侵袭性以及抑制应激和凋亡信号来触发结直肠癌的进展[9]。在结直肠腺癌中,CEA基因发生突变,抑制转化生长因子β信号,导致干细胞特征的基因过表达,促进细胞增殖和集落形成[10]。而且CEA影响结直肠癌微环境中的免疫细胞浓度,CEA抑制CD8+T细胞向肿瘤中心的迁移,刺激M0巨噬细胞向M2分化,而癌细胞可以与M2巨噬细胞相互作用,进而促进癌细胞增殖、迁移、侵袭和肿瘤新生血管生成[11-12]。在肿瘤微环境中,癌相关成纤维细胞可通过释放可溶性因子来增强肿瘤迁移或创造有利于癌细胞生长和血管生成的生态微环境。CEA可作为癌细胞分泌的循环成纤维细胞活化因子,以旁分泌的方式刺激幼稚成纤维细胞局部分化为癌相关成纤维细胞[13]。因而术前CEA水平升高患者与正常患者的肿瘤生物学特性可能存在差异,进而影响患者的预后,在本研究中也发现术前CEA水平升高的患者AJCC分期更晚,分化程度更低,更易发生周围神经浸润。
指南建议对于结肠癌患者术后的CEA水平进行规律的随访复查[14],而目前结肠癌患者术后的治疗及随访策略主要根据其AJCC分期来制定。本研究结果表明,术前CEA水平升高的患者,预后也较相同AJCC分期的CEA水平正常患者差。因此可考虑在传统AJCC分期中加入术前CEA水平作为一项预后分层指标,以便制定更为合理的治疗方案,如术后更密切的监测及更积极的治疗等。
相对于既往研究,本研究利用SEER数据库样本量大、统计效能高的优势,通过多个回归方程及分层分析来进行敏感性分析以检验结果的可靠性,发现将AJCC分期联合术前CEA水平能够进一步改善AJCC分期的区分度。然而本研究存在以下局限性,首先未能收集到脉管浸润情况、微卫星不稳定和KRAS、NRAS、BRAF基因突变等目前已证实能够影响结肠癌患者预后的指标,已收集到的指标中也有部分数据存在缺失的情况,但我们将这些缺失数据单独分组纳入最终多因素统计分析,因此这些数据缺失不影响本研究核心结果。其次本研究中未能从SEER数据库中收集到患者术后放疗及化疗的数据,使得无法纳入统计分析。最后本研究仅纳入了Ⅰ~Ⅲ期行根治性切除术的结肠癌患者,因此结论不适用于0期、Ⅳ期及未行根治性手术的结肠癌患者。
综上所述,本研究发现术前CEA水平升高的Ⅰ~Ⅲ期结肠癌患者预后较术前CEA水平正常的患者差,这提示术前CEA水平可以作为Ⅰ~Ⅲ期结肠癌患者术后分层管理和个体化监测策略的一项临床指标。未来还需进一步探究CEA水平对结直肠癌患者预后的影响及其分子生物学机制。
