介孔二氧化硅对映选择性吸附的手性印迹调控
2021-10-15宋文尧周张浪杨鑫莉葛广路
宋文尧,周张浪,杨鑫莉,4,陈 岚,葛广路
(1.国家纳米科学中心,中国科学院纳米标准与检测重点实验室,北京100190;2.中国科学院纳米科学卓越中心,北京100190;3.中国科学院大学中丹学院,北京100049;4.中国科学院大学,北京100049)
手性分子广泛存在于自然界生物体中,如蛋白质、核酸核糖等[1].随着化学工业和制药工业的快速发展,对对映体手性纯度的要求也越来越高,迫切需要为分析和拆分对映体开发新的、高效的识别和分离策略[2].功能性的手性多孔材料在介观或宏观尺度上所表现出的超分子手性,在选择性识别、不对称催化、手性吸附及药物输送等方面的应用具有很大潜力,可作为手性吸附与拆分的载体[3~10].
手性介孔二氧化硅(CMS)作为一种常见的无机介孔材料,主要是通过超分子模板手性转录到介孔二氧化硅而得到的[11].这种材料具有特定的螺旋外观结构、介孔结构和螺旋排列的内壁官能团[12].CMS由于具有独特的手性结构和良好的立体选择吸附性能,成为手性吸附与手性拆分理想的候选材料[13,14].此外,CMS性质稳定、骨架结构坚固、形态可控且易于功能化等特点为手性功能材料的设计和制备提供了更多选择[15,16].
丙氨酸外消旋体在吸附工业及生物医药应用领域具有重要作用[17],因此常被用于选择性吸附研究.Mastai等[18]使用手性氨基酸嵌段共聚物作为模板制备了CMS,使用丙氨酸的外消旋体混合物验证了CMS的手性拆分能力.Di等[19,20]制备了具有手性孔结构的单分散CMS微球在对丙氨酸对映体和外消旋体混合溶液的吸附中观察到不对称的优先吸附现象,但均没有给出CMS产生对映选择性吸附的原因.CMS介孔表面并没有不对称官能团,但通过结构导向法制备的CMS会在介孔表面留下手性印迹.Che等[21]最早提出的使用共结构导向剂(CSDA)合成CMS的方法,是将具有手性的表面活性剂超分子模板的手性结构转录到介孔材料的孔道表面,通过使用有机硅烷作为CSDA来建立手性表面活性剂与SiO2骨架之间的结构导向关系.N‐三甲氧基硅基丙基‐N,N,N‐三甲基氯化铵(TMAPS)作为CSDA,一端是带正电的季铵盐基团,可以与阴离子表面活性剂的手性头部基团产生库仑作用,而另一端是能够与硅源共缩合形成SiO2骨架的烷氧基硅烷位点[22].因而,TMAPS可以通过季铵盐基团的静电作用将手性超分子模板的手性结构转录到二氧化硅介孔内壁,形成均匀分布的螺旋排列的手性印迹[23,24].实验证明,螺旋型的CMS棒状结构同时具有六边形的二维介孔结构,但介孔表面呈螺旋排列的CSDA手性印迹是否是手性识别的来源还有待进一步验证[25].
溶剂萃取可以去除表面活性剂并在介孔内表面留下CSDA螺旋排列的手性印迹,但难以用X射线衍射(XRD)等结构分析技术来验证[14].Che等[26]已经证明CSDA的螺旋排列可以通过吸附银纳米颗粒等离子体‐等离子体相互作用来确定.Garcia‐Bennett等[27,28]则是通过酒石酸、缬氨酸和α‐蒎烯等外消旋体混合物的对映选择性吸附来确定使用某一手性鸟苷酸和叶酸制得的CMS是否具有对映选择性,实验证明,鸟苷酸和叶酸可在介孔二氧化硅孔道表面形成手性印迹,可转录模板手性结构到介孔表面.
根据手性超分子模板剂的不同,CMS的合成可采用不同的策略[12,29].本文通过使用手性阴离子表面活性剂C14‐L/D‐AlaA组装作为超分子模板合成CMS,再通过萃取和煅烧两种方法去除原合成CMS残留的表面活性剂,并对其进行再次修饰后对丙氨酸外消旋体混合物的对映选择性吸附能力进行了对比,直观揭示了去除表面活性剂后留下的CSDA手性印迹对对映选择性吸附有直接的影响.研究结果可能在如固相合成肽、农用化学品和医药产品的生产以及生物传感器等领域有广泛的应用前景.
1 实验部分
1.1 试剂与仪器
L‐丙氨酸(L‐Ala)、D‐丙氨酸(D‐Ala)、DL‐丙氨酸(DL‐Ala)、肉豆蔻氯(C14H27COCl)和N‐三甲氧基硅基丙基‐N,N,N‐三甲基氯化铵(TMAPS,质量分数为50%的甲醇溶液)均为分析纯,购自麦克林试剂有限公司;氢氧化钠、浓盐酸(质量分数为37%)、正硅酸乙酯(TEOS)、乙酸乙酯和三乙胺均为分析纯,购自国药集团化学试剂有限公司.
J‐1500型圆二色光谱仪(CD),日本分光JASCO公司;K‐Alpha型X射线光电子能谱仪(XPS),美国Thermo Fisher Scientific公司;ASAP2460型全自动比表面积及孔径分析仪,美国Micromeritics公司;Labsys Evo‐TGA型热重分析仪(TGA),法国Setaram公司;Nicolet iS50型傅里叶变换红外光谱仪(FTIR),美国Thermo Fisher Scientific公司;Tecnai G2 20 S‐Twin型场发射透射电子显微镜(TEM),荷兰FEI公司;Merlin GEMINIⅡ场发射扫描电子显微镜(SEM),德国Zeiss公司;Milli‐Q型超纯水仪,美国Millipore公司.
1.2 实验过程
1.2.1 阴离子表面活性剂的制备所用手性模板剂的合成参考文献[30]方法.以阴离子表面活性剂C14⁃L‐AlaA的合成为例:将L⁃Ala(4.5 g,0.05 mol)和NaOH(2.0 g,0.05 mol)溶解在250 mL去离子水中并滴加7.5 mL三乙胺,在25℃下搅拌混合均匀.然后在冰水浴中将13.25 mL肉豆蔻酰氯滴加到上述混合物中,搅拌1 h后,加入浓盐酸调节pH到1,过滤得到白色固体,并用去离子水洗涤至中性.最后,用乙酸乙酯萃取并多次重结晶,在40℃真空中干燥后得到样品C14‐L‐AlaA.
1.2.2 手性介孔二氧化硅的制备CMS的合成主要参考文献[31]的方法,该方法通过手性阴离子表面活性剂自组装形成螺旋结构的超分子模板,然后引入TMAPS作为CSDA与二氧化硅的前驱体共组装制备而得.阴离子表面活性剂提供的带负电荷的头部基团与CSDA带正电荷的季铵盐基团通过库仑作用结合,而TMAPS的烷氧基硅烷进一步与正硅酸乙酯共缩合形成二氧化硅骨架.典型的合成步骤为:将0.29 g C14‐L‐AlaA溶于20.5 mL去离子水中,于22℃搅拌20 min后加入8.5 g 0.1 mol/L NaOH溶液,室温下继续搅拌1 h形成溶胶.然后加入1.50 g TEOS和0.26 g TMAPS的混合物,在室温下搅拌20 min后静置2 h,形成凝胶状的产物在80℃下固化15 h形成白色固体.白色固体经离心分离、无水乙醇与水多次交替洗涤、于60℃温度下干燥12 h.去除CMS孔道内残留的阴离子表面活性剂,可以采用煅烧和萃取两种方式进行处理.煅烧处理需要在550℃的空气中煅烧6 h.而萃取的方法则是用盐酸和无水乙醇(体积比1∶8)形成的混合溶液在90℃下搅拌12 h,然后离心分离,用去离子水洗涤,烘干12 h后得到去模板的CMS.
1.2.3 原合成CMS反手性印迹的修饰CMS手性吸附的反转是通过对原合成CMS的后修饰实现的,在对原合成CMS进行修饰前,所采取的步骤主要包括将煅烧后得到的0.2 gL‐CMS先在盐酸醇溶液中活化24 h,以使其在孔道表面现成丰富的硅羟基(Si—OH),然后将活化的CMS分散到20.5 mL具有0.29 g相反手性的手性模板剂C14‐D‐AlaA的水溶液中,在22℃下搅拌30 min使其分散均匀,然后加入9.5 mL 0.1 mol/L NaOH溶液后继续搅拌1 h,再加入300 μL TMAPS搅拌20 min后静置2 h,在80℃下固化15 h完成后修饰.获得的白色产物经过离心洗涤、干燥12 h后,得到具有相反手性印迹(L/D‐CI)的样品L‐CMS@D‐CI.
2 结果与讨论
2.1 CMS的结构表征

Fig.1 SEM images of L⁃CMS(A)and D⁃CMS(B)and TEM image of CMS(C)
由图1(A)和(B)可以看出,L‐CMS/D‐CMS具有螺旋棒状结构,可以直接观察到螺旋方向的不同,长度为2~3 μm.TEM照片[图1(C)]中箭头所示处的有序条纹证明CMS具有高度有序且径向排列的螺旋孔道,这与Che等[14]所报道的结果一致.螺旋方向不同的棒状外形和有序的螺旋孔道结构均受手性模板剂、CSDA、溶液的pH值及反应过程中搅拌速度、反应时间和温度等因素的影响[32].CMS的氮气吸附‐脱附等温线如图2(A)所示,没有滞后环,且孔径分布在2.1~3.5 nm之间[图2(B)],是比较典型的介孔材料[33].L‐CMS和D‐CMS的比表面积分别为634.2和563.4 m2/g,相对压强(p/p0)在0.4附近,孔体积为0.46和0.45 cm3/g,表明CMS为均匀的介孔结构.
2.2 CMS的对映选择性吸附
为了评估CMS的手性识别及对映选择性吸附能力,用盐酸醇溶液洗掉残留的模板剂得到L‐CMS和D‐CMS,使用CD光谱分别检测了其对同手性丙氨酸分子的吸附能力,通过与吸附相反手性丙氨酸分子的能力进行比较得到其对映选择性.然后进一步通过CD光谱直观验证了CMS对丙氨酸外消旋体混合溶液的对映选择性吸附能力.为了避免颗粒散射或孔内分子取向对CD信号的任何潜在影响,测量溶液中残留丙氨酸对映体分子的CD信号从而确定CMS的吸附程度[34].
单一分子吸附测试使用了0.1 mmol/L的L‐Ala和D‐Ala水溶液,然后将5 mg的L‐CMS和D‐CMS材料分别加入到同手性的上述溶液中.如图3(A)和(C)所示,由CD光谱可以观察到,随着吸附时间的变化,因丙氨酸对映体分子被吸附而导致CD信号逐渐减弱,4 h后基本达到吸附平衡.根据椭圆度与浓度的关系θ=(100[θ]lc)/M(其中,θ是椭圆度;[θ]是摩尔椭圆度;l是波长;c是丙氨酸的浓度;M是丙氨酸的摩尔质量),并利用浓度的标准曲线可以计算CMS对丙氨酸分子的吸附量[19].如表1所示,L‐CMS和D‐CMS在4 h的最大吸附量分别为135和127 mg/g.选择性吸附的能力则由α=Qcon/Qin(其中,α是对映选择性因子;Qcon是对同手性丙氨酸分子的吸附量;Qin是对不同手性丙氨酸分子的吸附量)定义[19],得到L‐CMS和D‐CMS的对映选择性分别为1.36和1.35.图3(B)和(D)中CD信号的强弱变化直观显示了CMS对丙氨酸外消旋体混合物的对映选择性吸附程度.虽然L‐CMS和D‐CMS对DL‐Ala外消旋体的最大吸附能力略有差异[图3(B)和(D)],但仍旧可以清晰地看到其对外消旋体混合物中某个对映体的选择性吸附倾向,我们把这个现象称之为“相似相吸”.这主要是因为修饰于孔道表面的TMAPS呈螺旋排列的手性印迹的存在,而这些TMAPS分子的排列方式取决于手性模板剂初始的排列取向,因而也就能优先吸附与之排列方向相似的手性分子[12].
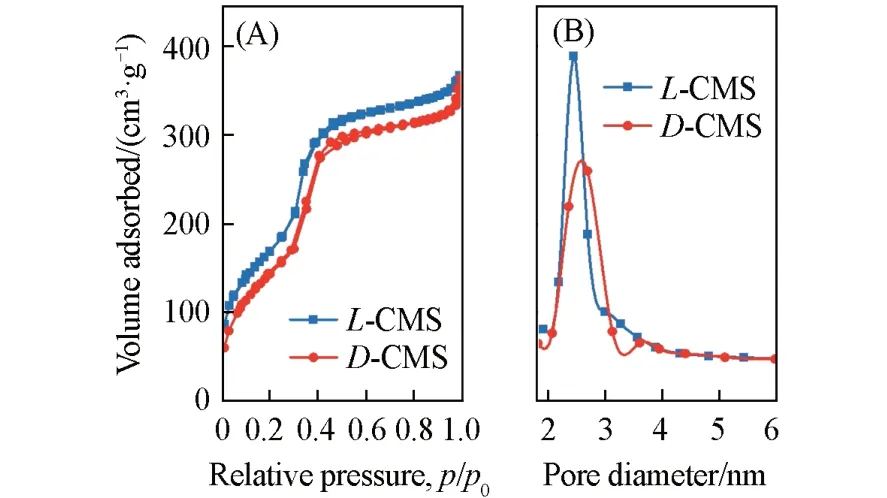
Fig.2 N2 adsorption⁃desorption isotherms(A)and corresponding pore size distributions(B)of L⁃CMS and D⁃CMS
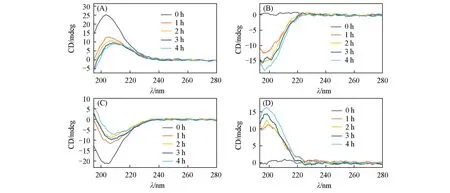
Fig.3 Circular dichroism(CD)spectra of alanine enantioselective adsorption on CMSs
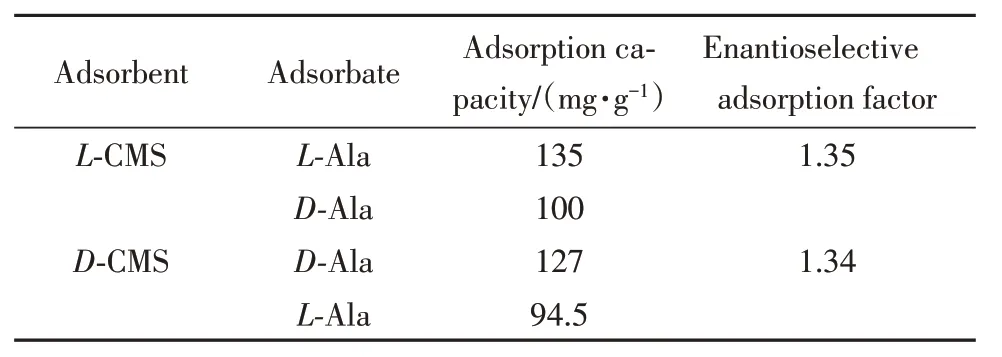
Table 1 Adsorption comparison of alanine by L⁃CMS and D⁃CMS*
为了证明TMAPS在介孔表面螺旋排列的手性印迹是否是CMS对映选择性吸附的关键,对合成的L‐CMS进行煅烧处理,并与溶剂萃取处理的结果进行比较.经过煅烧处理的L‐CMS对DL‐Ala外消旋体的吸附不具有选择性[图4(A)],而经过盐酸醇溶液萃取得到的CMS对外消旋体混合物的吸附具有对映选择性[图3(B)和(D)].由图4(B)所示,经过600℃的高温煅烧CMS的TGA失重曲线缓慢下降,表明材料中已无有机组分.而盐酸醇溶液萃取得到的CMS则有2个明显的失重峰:第一个峰在150~300℃之间,可归因于在合成过程中键合在CMS介孔表面TMAPS的季铵盐官能团的氧化分解;第二个峰在400~550℃之间,是由于二氧化硅表面的硅醇基团缩合导致二氧化硅骨架脱水所致.季铵盐的分解对应着手性印迹的破坏,导致对映选择性吸附能力的丧失,而硅羟基的减少(与红外光谱中Si—OH峰强度降低一致)进一步导致了CMS吸附活性的降低[27].如图4(C)所示,通过对比分析XPS全谱,可见盐酸醇溶液萃取后的CMS具有N1s峰,这也与盐酸醇溶液处理过的CMS保留了TMAPS(含N元素的季铵盐基团)有关.红外光谱[图4(D)]中的2个样品均具有二氧化硅的特征峰,Si—O—Si的弯曲振动峰出现在463.3和455.2 cm−1处,Si—O—Si对称伸缩振动峰在798.4和792.6 cm−1处,Si—O—Si的不对称伸缩振动吸收峰在1081.3和1076.4 cm−1处,Si—OH的反对称伸缩振动峰位于3447.2和3445.5 cm−1处,表明不同的后处理方法均保留了二氧化硅框架[35].图4(D)显示,由于—OH较强的红外吸收作用,只能观察到季铵盐基团[—(CH3)3N+]中—CH3在1478.2 cm−1处的变形振动峰,进一步证明了TMAPS的存在.虽然不同后处理方法均能保留二氧化硅的框架,但只有盐酸醇溶液萃取处理过的CMS保留了TMAPS(含有季铵盐基团),而TMAPS在CMS介孔表面组成的手性印迹是对映选择性吸附的关键.
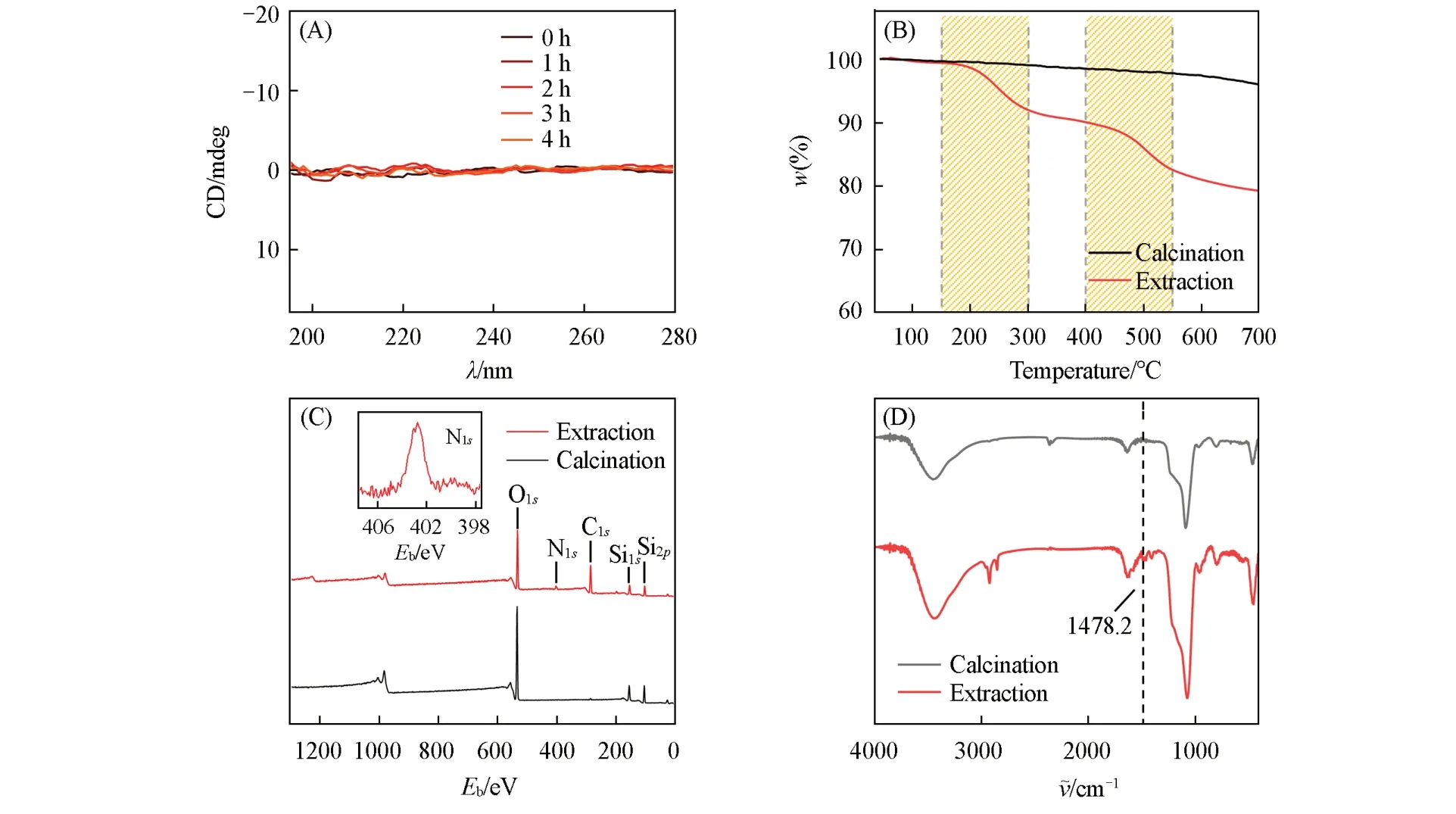
Fig.4 CD spectra of DL⁃Ala enantioselective adsorption on L⁃CMS after calcination(A),TGA curves(B),overall XPS survey spectra(C)and FTIR spectra(D)for the CMSs after calcination and extraction
2.3 原合成CMS的手性印迹反转
CMS介孔表面的修饰有益于药物递送等应用[36,37],这里重点考查了孔道内表面修饰与原阴离子表面活性剂超分子模板手性相反的超分子模板能否诱导TMAPS排列形成反向手性印迹,是否能诱导手性印迹的反转.实验中使用与原合成CMS手性相反的手性阴离子表面活性剂作为超分子模板与TMAPS混合,使其修饰于孔道表面,分别形成具有相反手性印迹的D‐CMS@L‐CI和L‐CMS@D‐CI.如图5(A)所示,在不改变原合成CMS形貌和孔道结构的情况下,通过使用不同手性超分子模板剂在孔道表面诱导产生相反的手性印迹,实现对孔道表面手性印迹的原位调控.DL‐Ala外消旋体的对映选择性吸附实验[图5(B)和(C)]直观地表明经过长时间(12 h)的吸附,介孔表面修饰后的CMS可以实现对外消旋体的对映吸附,对映吸附时间的延长可能与孔道内扩散困难有关[28].实验结果证实了通过对孔道表面分子印迹的调控可以使CMS的手性响应(识别及吸附)发生反转,并确定了CMS材料的吸附手性源自手性阴离子表面活性剂超分子模板的组装取向经TMAPS转录至CMS介孔表面而形成相应的手性印迹,从而使原合成CMS具有了可调控的对映选择性吸附及分离的能力.
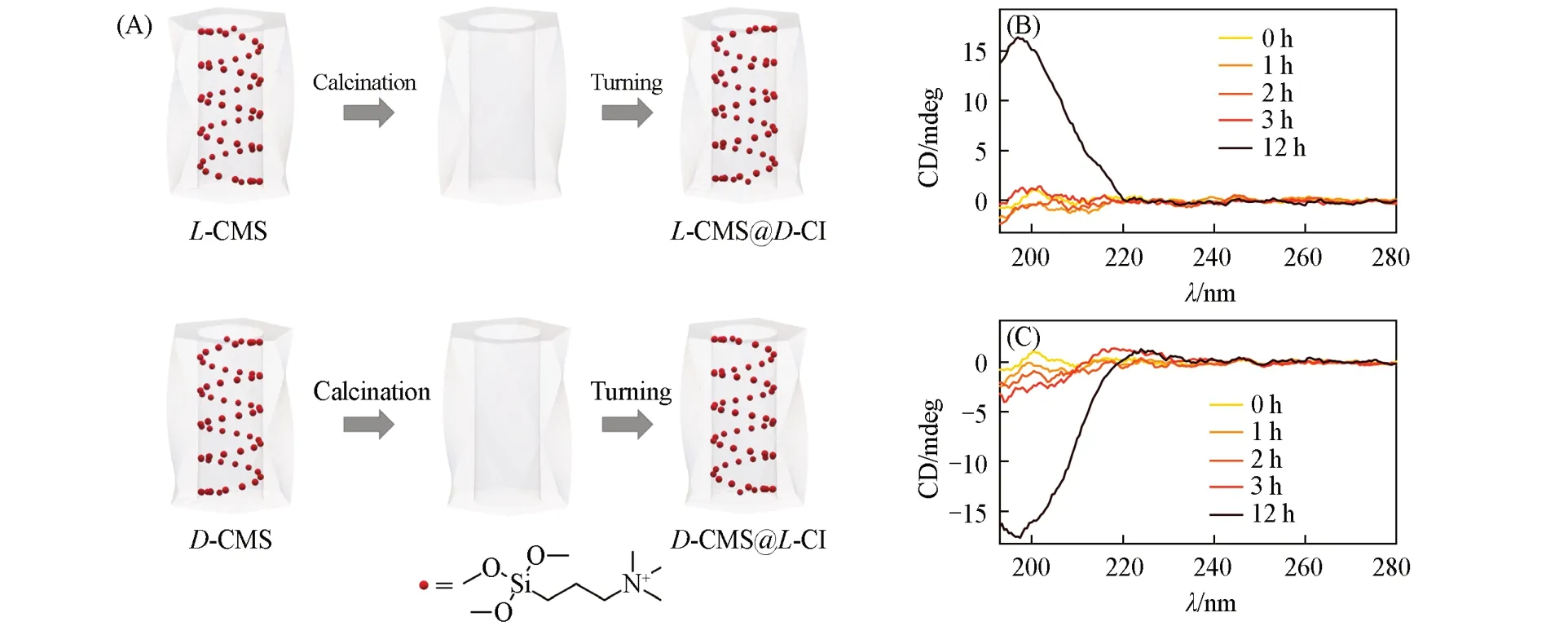
Fig.5 Schematic of chiral imprinting(A)and CD spectra(B,C)of DL⁃Ala enantioselective adsorption on CMSs after chiral imprinting turning
3 结 论
使用TMAPS辅助组装的手性阴离子表面活性剂超分子模板制备CMS,运用圆二色谱原位监测了CMS的吸附过程,并成功实现了对丙氨酸外消旋体混合物的对映选择性吸附与分离.对比煅烧和萃取两种去除模板的方法,发现煅烧后的CMS不具备对映选择性吸附,这可能是因为介孔表面的TMAPS的手性印迹被破坏所致.而手性超分子模板诱导TMAPS排列产生手性印迹的方法可实现在原合成CMS介孔表面进行修饰从而产生反向手性印迹和反向对映选择性吸附的目的.实验证明,CMS的对映选择性吸附主要是由手性超分子模板诱导TMAPS在介孔表面组成的手性印迹所致.此手性超分子模板诱导手性印迹的修饰方法具有一定的普适性,可根据需要对介孔材料手性特征进行合成后调控,对于立体选择性识别、不对称催化、农用化学品和医药产品的生产以及生物传感器等方面的应用具有一定的指导意义.