阳离子共价有机框架对水中非甾体药物的强化去除
2021-10-15颜艳红李舒晴汤西豪郑盛润蔡松亮章伟光顾凤龙
颜艳红,李舒晴,汤西豪,郑盛润,,蔡松亮,,章伟光,,顾凤龙
(1.华南师范大学化学学院,环境理论化学教育部重点实验室,2.华南师范大学化学学院,广州市生物医药分析化学重点实验室,广州510006)
非甾体抗炎药(NSAIDs)用途广泛,可通过尿液、生活废水和废弃过期药物排放到环境中,最终对人体健康和生态系统产生深远且不可恢复的影响[1~3].双氯芬酸钠是一种常用的NSAID,其在水环境中的广泛存在会对水生生物产生肾脏损伤等不良影响[4,5].NSAIDs往往难以降解,它们的长期存在会对环境造成较严重的污染[2].因此,迫切需要开发有效策略以从水生环境中除去这些污染物.
通过吸附来去除有毒污染物由于具有简单、安全和清洁等优点而备受关注.目前报道的吸附剂种类较多,如多孔商业活性炭[6,7]、生物质衍生吸附剂[8]和纳米颗粒[9]等,但它们大多吸附性能有限.与传统的吸附剂相比,共价有机框架(COFs)具有规则的孔道、较大的表面积、低密度和优异的稳定性等特点[10].通过合理的结构设计,系列可用于高效去除目标污染物的COFs材料已被合成出来[11],一些COFs吸附剂已被用于水中NSAIDs的有效去除[12~17].例如,Mellah等[12]制备了一种新型的含氟COF,其对亲脂性药物布洛芬具有很高的亲和力,这揭示了疏水相互作用对吸附药物污染物具有重要作用.Liu等[14]合成了磺酸功能化COF-SO3H,其主要通过π-π堆积和氢键作用实现对多种药物的有效吸附,其中对双氯芬酸的饱和吸附容量可达770 mg/g.Wang等[15]设计并制备了两种含不同官能团的COF-NO2和COF-NH2材料,通过COFs官能团的调控以增强其与药物分子的氢键等作用,从而实现了对废水中酮洛芬的选择性去除.综上所述,将COFs用于去除NSAIDs的多数研究工作主要依靠疏水作用、π-π堆积和氢键作用,但构筑离子型COFs以增加静电作用来提高对NSAIDs的吸附性能的相关报道却很少见.在过去几年中,离子选择性吸附剂的构建引起了越来越多的关注[18~21].研究表明,COFs的孔道结构和电荷是影响其吸附性能的主要因素,通过调节孔结构和表面电荷有可能实现更高的吸附能力或更快的吸附动力学[22~24].
本文使用三醛基间苯三酚(TFP)分别与溴化乙锭(EB)和4,4'-二氨基联苯(BND)进行席夫碱反应,合成了β-酮烯胺类中性TFP-BND COF和阳离子型TFP-EB COF.以双氯芬酸钠(DCF-S)和对氨基水杨酸钠(PAS-S)作为研究对象,探究了阳离子型和中性COFs对NSAIDs污染物的吸附性能.研究表明,通过引入阳离子型EB功能基团到框架结构中可以有效增强COFs对NSAIDs的吸附能力.此外,本文还探讨了竞争离子和温度等环境因素的影响及吸附机理.
1 实验部分
1.1 试剂与仪器
溴化乙锭、双氯芬酸钠和对氨基水杨酸钠购于阿拉丁生化科技股份有限公司;三醛基间苯三酚购于腾骞生物有限公司;4,4'-二氨基联苯购于天津市大茂化学试剂厂;1,3,5-三甲苯、1,4-二氧六环、四氢呋喃(THF)、甲醇、氯化钠、N,N'-二甲基乙酰胺和丙酮购自天津市致远化学试剂厂;所用试剂均为分析纯.
Ultima IV型X射线粉末衍射仪(PXRD,日本Rigaku公司);Spectrum Two型傅里叶变换红外光谱仪(FTIR,美国PerkinElmer公司);STA 409 PC型热重分析仪(TGA,德国Netzsch公司);Gemini 500型扫描电子显微镜(SEM,德国Zeiss公司);ASAP 2020 Plus型表面积和孔隙率分析仪(美国Mike公司);Zetasizer Nano ZS90型电位分析仪(英国Malvern公司);UV-2700型紫外-可见分光光度计(UV-Vis,日本岛津公司).
1.2 COFs的制备
参照文献[25]和[26]方法制备TFP-EB和TFP-BND COFs.合成路线如Scheme 1所示.将TFP(21 mg,0.10 mmol)、EB(59 mg,0.15 mmol)和1.0 mL 1,4-二氧六环/1,3,5-均三甲苯(1/1,体积比)置于反应瓶中;使用氩气鼓泡15 min后加入0.1 mL乙酸溶液(6 mol/L);将所得混合物继续用氩气鼓泡15 min后快速密封,于120℃反应72 h;反应完成后冷却至室温,抽滤收集固体,依次用去离子水、THF和甲醇洗涤,并用THF索氏提取24 h;于100℃真空干燥后得到红色的TFP-EB COF固体(产率:82%).TFP-BND COF的合成方法见本文支持信息Text S1.
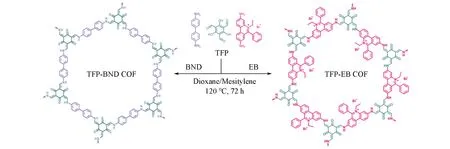
Scheme 1 Synthesis of TFP⁃EB and TFP⁃BND COFs
1.3 COFs对NSAIDs的吸附等温线吸附及动力学
将3.0 mg COFs粉末分散在15 mL不同初始浓度的NSAIDs水溶液中,并于黑暗环境、室温下搅拌24 h,离心、收集上清液,通过测试UV-Vis光谱获得吸附等温线.
取5.0 mg活化处理的COFs粉末于离心管中,加入10 mL浓度为20 mg/L的NSAIDs水溶液进行吸附动力学实验.在给定时间收集2.0 mL上层清液并通过0.22 μm水系滤膜后进行UV-Vis测试,测试后立即倒回原始环境中,以t时刻的吸附量qt(mg/g)对吸附时间t(min)作图,获得吸附动力学曲线.
1.4 温度和竞争离子对NSAIDs吸附的影响
配制初始浓度为50 mg/L的NSAIDs溶液,将3.0 mg TFP-EB COF分散在15 mL NSAIDs溶液中,在288~328 K的温度范围内进行吸附,持续搅拌24 h达到吸附平衡,离心、收集上清液,通过UV-Vis测试吸光度,用于热力学方程拟合.将29.0 mg NaCl,59.5 mg KBr,50.5 mg KNO3,71.0 mg Na2SO4,53.0 mg Na2CO3,42.0 mg NaHCO3和190.1 mg Na3PO4·12H2O分别置于50 mL容量瓶中,加入配制好的200 mg/L的NSAIDs溶液定容至刻度线,制备成含0.01 mol/L干扰离子的NSAIDs溶液.同样将3.0 mg TFPEB COF分散在15 mL含不同竞争离子的NSAIDs溶液中,并于黑暗环境、室温下搅拌24 h,离心、收集上清液,测试UV-Vis光谱.
2 结果与讨论
2.1 COFs的表征
图1 和图S1(A)(见本文支持信息)给出了2种COFs材料的PXRD谱图.2种COFs材料均显示出强的衍射峰,表明其具有较高的结晶度.TFP-EB COF在3.6°,6.0°,7.3°和9.3°处出现的衍射峰可分别归属为(100),(110),(200)和(210)晶面,在26.6°处出现的宽峰对应(001)晶面[27].TFP-BND COF在3.3°,6.6°和9.3°处出现衍射峰,分别对应(100),(110)和(200)晶面[图S1(A)].实验测得的PXRD谱图与AA堆积模式的模拟谱图较为匹配,表明TFP-EB和TFP-BND COFs都采取AA堆积模式,这与文献报道的结果类似[25,28].
图2 和图S1(B)(见本文支持信息)分别为TFPEB和TFP-BND COFs的FTIR谱图,图 中1579和1588 cm−1处出现的特征峰可归属于C=C伸缩振动,在1277和1271 cm−1处的特征峰归属于C—N伸缩振动,表明发生了烯醇-酮互变异构[29].此外,起始原料的醛C=O伸缩振动的特征带消失了,这意味着单体之间缩合完全.图3和图S1(C)(见本文支持信息)给出TFP-EB和TFP-BND COFs的SEM照片,二者分别呈现出珊瑚枝状和片状两种不同的形貌.
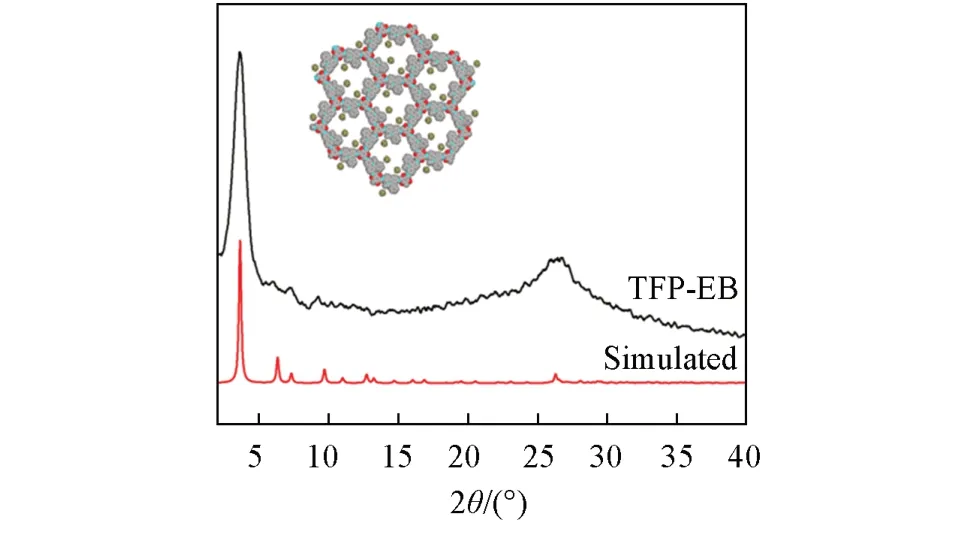
Fig.1 Experimental PXRD pattern of TFP⁃EB COF and simulated PXRD pattern for the AA eclipsed stacking model
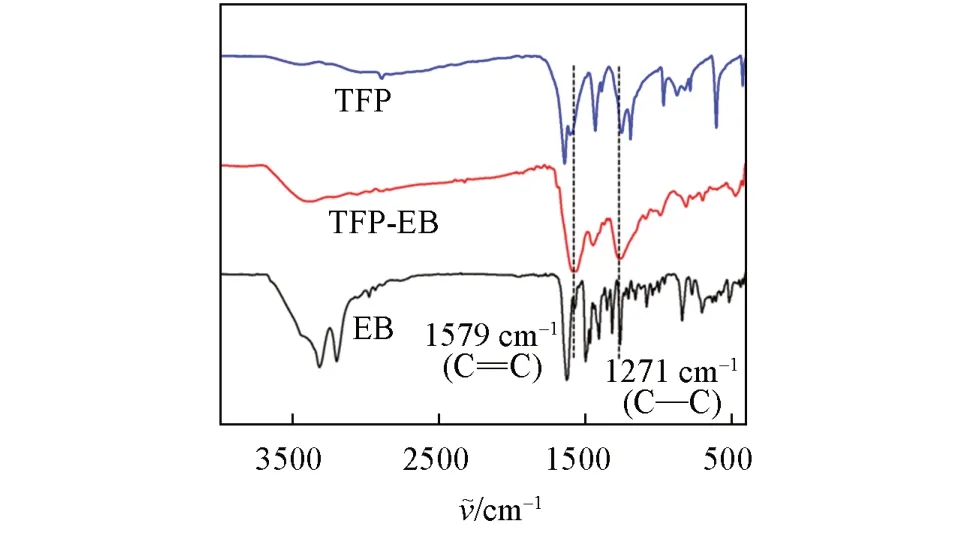
Fig.2 FTIR spectra of TFP,EB and TFP⁃EB COF

Fig.3 SEM image of TFP⁃EB COF
如图4和图S1(D)(见本文支持信息)所示,TFP-EB和TFP-BND COFs的氮气吸附-脱附等温线属于I型,表明所得COFs为典型的微孔材料.由图4(B)可见,TFP-EB显示出狭窄的孔径分布.利用局部密度泛函理论(NLDFT)计算出孔径分布主要集中在1.58和1.85 nm左右.利用Brunauer-Emmett-Teller(BET)模型计算,TFP-EB和TFP-BND COFs的比表面积分别为724和368 m2/g(图S2,见本文支持信息).热重分析(TGA)曲线表明这2种COFs材料具有良好的热稳定性(图S3,见本文支持信息).
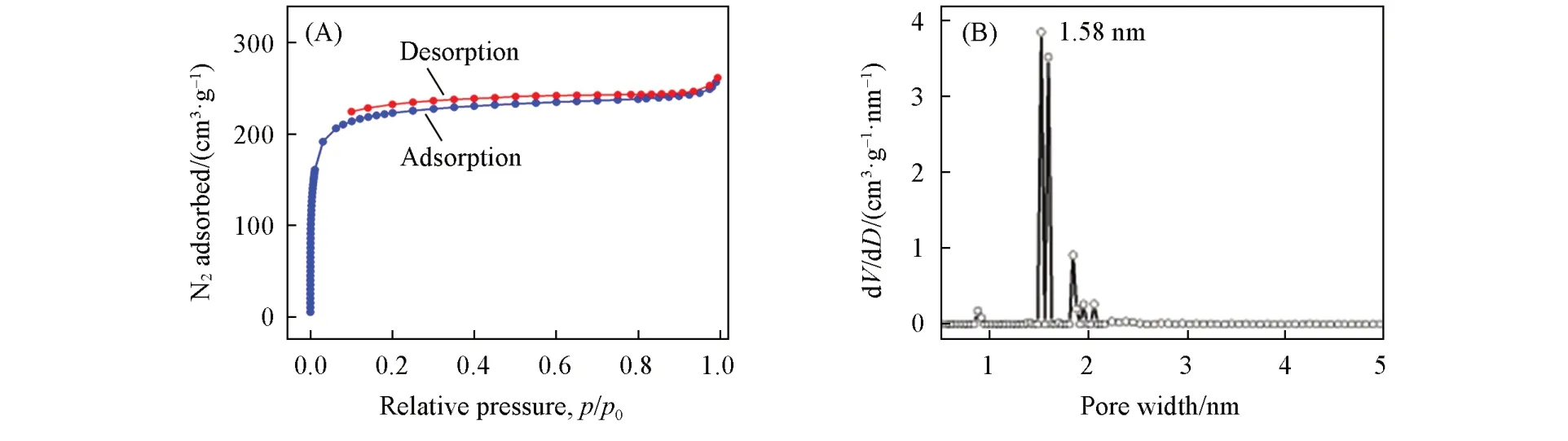
Fig.4 Nitrogen adsorption⁃desorption isotherms(A)and pore size distribution profile(B)of TF⁃EB COF
2.2 COFs的吸附性能
选择DCF-S和PAS-S 2种NSAIDs污染物作为研究对象评估2种COFs的吸附性能.由图5(A)可见,阳离子型TFP-EB COF对NSAIDs的吸附量随着NSAIDs浓度的增加而升高,然后基本保持不变.当NSAIDs的浓度分别为128和174 mg/L时,其对DCF-S和PAS-S的饱和吸附容量分别高达350.4和145.4 mg/g.然而在相同吸附条件下,中性TFP-BND COF对DCF-S和PAS-S的饱和吸附容量分别仅有59.7和13.6 mg/g[图5(B)].TFP-EB COF优异的吸附能力主要归因于NSAIDs与TFP-EB COF孔道中的溴化乙锭基团之间存在强的静电相互作用.采用表S1(见本文支持信息)所示的Langmuir,Freundlich和Tempkin 3种等温吸附模型来拟合实验数据,拟合结果见图S4(见本文支持信息).表S2(见本文支持信息)给出TFP-EB COF对DCF-S和PAS-S吸附数据,与Langmuir模型拟合所得数据相吻合,相关系数R2分别大于0.999和0.99,表明TFP-EB COF对DCF-S和PAS-S的吸附更符合单层吸附模型[30].表S3(见本文支持信息)列出了其它已报道的多孔吸附剂对DCF-S的吸附容量,可见TFP-EB COF对DCF-S的吸附能力比其它吸附剂如沸石[31]、活性炭[7]和新型MOFs[7]等更高.
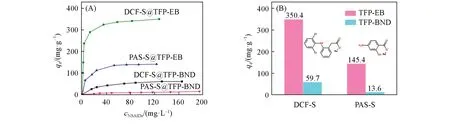
Fig.5 Adsorption isotherms for NSAIDs on TFP⁃EB and TFP⁃BND COFs(A)and comparison of the adsorption amounts of NSAIDs by TFP⁃EB and TFP⁃BND COFs(B)at 298 K for 24 h
根据吸附容量实验结果,进一步研究了COFs的吸附动力学(NSAIDs溶液浓度为20 mg/L).由图6(A)和(C)可见,TFP-EB COF对DCF-S呈现出超快的吸附动力学,在1 min时去除率为84.6%,在30 min后去除率可达93.8%.而TFP-BND COF对DCF-S的吸附能力十分有限,30 min后仅为38.4%[图6(B)和(C)].由图6(D)和(F)可见,TFP-EB COF对PAS-S同样表现出快的吸附动力学,30 min后去除率为89.2%;而30 min后TFP-BND COF对PAS-S的去除率仅有5.0%[图6(E)和(F)].与中性TFP-BND COF相比,将离子型构筑单元引入到TFP-EB COF框架结构中可有效增强对DCF-S和PAS-S的去除效率[图6(C)和(F)].这是由于经电荷调控后的TFP-EB COF材料表面与被吸附物的活性位点之间存在高亲和力的静电相互作用,有利于NSAIDs扩散到孔道内,从而快速达到吸附平衡[32].
利用拟一级和拟二级动力学方程研究了COFs对NSAIDs的吸附动力学(表S4,图S5和图S6,见本文支持信息).表S2列出了拟二级速率常数(K2)、平衡容量和相关系数(R2).吸附数据与拟二级动力学模型拟合较好,R2皆高于0.999,且理论与实验平衡吸附容量相当,表明2种COFs对NSAIDs的吸附通过化学过程控制[30].DCF-S和PAS-S吸附的拟二级速率常数分别为0.194和0.092 g·mg−1·min−1).
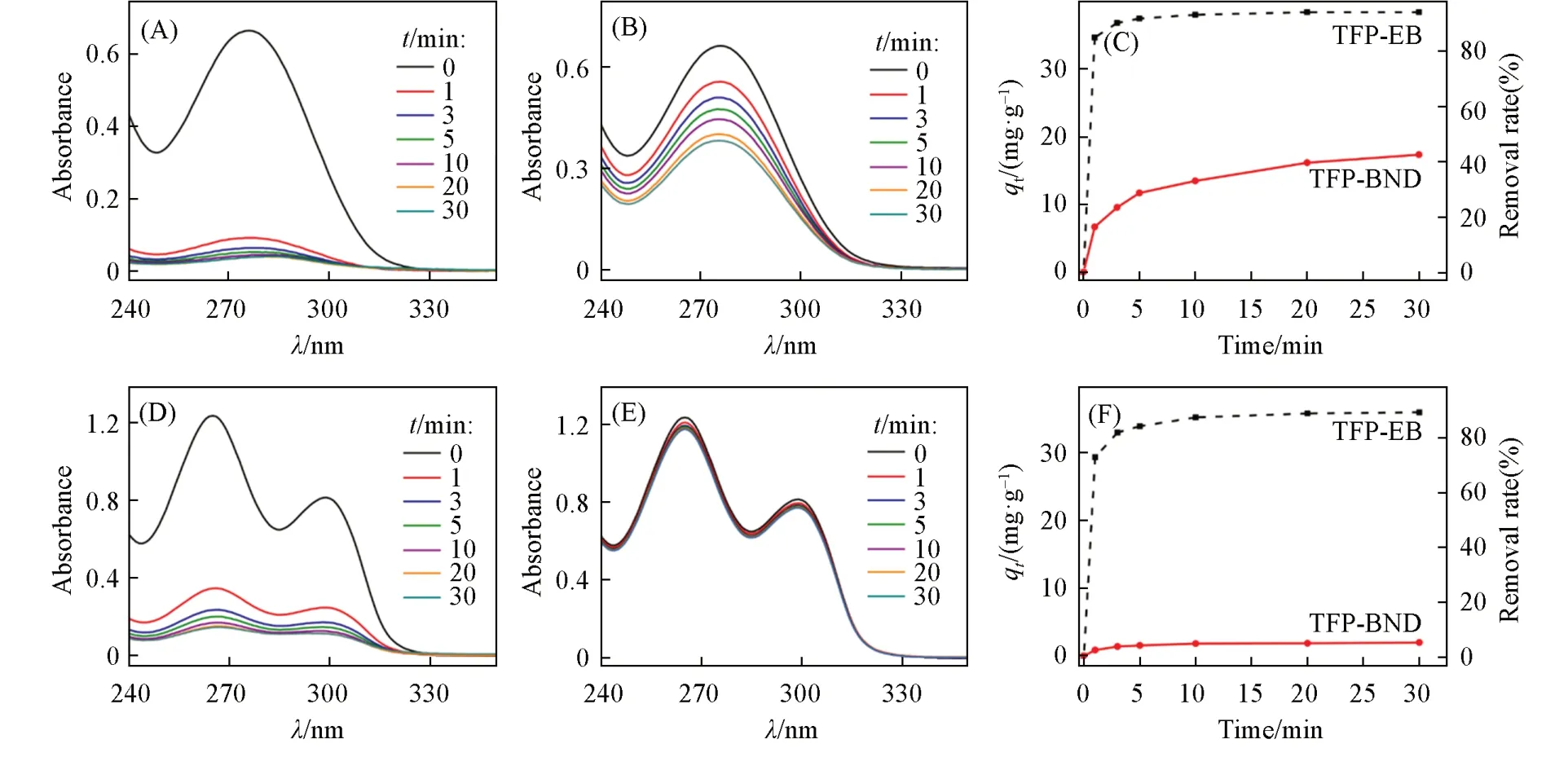
Fig.6 UV⁃Vis spectra(A,B,D,E)of DCF⁃S(A,B)and PAS⁃S(C,D)in aqueous solutions with TFP⁃EB(A,D)and TFP⁃BND(B,E)COFs and effects of contact time on adsorption capacity for DCF⁃S(C)and PAS⁃S(F)
图S7和表S5(见本文支持信息)示出了温度对TFP-EB COF去除NSAIDs的影响.随着温度升高,TFP-EB COF对2种NSAIDs的吸附量均降低,表明2种药物在TFP-EB COF上的吸附机制相同(图S7).由表S5可知,吸附平衡常数(Kd)值随着温度的升高而减小,温度升高吸附量会降低,吸附容量从而降低,并且所有的焓变ΔH0—<0,说明吸附过程皆为放热过程.在测试温度范围内,TFP-EB COF吸附DCF-S和PAS-S的吉布斯自由能变ΔG0—<0,表明该吸附过程是自发进行的[33].与熵变ΔS0—(−78.484和−114.941 J·mol−1·K−1)相比,ΔH0—(−34.104和−38.056 kJ/mol)呈现出更高的数值,表明焓变是该吸附过程的主要驱动力[34].
通过向DCF-S和PAS-S溶液中添加0.01 mol/L共存阴离子(包括Cl−,Br−,SO42−,NO3−,HCO3−,CO32−和PO43−),研究了TFP-EB COF在竞争离子下的吸附性能.由图7(A)可见,当存在竞争离子时,TFP-EB COF对DCF-S仍表现出优异的选择性吸附.由图7(B)可见,对于TFP-EB COF对PAS-S药物溶液的吸附,除SO42−以外,其余的共存阴离子明显会影响其吸附容量,主要是因为这些阴离子和目标药物分子在TFP-EB COF上存在强烈的吸附竞争[23].这一结果说明,TFP-EB COF孔壁上溴离子与阴离子药物之间的离子交换导致静电相互作用,从而使得药物分子被吸附[20,35].可见,TFP-EB COF材料可作为去除水中NSAIDs污染物的良好吸附剂.
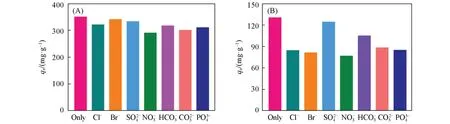
Fig.7 Effect of coexistence of competing anions on the adsorption of DCF⁃S(A)and PAS⁃S(B)on TFP⁃EB COF at 298 K for 24 h
2.3 吸附机理
COFs作为一种高度多孔的晶态高分子聚合物,在吸附和分离方面受到越来越多的关注,具有成为高效吸附剂的潜力,因此很有必要研究其吸附机理.在吸附DCF-S后,TFP-EB@DCF-S的FTIR光谱在1573和1278 cm−1处出现特征峰,可分别归属为DCF-S中羰基(C=O)和亚胺(—NH)的伸缩振动[图S8(A),见本文支持信息].在吸附PAS-S后,所 得TFP-EB@PAS-S的FTIR光谱在3401和1632 cm−1处出现特征峰,可分别归属为PAS-S中氨基(—NH2)和羰基(C=O)的伸缩振动[图S8(B),见本文支持信息].证实这些药物分子被TFP-EB COF吸附.由图S9和S10(见本文支持信息)可见,在吸附药物分子后,TFP-EB COF仍具有较好的结晶度,表明该COF框架结构得以保留,具有良好的稳定性.
DCF-S和PAS-S主要以羧酸阴离子形式存在于水环境中,而TFP-EB COF的Zeta电位为正(38.9 mV).因此,带正电的吸附剂表面(来自EB单体)与NSAIDs阴离子之间可能存在强静电相互作用,使阴离子NSAIDs可以被快速吸附[36].
图8 给出TFP-EB COF与不同浓度的药物溶液作用达到平衡后的Zeta电位.可见,随着添加的药物初始浓度的增加,材料的Zeta电位越来越小.这是由于随着更多的NSAIDs被吸附到材料表面,静电相互作用后导致Zeta电位逐渐降低[37].同时,TFP-EB COF的孔径分布集中在1.58 nm,尺寸较小的DCFS和PAS-S容易进入孔内并与孔壁上的活性位点发生作用[23,38].由于DCF-S中的亚胺基(—NH)与COFs中的羰基(C=O)可形成氢键作用,而PAS-S中的氨基(—NH2)和羟基(—OH)易与COFs之间形成氢键,且COFs和NSAIDs结构中存在丰富的芳香环,故中性TFP-BND COF对DCF-S和PAS-S的吸附主要归因于TFP-BND COF与NSAIDs分子之间形成π-π堆积和氢键作用,吸附容量分别为59.7和13.6 mg/g;而含离子型构筑单元的TFP-EB COF对DCF-S和PAS-S吸附容量分别高达350.4和145.4 mg/g,说明静电吸附在吸附过程中占主导作用(图9).DCF-S与PAS-S相比具有更高的吸附容量,可能是由于DCF-S与吸附剂之间形成的相互作用比PAS-S更强.以上结果表明,TFP-EB COF对DCF-S和PAS-S的吸附机理主要是静电相互作用,而π-π堆积和氢键作用对吸附性能的影响相对较小.
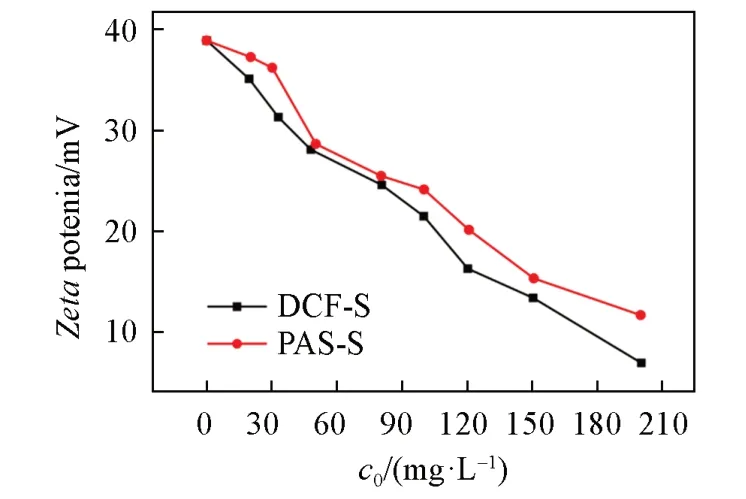
Fig.8 Zeta potential of TFP⁃EB COF after the adsorption of NSAIDs
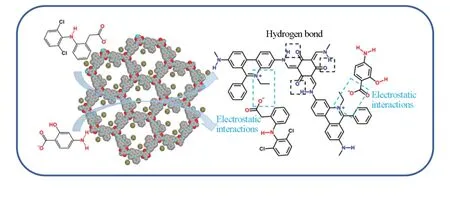
Fig.9 Proposed adsorption mechanism for removal of NSAIDs via TFP⁃EB COF
2.4 脱附和循环使用性能
分别使用甲醇和饱和氯化钠甲醇溶液作为解吸溶剂研究了TFP-EB COF的脱附和循环使用性能.由图S11(见本文支持信息)所示,使用饱和氯化钠甲醇溶液作为解吸溶剂时可获得更高的解吸效率.由于氯化钠会破坏阳离子COFs材料与阴离子NSAIDs分子间的静电作用,同时甲醇优异的解吸能力与其适当的极性和氢键结合能力有关[17],因此使用饱和氯化钠甲醇溶液时能获得更高的解吸效率.
由图10可见,经过4次循环使用后,TFP-EB COF材料对DCF-S吸附能力仍保留了近90%,而对PAS-S则保留了近85%的吸附能力,表明TFP-EB COF吸附剂具有良好的循环使用性能.
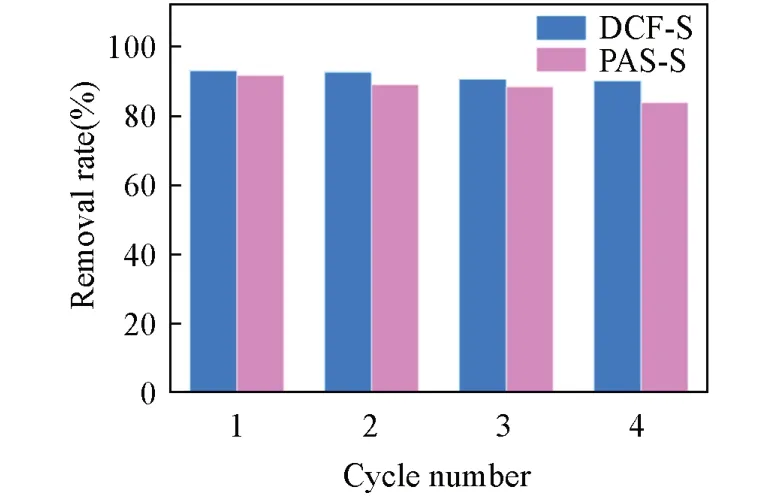
Fig.10 Recycling test for TFP⁃EB COF on the removal of NSAIDs at 298 K for 24 h
3 结 论
通过溶剂热法合成了二维阳离子型TFP-EB COF材料.NSAIDs药物吸附实验表明,TFP-EB COF对DCF-S和PAS-S均显示出良好的吸附性能,吸附容量分别为350.4和145.3 mg/g.吸附等温数据与Langmuir模型较吻合,吸附动力学数据与拟二级动力学模型吻合较好.热力学研究表明吸附为放热过程且具有自发性.此外,通过与中性TFP-BND COF的吸附实验对比,证实了TFP-EB COF对NSAIDs的吸附主要依靠静电相互作用,而π-π堆积和氢键作用对其吸附性能的影响相对较小.本文研究结果表明,通过COFs电荷的调控,可有效提高其对NSAIDs污染物的吸附性能.同时也证明了所得阳离子型TFP-EB COF是一种高效的吸附剂,用于水中NSAIDs污染物的去除具有良好的应用前景.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210417.